双峰驼血清IgG纯化及其抗血清制备
贾存瑜,韩熙梦,聂佳琪,张 欣,焦韵洁, 刘宝元,周恩民,穆 杨
(西北农林科技大学 动物医学院/农业部兽用药物与诊断技术陕西科学观测实验站,陕西杨凌 712100)
免疫球蛋白G(IgG)是机体血清中的主要抗体成分,约占血清抗体的75%,是体液免疫应答中发挥抗感染免疫的主要活性物质。骆驼血清中有3种类型的 IgG,分别为 IgG1、 IgG2 和 IgG3,其中 IgG1 为传统抗体,IgG2 和 IgG3 为重链抗体(Heavy-chain only antibodies, HcAbs),在骆驼科动物中占IgG 总量的45%~75%[1-3]。与传统的IgG1型抗体不同,重链抗体是一类缺失轻链和重链第一个恒定区(CH1)的新型抗体,这种缺失轻链的重链抗体可变区(Variable domains of Camellidae heavy chain-only antibodies, VHH)晶体结构呈椭圆形,长 4 nm,直径2.5 nm,分子质量约15 ku,因此又被称为纳米抗体(Nanobody, Nb)。Nb是目前已知最小的具有完整抗原结合功能的抗体片段[4-5]。相比于常规抗体的抗原结合区,纳米抗体的单结构域性质具有独特的特征,除了容易从体内成熟文库中克隆和选择高亲和力结合物的优点外,纳米抗体还具有其他技术、功能和生物物理学优势,如高表达产率和易于纯化、高度可溶且稳定、识别独特的构象表位等。纳米抗体具有较高的特异性,而且由于纳米抗体结构简单,更便于被基因工程改造、重组表达和生产等[6-7]。目前已报道获得多种抗原的纳米抗体,抗原从小分子(如半抗原和肽)到大抗原(如蛋白质或病毒)都有[8]。制备纳米抗体常用的方法为噬菌体展示技术,用抗原免疫双峰驼,收集双峰驼血清,检测抗体效价水平达到要求后分离免疫骆驼外周血淋巴细胞,提取细胞总RNA,反转录获得cDNA,经2轮PCR扩增获得编码VHH的基因,连接噬菌体展示载体,经电转化等过程构建噬菌体抗体文库;然后利用抗原反复从文库中淘选,获得表达针对目的抗原纳米抗体的重组噬菌体,用重组噬菌体感染合适的感受态细胞,IPTG诱导表达纳米抗体,进行一系列鉴定后可以采用不同的表达系统进行纳米抗体的大量表达。
西北农林科技大学动物医学院重大动物疫病病原感染和致病机制研究团队(本团队)前期表达纯化PCV2 Cap蛋白并进行双峰驼免疫,采集骆驼血清,为构建多样性广泛的Cap蛋白纳米抗体文库,需对免疫后骆驼血清中抗Cap蛋白的抗体效价进行检测;目前已获得针对不同病毒蛋白的多种纳米抗体,后期需要对这些纳米抗体进行鉴定。然而,市场上目前尚无商品化的抗骆驼IgG的抗体。本研究通过纯化骆驼血清IgG,并用纯化的骆驼IgG免疫家兔,制备兔抗骆驼抗血清,为免疫血清效价检测及纳米抗体检测提供材料。
1 材料与方法
1.1 材 料
1.1.1 试验动物 成年雄性阿拉善双峰驼购自甘肃民勤骆驼养殖场,寄养于该厂,观察 1 周后采血制备血清;雄性家兔 2 只,购自杨凌周边农户,饲养于西北农林科技大学动物医学院动物医院,观察 1 周后进行免疫。
1.1.2 主要试剂 Protein G 纯化介质购自金斯瑞生物科技有限公司;弗氏完全佐剂和弗氏不完全佐剂为Sigma公司产品;HRP标记的羊抗兔IgG为Jackson Immuno Research公司产品;蛋白质Marker为Thermo-Fisher公司产品;纯化的PCV2 Cap蛋白、原核表达的猪流感病毒(Swine influenza virus,SIV)核蛋白纳米抗体(SIV-Nb1)、连接穿膜肽TAT的猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)Nsp9纳米抗体(PRRSV-TAT-Nb6)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)N蛋白纳米抗体(PEDV-Nb2)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)S蛋白纳米抗体(TGEV-Nb15)由本团队制备并保存;PCV2 Cap蛋白单克隆抗体1E7由中国农业科学院哈尔滨兽医研究所蔡雪辉研究员馈赠,96 孔酶标板为NUNC 公司产品;其他常规试剂为国产分析纯。
1.2 方法
1.2.1 骆驼血清样本制备 颈静脉采集成年雄性阿拉善双峰驼血液于50 mL无菌离心管,放置呈斜面,待血液凝固后将离心管置于37 ℃恒温箱中30 min,再4 ℃放置过夜。用枪头将血凝块从管壁上拨落,4 ℃ 10 000 r/min离心10 min,收集血清分装保存,备用。
1.2.2 骆驼血清IgG 的纯化与鉴定 取5 mL血清与0.01 mol/L pH 7.2的磷酸缓冲盐液(PBS) 按体积比1∶1混匀,用0.45 μm滤膜过滤得待纯化样品。用Protein G 亲和树脂纯化骆驼血清IgG,纯化前先用10倍柱体积的PBS平衡柱子至流出液A280≤0.01,将10 mL待纯化样品缓慢上柱,保持流速为0.5 mL/min,重复上样8~10次,然后用 30 mL PBS洗涤树脂,流速控制在 1 mL/min,至流出液 A280稳定为止;用5倍柱体积的Elution buffer(0.1 mol/L pH 2.7甘氨酸溶液)洗脱IgG,流速控制在0.5 mL/min,每管收集洗脱液0.5 mL,并迅速加入50 μL 1 mol/L Tris-HCl缓冲液(pH 8.5)中和pH至7.2~7.4。用超微量分光光度计测定每管洗脱液中 IgG的质量浓度,将质量浓度大于 0.5 mg/mL 的样品合并,用 PBS 透析过夜后分装,-20 ℃保存。留取少量样品用 SDS-PAGE 分析蛋白纯度。
1.2.3 纯化的骆驼IgG纯度分析 配制12%分离胶和5%浓缩胶并组装电泳装置,取适量收集的样品加入2×SDS-PAGE loading buffer混匀后沸水浴10 min,10 000 r/min 离心1 min,取10 μL 加入蛋白胶孔,电压100 V电泳约15 min后,调电压至200 V继续电泳,至溴酚蓝电泳至凝胶下边缘停止。小心取出凝胶,考马斯亮蓝染液染色2 h,脱色后观察IgG 纯化效果,并拍照保存。
1.2.4 兔抗骆驼IgG抗血清制备 家兔免疫前耳缘静脉采血2 mL左右,分离血清-20 ℃保存,用作阴性对照。取纯化的骆驼IgG 1 mg与等体积弗氏佐剂充分乳化,每只家兔每次免疫1 mg骆驼IgG,脊柱两侧皮下分点注射,间隔 2 周免疫 1 次,首次免疫使用弗氏完全佐剂,之后使用弗氏不完全佐剂。第 3 次免疫1 周后,颈动脉采集血液,分离血清,分装保存。
1.2.5 兔抗骆驼IgG抗血清抗体效价检测 采用间接 ELISA 方法检测兔抗骆驼 IgG 抗血清的抗体效价,以免疫前家兔血清为阴性对照。将纯化的骆驼 IgG 用 PBS 稀释至4 μg/mL,取 96 孔酶标板,每孔加入100 μL,4 ℃包被过夜。PBS’T(φ=0.05% Tween-20的PBS)洗板4次后每孔加入封闭液(50 g/L 脱脂奶粉的PBS’T溶液) 200 μL,室温封闭2 h,PBS’T洗板4次,将分离的免疫兔血清用封闭液稀释至1∶1 000后再依次倍比稀释加入96孔酶标板,每孔100 μL,每个稀释度重复3孔,室温孵育2 h,PBS’T洗板后每孔加入1∶5 000稀释的HRP标记的羊抗兔IgG,每孔100 μL,室温孵育2 h。洗板后,用TMB显色液显色15 min,3 mol/L H2SO4终止反应,用超微量分光光度计读取每孔450 nm吸光度值(OD450)。以免疫血清OD450/阴性血清 OD450>2.1的最高血清稀释倍数确定兔抗骆驼IgG抗血清的抗体效价。
1.3 抗血清的应用
1.3.1 PCV2 Cap蛋白免疫骆驼血清抗体效价检测 用纯化的Cap 蛋白免疫双峰驼,免疫前颈静脉采集骆驼血液,分离血清作为阴性对照。每次免疫量为2 mg,首次免疫用弗氏完全佐剂乳化,之后用弗氏不完全佐剂乳化;皮下分点注射免疫,每间隔2周免疫 1 次。免疫5 次后颈静脉采集血液,分离血清,采用间接ELISA方法检测免疫血清中抗Cap蛋白的抗体效价。将纯化的Cap 蛋白用PBS稀释至4 μg/mL,加入96 孔酶标板,每孔100 μL,4 ℃包被过夜。PBS’T洗板4次后每孔加入200 μL 封闭液室温封闭2 h,免疫前和免疫后的骆驼血清分别进行倍比稀释后加入96 孔酶标板,每孔100 μL,每个稀释度做3 个重复,室温反应2 h,PBS’T洗涤4 次后每孔后加入1∶2 000 稀释的兔抗骆驼IgG抗血清100 μL,室温反应 2 h,PBS’T洗涤4 次后每孔加入1∶5 000 稀释的HRP标记的羊抗兔IgG 100 μL,室温孵育2 h。洗板后,用TMB显色液显色15 min,3 mol/L H2SO4终止反应,用超微量分光光度计读取每孔OD450。
1.3.2 纳米抗体的Western blot检测 将原核表达SIV-Nb1、PRRSV-TAT-Nb6、PEDV-Nb2、TGEV-Nb15和 PCV2 Cap蛋白单克隆抗体1E7进行12% 分离胶的SDS-PAGE后转至PVDF膜,用50 g/L脱脂奶粉室温封闭2 h后,以制备的兔抗骆驼血清IgG(1∶2 000稀释)为一抗,HRP标记的羊抗兔IgG(1∶5 000稀释)为二抗进行Western blot检测,确定制备的抗血清与针对不同病毒蛋白的纳米抗体的反应原性。
2 结果与分析
2.1 骆驼血清IgG 的纯化
用Protein G 亲和树脂纯化骆驼血清IgG,SDS-PAGE 检测认为骆驼IgG纯度良好(图1)。从图1可以看出,用Protein G纯化的骆驼 IgG 中存在2种类型的重链,一种是传统的分子质量约 50 ku的重链,另一种是缺失CH1的分子质量为 43 ku 左右的重链。在洗涤液中也可以隐约看到一条重链,是没有和Protein G结合的IgG2型重链。超微量分光光度计测得纯化的骆驼IgG质量浓度为1 mg/mL,共获得12 mg 纯化的骆驼IgG,完全满足后续家兔免疫和抗体效价检测。
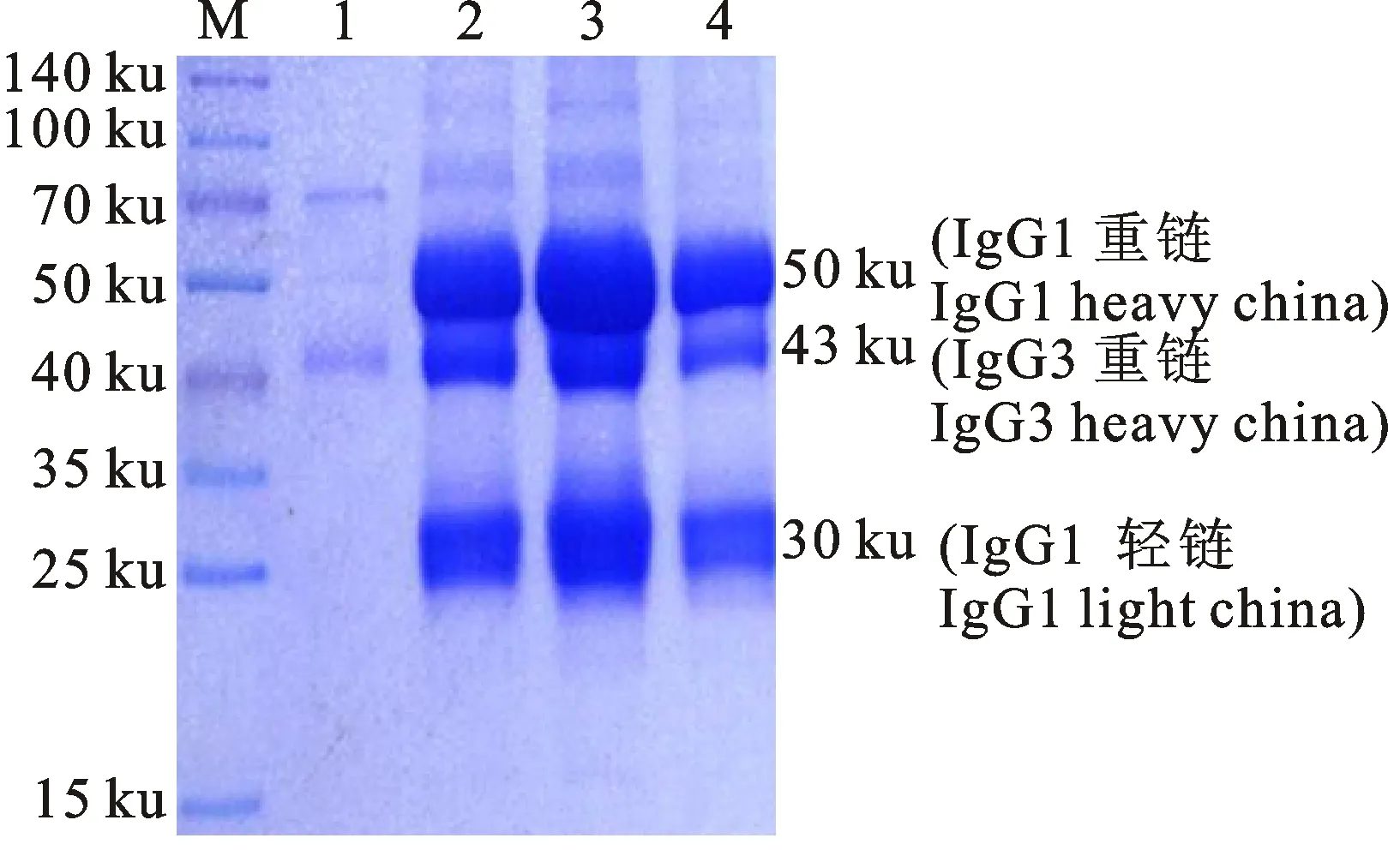
M. 蛋白质分子标准 Protein marker;1.PBS;2~4. 洗脱液 Elution buffer
图1SDS-PAGE分析骆驼IgG纯化效果
Fig.1AnalysisofpurifiedcamelIgGbySDS-PAGE
2.2 兔抗骆驼IgG抗血清效价检测
利用间接ELISA方法,对免疫后的2 只免疫兔血清进行抗体效价检测(图2),从图2可以看出,免疫前血清的OD450一直很低,随着稀释度的增大,OD450不断降低,2只免疫兔血清在稀释1 024 000倍时,OD450仍分别达0.206±0.009 9和0.264±0.030 2,与阴性对照血清OD450(0.129±0.002 1)比值均小于2.1,因此确定获得的免疫兔血清中兔抗骆驼IgG抗体效价为1∶512 000[9]。
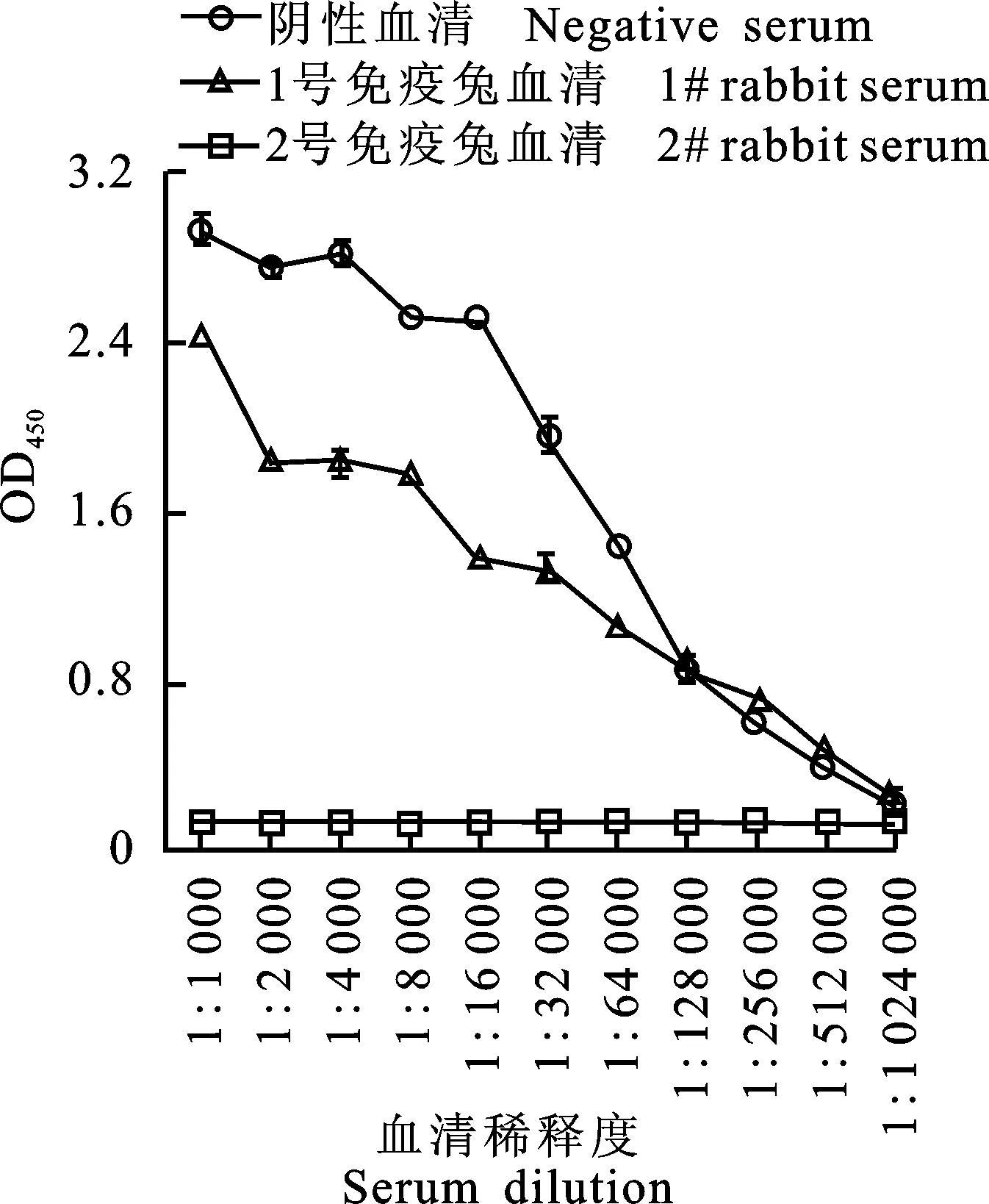
图2 兔抗骆驼IgG 抗血清抗体效价检测Fig.2 Antibody titer of rabbit anti-camel IgG immune sera
2.3 PCV2 Cap蛋白免疫骆驼血清抗Cap蛋白抗体效价检测
用纯化的Cap 蛋白免疫双峰驼,第5次免疫1 周后采集血液分离血清,间接ELISA方法检测免疫血清中抗Cap蛋白的抗体效价,结果如图3所示。免疫前血清OD450小于0.115±0.004 1,免疫后血清4 000倍稀释时OD450为1.977±0.094,随着血清稀释倍数的增大,OD450不断降低;当血清被稀释1 024 000倍时,OD450为0.220±0.018,与阴性对照血清OD450(0.092±0.006)的比值为2.378,而血清被稀释2 048 000倍时,OD450为0.130±0.004,与阴性对照血清OD450(0.072±0.012)的比值为1.802,说明免疫5次后骆驼血清中抗Cap蛋白的抗体效价达1∶1 024 000[9]。
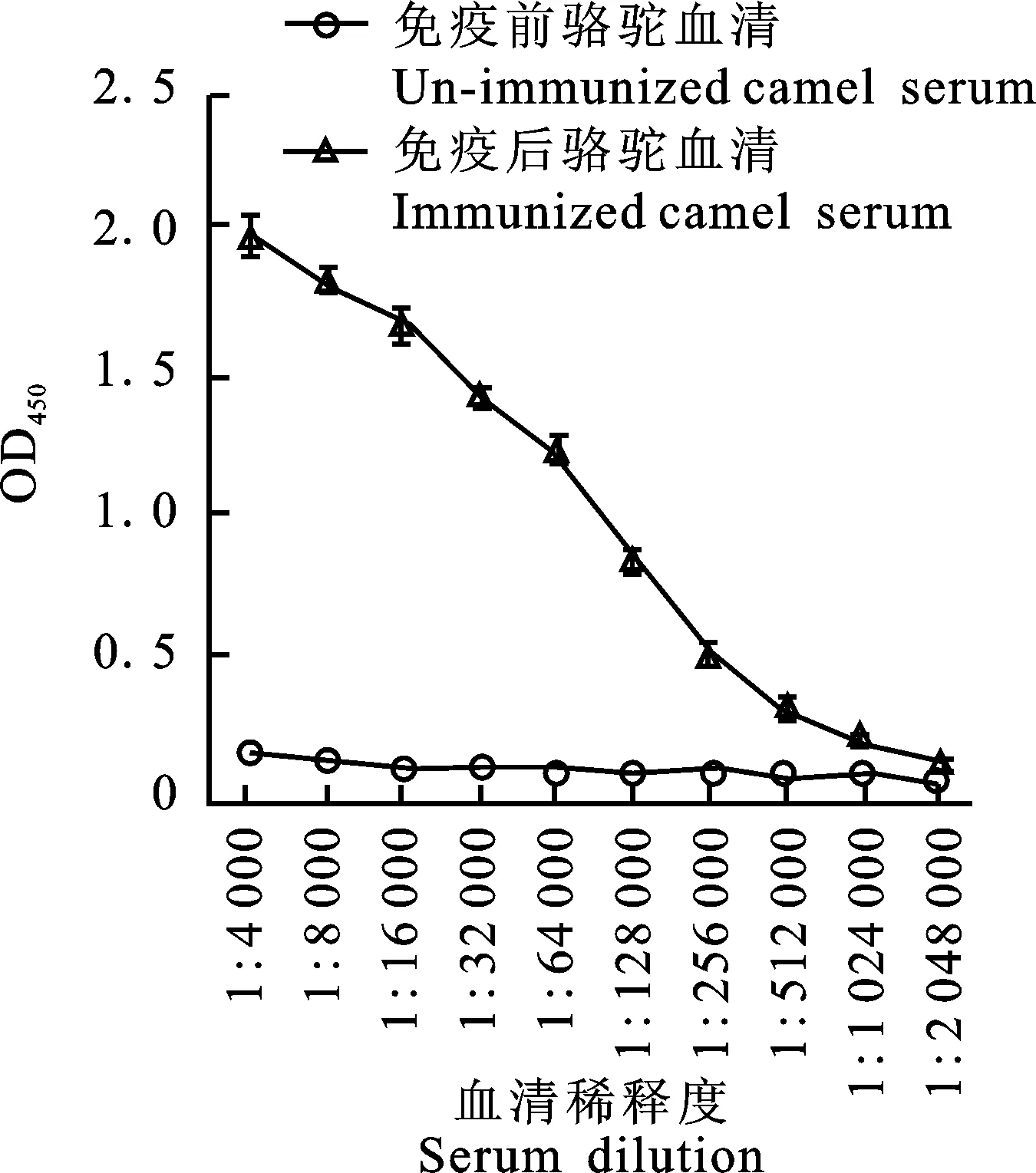
图3 免疫骆驼血清中抗Cap蛋白抗体效价检测Fig.3 Antibody titer of anti-Cap protein in serum of immune camel
2.4 纳米抗体的检测
以制备的兔抗骆驼IgG抗血清采用Western blot方法检测本团队制备保存的原核表达的SIV-Nb1、PRRSV-TAT-Nb6、PEDV-Nb2、TGEV-Nb15和 PCV2 Cap蛋白单克隆抗体1E7。结果显示,制备的抗血清可以与表达的纳米抗体发生特异性反应,但与来源于小鼠腹水的PCV2 Cap蛋白单克隆抗体不反应(图4)。由于这些纳米抗体的CDR3区氨基酸数目多少不一,因此显示的印迹条带大小稍有差异,但基本均在15 ku左右;本团队在PRRSV Nsp9的纳米抗体上连接促进其穿过细胞膜的穿膜肽TAT,所以检测到的PRRSV-TAT-Nb6条带比其他的纳米抗体条带稍大一些。结果说明制备的兔抗骆驼IgG抗血清可以用于纳米抗体的检测。

图4 纳米抗体的Western blot检测Fig.4 Detection of different nanobodies with Western blot method
3 讨 论
1993年,Hamers-Casterman等[2]报道在骆驼科动物(单峰驼、双峰驼、美洲驼等)体内不仅存在分子质量约为 150 ku 的常规四聚体抗体 IgG1,还存在天然的重链抗体(Heavy chain antibodies,HcAbs),包含IgG2和IgG3亚型;其中IgG1由2条重链和2条轻链构成的,而HcAbs仅由2条不含第一个恒定区(CH1)的重链构成。常规抗体的抗原识别位点是由重链和轻链的可变区形成,与传统IgG的抗原结合位点相比,骆驼重链抗体的抗原识别位点仅由一个单独的结构域构成,即重链抗体可变区(Variable domain of the heavy chain of HCAb,VHH)[10]。纳米抗体较普通抗体具有一些独特性能,如分子质量小、亲和力高、稳定性高、水溶性好、免疫原性弱、抗原结合力广泛且良好等[11]。纳米抗体的尺寸很小,使其成为体内功能性干扰研究的便利工具[12]。由于其独特的性质,纳米抗体在未来的结构生物学、基因调控网络分析和信号转导研究中有取代常规抗体[13]的潜力。
目前,纳米抗体作为一种新型小分子抗体已成为生物科技领域的研究热点,在人医上,纳米抗体在科学研究、肿瘤等疾病检测与治疗、疫苗研发、霉菌毒素检测等方面均取得显著的成果[14-18]。在兽医方面,有关纳米抗体的研究也越来越多[19-21]。笔者团队的刘红亮博士利用噬菌体展示技术分别筛选到猪繁殖与呼吸综合征病毒 Nsp9及Nsp4蛋白的纳米抗体,并在HEK293T 细胞进行Nsp9纳米抗体Nb6的稳定表达,发现胞内表达的 Nb6 可以结合PRRSV 编码的Nsp9蛋白,并抑制病毒基因的复制和转录,有望开发成为新型的抗PRRSV药物[22-23]。
常用的纳米抗体制备方法为噬菌体展示技术,即以免疫骆驼淋巴细胞基因组为模板扩增表达VHH的基因片段,将序列插入到噬菌体外壳蛋白结构基因的适当位置,使VHH基因随噬菌体外壳蛋白的表达而表达,同时,VHH随噬菌体的重新组装而展示到噬菌体表面[24]。为构建多样性广泛的噬菌体纳米抗体文库,骆驼免疫后需要检测免疫骆驼血清中针对目的蛋白的抗体水平,筛选完成后也需要对表达的纳米抗体进行特异性与效价检测。然而,市场上目前尚缺少商品化的抗骆驼IgG的抗体。本研究收集骆驼血清,利用Protein G亲和树脂纯化骆驼IgG,经SDS-PAGE分析,纯化的骆驼 IgG 中存在2种类型的重链,一种是传统的分子质量约 50 ku的重链,另一种是缺失CH1的 43 ku 左右的重链,SDS-PAGE显示没有约46 ku的IgG2型重链,因为IgG1和IgG3结合Protein G和Protein A,而IgG2只结合Protein A[2,25-26],如果要收集IgG2,只要用Protein G的流穿液(Flow-through)再过Protein A树脂进行纯化即可。用纯化的骆驼IgG 免疫家兔,分离免疫兔血清,采用间接ELISA方法检测血清抗体效价,结果显示兔抗骆驼IgG抗血清抗体效价超过1∶512 000,利用制备的兔抗骆驼IgG抗血清检测PCV2 Cap蛋白免疫后骆驼的抗体水平,显示5次免疫后骆驼血清中抗Cap蛋白的抗体效价达到1∶1 024 000以上,说明制备的兔抗骆驼IgG抗血清能用于后续纳米抗体制备中的ELISA检测。用制备的抗血清采用Western blot方法检测本团队制备保存的针对不同病毒蛋白的纳米抗体SIV-Nb1、PRRSV-TAT-Nb6、PEDV-Nb2、TGEV-Nb15和 PCV2 Cap蛋白单克隆抗体1E7,发现制备的抗血清可以和纳米抗体反应而不与来源于小鼠腹水的单克隆抗体反应,说明制备的兔抗骆驼IgG抗血清可以用于后续表达的纳米抗体的检测。本研究结果为目标蛋白免疫骆驼后抗体效价检测提供关键的材料,也为表达的纳米抗体的检测提供材料。

