DEHP对雄性小鼠生殖功能的影响
曲 莉,李善姬,徐 斌,白雪松
(1.北华大学公共卫生学院,吉林 吉林 132013;2.吉林医药学院公共卫生学院,吉林 吉林 132013)
邻苯二甲酸酯类(phthalic acid esters.PAEs)是公认的环境内分泌干扰物,在PAEs类塑化剂中最常使用的是邻苯二甲酸二(2-乙基己基)酯[Di-(2-ethylhexyl)phtha-late,DEHP],其产量占到邻苯二甲酸酯类物质总产量的50%以上[1]。DEHP主要应用于各种塑料包装用品,同时在涂料、印刷油墨、染料、农药等工业生产中应用广泛。DEHP以非共价键与聚氯乙烯等物质结合,在塑料产品使用过程中被释放出来,形成环境污染物[2]。DEHP一般是通过污染的大气、水体、土壤和食物等途径进入人体[3],可对肝、肾、心、肺、生殖系统等脏器产生较大的毒性损害。环境内分泌干扰物可以影响到人体的内分泌进程[4],目前最为引人关注的是其所致生殖损伤,生殖系统作为DEHP毒性作用的主要靶器官,DEHP的雄性生殖毒性主要表现为生殖结构、睾丸组织以及生殖细胞的异常。本试验以不同剂量DEHP对雄性小鼠进行染毒,观察其对小鼠生殖功能的影响,为进一步研究DEHP生殖毒性提供相应的依据。
1 材料与方法
1.1 实验动物 40只成年健康雄性小鼠,体重为25±2 g。由吉林医药学院动物实验中心提供。饲养于温度22℃ ±2℃,湿度50% ±5%。
1.2 试验试剂与仪器 邻苯二甲酸二(2-乙基己基)酯(DEHP)(纯度≥99.5%),购自美国 Sigma公司;生理盐水(吉林省都邦药业股份有限公司);吐温80(上海盈公生物技术有限公司);1%伊红(武汉博士德生物工程有限公司);甲醛(上海盛欣医药化工有限公司);CX41正置显微镜(日本OLYMPUS公司);DT1001电子称(江苏省常熟市意欧仪器仪表公司);FA1104N分析天平(上海天平仪器厂);HHS电热恒温水浴锅(上海博迅实业有限公司医疗设备厂);精子计数板(上海求精生化试剂仪器有限公司);HC-1014离心机(北京京立离心机有限公司)。
1.3 方法
1.3.1 动物分组与处理 将40只成年健康雄性小鼠按体重随机分成4组,分别为空白组(生理盐水)和低(250 mg/kg·bw)、中(500 mg/kg·bw)、高(1 000 mg/kg·bw)剂量DEHP染毒组,每组10只。
DEHP染毒溶液配制方法:取纯度99%的DEHP和吐温80各15 mL到棕色试剂瓶里,以1∶1的体积比溶解,接着取118 mL的0.9%生理盐水到棕色试剂瓶中,最后取0.6 mL的0.9%生理盐水到棕色试剂瓶中,配置成浓度为1.0 mg/mL的溶液供高剂量组染毒使用。中、低剂量组用吐温稀释成相应浓度使用。
每天称重,根据体重按灌胃体积(10 mL/kg)给予不同剂量DEHP和生理盐水,每天一次,连续4周,试验期间观察动物的活动、毛发及进食情况。
1.3.2 睾丸、附睾重量及其脏器系数测定 处死小鼠前1 d禁食不禁水,称量小鼠体重,脱臼处死小鼠,迅速取出双侧睾丸、附睾,并小心剥离周围的结缔组织和脂肪组织后称重,计算其脏器系数(脏器系数=脏器重量/体重×100%)。
1.3.3 精子计数方法 将双侧附睾放在盛有2 mL生理盐水的表面皿中,用眼科剪将附睾纵向剪2~3下,再用胶头吸管将悬浮液轻轻吹打6~7次,静置5 min,用4层擦镜纸小心过滤,过滤掉组织碎片,制成精子悬液。吸取一滴精子悬液到精子计数板的两个计数池内,静置5 min,先将充好精子悬液的计数板小心放置在低倍镜下,然后转动粗准焦螺旋找到计数板中心方格,选择精子分布比较均匀的计数池,然后转换成高倍镜观察,在高倍镜下数中间大方格内的5个中方格(4角4个和中间1个或对角线5个),计数时要按一定的顺序进行,以避免遗漏和重复,压在双线上的精子就只计两边,即只计上方和左侧线上的精子,而压在下方和右侧线的精子均不计入(即计左不计右,计上不计下)。将5个中方格计数的精子数相加,记为n,以1 mL精子悬液中的精子数目作为精子总数(1 mL精子总数=n×50 000)。
1.3.4 精子畸形率测定 取精子悬液以3 000 r/min离心20 min,吸去离上清液,剩余的少量液体与沉淀摇匀后,取1滴悬液于载玻片一侧,均匀涂片,晾干后甲醛固定5 min,晾干后用1%伊红染液染色1 h,在高倍镜下检查精子形态,每只小鼠检查结构完整的1 000个精子,并计算畸形率(%)。
1.4 数据处理 所有数据的均采用SPSS20.0软件进行统计分析,数据均以平均值±标准误差(mean±SE)表示,各实验组差异检验采用单因素方差分析,方差齐时,各组间两两比较用LSD方法,不齐时,各组间两两比较采用Tamhane′s方法。
2 结果
2.1 一般情况 在染毒期间,各剂量DEHP染毒组与阴性对照组比较,小鼠出现活动减少、被毛蓬松等中毒症状,进食情况良好。
2.2 DEHP染毒对雄性小鼠睾丸、附睾重量及其脏器系数的影响 本次试验结果显示:与空白组比较,中、高剂量DEHP染毒组的小鼠的睾丸、附睾重量及其脏器系数均下降,低剂量DEHP染毒组仅睾丸重量明显下降,差异均有统计学意义(P<0.05);随着DEHP染毒剂量的升高,小鼠的睾丸、附睾重量及其脏器系数呈下降趋势。结果见表1。
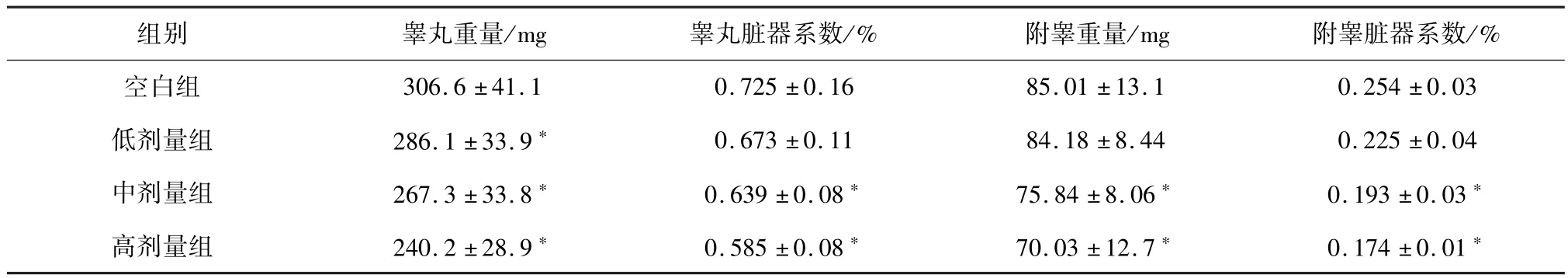
表1 DEHP染毒对小鼠睾丸、附睾重量及其脏器系数的影响
2.3 DEHP染毒对小鼠精子计数和精子畸形率的影响 本次试验结果显示,与空白组比较,各剂量组的小鼠精子计数明显降低、精子畸形率明显升高,差异有统计学意义(P<0.05)。随着DEHP染毒剂量的升高,小鼠精子计数呈下降趋势,精子畸形率呈上升趋势。结果见表2。

表2 DEHP染毒对小鼠精子计数和畸形率的影响
3 讨论
近年来DEHP对雄性生殖系统的毒性作用越来越受人们关注,雄性生殖系统是一个非常复杂的系统,包括睾丸、附睾、精囊、射精管、阴囊、输精管等。雄性生殖系统中最重要的器官是睾丸,它主要发挥着生成精子、分泌和合成雄性激素的功能,在维持生育及性功能等方面具有非常重要的作用。脏器系数即脏器重量/动物体重,若受试物使某个脏器受到损害,如充血、增生、萎缩、水肿等,则该比值就会发生变化,可以减小或增大。所以脏器系数是一个灵敏和客观的指标[5],它的变化可以比较全面的反映出毒性物质对该脏器的影响,与此同时还能为毒物作用于哪个靶器官提供重要依据。本次试验结果显示,雄性小鼠经DEHP染毒后,睾丸和附睾脏器系数有着不同程度的改变,随着DEHP染毒剂量的升高,与空白组相比,睾丸和附睾脏器系数降低,表明DEHP对睾丸和附睾有毒性作用。本次试验结果与丁承辉[6]报道的结果一致。
精子数量是维持雄性生育能力的主要条件,精子计数的改变在评价有害因素对精子生成的影响时比其他指标更为敏感,它是研究环境因素对雄性生殖健康影响的很重要的观察终点,可反映其生精细胞的功能,是一种用于评价精子发生致毒效应的方法[7]。本研究发现各染毒组雄性小鼠精子计数均低于空白组,中、高剂量组小鼠精子计数与空白组比较显著降低,说明DEHP对小鼠的精子生成有抑制作用,对各级精母细胞有明显的毒性作用,干扰精子的生长发育过程。可能的原因是DEHP或其代谢产物直接作用于睾丸组织,一方面DEHP可能损害睾丸间质细胞,引起T分泌的减少,由于睾丸T水平的降低,必定会对支持细胞(Sertoli细胞)产生影响,包括影响它的分泌功能以及对生精细胞的营养和支持作用,另一方面破坏生精过程,使各级生精细胞数量减少,然后精子生成数量就减少,接着精曲小管管壁也变薄,甚至是精曲小管整体的横径变短,生精细胞变性、脱落进入管腔,最终可导致精子数量的减少。
小鼠精子畸形试验是我国食品、药品、化妆品等商品进行雄性生殖细胞遗传毒性安全性评价的标准方法[8]。精子畸形试验是评价毒物对雄性生殖毒性及潜在诱变性的一种快速便捷方法,能够较为客观地反映精子的形态发育情况。本试验结果显示,经DEHP染毒后,各剂量组小鼠精子畸形率明显高于空白组,且随着DEHP染毒剂量的增大精子畸形率随之增高,说明一定浓度的DEHP可影响精子的生成和发育过程,导致精子畸形的发生,DEHP对雄性小鼠生殖细胞具有致畸作用,存在着一定的生殖毒性。本次结果与郑立[9]和王蕊[10]的文献报道基本一致。

