核-壳型松香基磁性聚合物固定化脂肪酶的制备及性能
黎克纯,雷福厚,2,卢建芳,2*,周菊英,2,许海棠,2,赵彦芝,2
(1.广西民族大学 化学化工学院,广西 南宁 530006;2.广西民族大学 广西林产化学与工程重点实验室,广西 南宁 530006)
脂肪酶作为一种特殊的生物催化剂,既可以促进油脂的水解,又可以在一定的条件下加速油脂的合成,发生酯交换反应[1-2]。鉴于以上特点,广泛应用于食品、医药、工业等领域。但游离酶在使用过程中局限性较大(如成本高、难回收、易失活、重复使用率低),使酶的应用提出较大挑战,固定化酶技术的提出,提高了酶的催化性能、操作稳定性和重复利用率,并降低了生产成本,为酶提供了广阔的应用前景[3-5]。
磁性复合材料既具有功能化基团,又具有良好的磁导向性,可以结合多种生物分子,且通过外加磁场快速进行分离和回收。因此被广泛应用制备固定化脂肪酶领域[6-9]。
本研究以天然产物松香的衍生物为交联剂,采用共沉淀法及悬浮聚合法制备出具有磁性的核-壳结构的球状聚合物,用化学交联法固定脂肪酶。优化了载体的制备及酶固定化条件,表征了核-壳型松香基磁性微球的结构和考察了酶学性质。
1 材料与方法
1.1 材料与试剂
马来松香乙二醇丙烯酸酯:本实验室自制;甲基丙烯酸、丙烯酸、戊二醛、氢氧化钠、无水乙醇、十二水合磷酸二钠、磷酸二氢钾等(均为分析纯):天津大茂化学试剂厂;脂肪酶(生物试剂),聚乙烯醇、橄榄油、二氯亚砜(均为分析纯):国药集团化学试剂公司;所有溶液均使用高纯水配制。
1.2 仪器与设备
SYC-15超级恒温水浴锅:南京桑力电子设备厂;Scientz-10N冷冻干燥机:宁波新芝生物科技股份有限公司;ZJ-2B磁天平:南京多助科技发展有限公司;ASAO2010微孔分析仪:美国麦克micromertics公司;SUPRA55Sapphire场发射扫描电子显微镜:德国卡尔蔡司(carlZEISS)公司;D8Advance型x射线衍射仪:德国布鲁克公司。
1.3 方法
1.3.1 具有菲环结构的高分子磁性微球的制备
取甲基丙烯酸4.2 g、丙烯酸1.8 g和马来松香丙烯酸乙二醇酯20.0 g,溶于50 mL乙酸乙酯后再加入过氧化二苯甲酰0.06g,超声20min后再加入FeCl3·6H2O3.2g、FeCl2·4H2O 1.4 g及蒸馏水100 mL,继续超声30 min,然后400 r/min搅拌,缓慢加热至80℃,迅速加入25 mL质量分数25%的氨水再保温6 h。通过外加磁场分离出磁性微球,并用无水乙醇和去离子水反复洗涤。
取上述固体5 g加入5 mL吡啶中,冰浴条件下缓慢滴加15mL二氯亚砜,反应4h后减压抽滤。再向其中加入溶有5 mL乙二胺的10 mL 1.4-二氧六环的溶液。常温条件下,磁力搅拌反应2 h,在外加磁场的作用下固液分离并用蒸馏水反复洗涤。
1.3.2 松香基载体性能与结构的测试
傅里叶变换红外光谱学(Fouriertransforminfrared,FT-IR)分析:样品与标准溴化钾固体按质量比为1∶200进行混合,压片后进行测试,分析样品所含官能团。
孔径分析:采用微孔分析仪,低温条件下氮气吸/脱附,测试磁性微球的比表面积、孔体积及平均孔径。
X射线衍射(X-ray diffraction,XRD)分析:采用x射线衍射仪对样品进行物相分析。使用Cu-Kα作为辐射源,采用步进扫描,扫描范围2θ为10~80°,步长为0.013,扫描速率为5°/min。
扫描电子显微镜(scanning electron microscope,SEM)分析:采用场发射扫描电镜,观测磁性微球的外部及内部的形貌。
磁化率:按照参考文献[10]测定磁化率:采用古埃及磁天平测定松香基磁性微球在磁场强度为400 mT的磁化率。以莫尔盐为基准物质,计算公式为:

式中:M样、M标分别为待测样品和标准样品的质量,g;ΔM样、ΔM标分别为待测样品和标准样品施加外加磁场的质量差。M标=37.3 mg,M样=35.6 mg。
1.3.3 固定化脂肪酶的制备方法
称取1.0 g脂肪酶粉末,放入50 mL的磷酸盐缓冲溶液(pH7.5)中,加入磁性松香基微球(载体与酶的质量比从1∶0.5~1∶5.0),磁力搅拌条件下,加入体积分数50%的戊二醛(加入量为总体积的0.1%~2.7%),冰浴条件下,反应0.5~4 h,在外加磁场的作用下固液分离并用蒸馏水反复洗涤,将制得的固定化酶冷冻干燥。
1.3.4 酶学性质的测定
最适温度和pH:分别将固定化酶和游离酶置于20~70℃水浴中和pH值为5.8~8.0缓冲溶液中按照1.3.5进行酶活检测。
热稳定性:分别将固定化酶和游离酶置于50℃水浴中,每隔30 min测其活力,考察载体固定化技术能否提高酶的耐热性能。
储存稳定性:将固定化酶与游离酶同时放在4℃的冰箱保存,每隔一段时间测定一次活力,以最高的酶活为100%。
操作稳定性:将固定化酶置于45℃,pH 7.0的底物中,按1.3.5进行酶活测定。每次催化完成后,回收固定化酶,用于下一次反应:把第一次使用时酶活定义为100%。考察固定化酶在催化反应中的重复使用性。
1.3.5 测定方法
按照参考文献[11]测定酶的活性。

2 结果与分析
2.1 核-壳型松香基磁性球状聚合物的制备
各反应条件对磁含量的影响见图1。
由图1a可知,形成聚合物的磁含量随着反应温度的升高呈先增大后减小的趋势,在反应温度为75℃时,磁含量最高为20.35%。可能是因为此反应为自由基聚合,引发剂受热裂解产生自由基,温度越高产生的自由基越多。当自由基少时,不易在磁核周围发生聚合,难形成核-壳型磁性聚合物;当自由基多时,Fe3O4周围的自由基不断发生碰撞,易形成大颗粒,含磁量较少。因此选择反应温度为75℃为宜。
由图1b可知,形成聚合物的磁含量随引发剂用量的增加呈先增大后减小的趋势,当引发剂用量为单体总质量的1%时,形成的聚合物磁含量最高为21.52%。可能是因为随着引发剂用量增加,溶液中的自由基浓度逐渐增加,Fe3O4经历了从不易被包覆,到易于被分子质量较低的高分子包覆,最后到分子质量较高的高分子包覆的过程。因此选择引发剂用量为1%为宜。
由图1c可知,随着水油比的增加呈先增大后减少的趋势,当水油体积比为2∶1时,形成的聚合物磁含量最高为21.87%。可能是因为引发剂(过氧化二苯甲酰)属于油溶性引发剂,在不断的搅拌下,含有引发剂的油滴分散在水中,形成水包油。引发剂裂解产生的自由基,与油水界面的单体发生自由基传递,从而形成聚合物。随着水量的增加,油滴可以均匀的分散在水中,与水中单体及Fe3O4的接触机会增加,易形成含磁量高的聚合物。当继续加大水量,相当于稀释引发剂、单体及Fe3O4的浓度,因此合成的聚合物磁量逐渐减少。因此选择水油体积比为2∶1为宜。
由图1d可知,形成聚合物的磁含量随着转速的增加呈先增大后减小的趋势,当转速为450 r/min时,聚合物的磁含量最高为22.23%。可能是因为当加大搅拌速度时,相当于加快自由基相对运动,增加Fe3O4面自由基碰撞聚合的机会,易合成含磁量较高的高分子。当搅拌速度继续增大,剪切力逐渐增强,含有表引发剂的液体形成更多更小的小液滴,分散在溶液中,能产生更多的自由基,自由基之间更易于聚合,可能形成的聚合物未包覆上Fe3O4(只有在Fe3O4表面的自由基发生聚合,才易得到磁性高分子)含磁量减小。因此选择转速为450 r/min为宜。
由图1e可知,形成聚合物的磁含量随着聚合反应时间的延长呈先增大后减小的趋势,当聚合反应时间为4 h时,最佳磁含量为23.32%。可能是因为整个反应的过程就是自由基在Fe3O4表面不断聚合,把Fe3O4包覆在高分子内。随着反应时间的增加,不断有自由基碰撞包覆在Fe3O4的外层,形成较大的颗粒,Fe3O4外层被分子量较高的松香基高分子包覆,磁含量相对减小。因此选择聚合反应时间4h为宜。

图1 反应条件对磁含量的影响Fig.1 Effect of reaction condition on magnetic content
2.2 松香基载体性能与结构
2.2.1 FT-IR分析

图2 松香基磁性微球的傅里叶变换红外谱图Fig.2 FTIR spectra of rosinyl magnetic microspheres
由图2可知,580 cm-1为Fe-O的伸缩振动,说明Fe3O4包裹在松香基微球里,形成核-壳结构[12];1 724 cm-1出现了吸收峰为酰胺基的C=O的伸缩振动,3 374 cm-1为N-H的伸缩振动,1 644 cm-1、1 448 cm-1为C-N伸缩振动,以上均表明该核-壳型松香基磁性微球含有-CO-NH-基团[13];1 167 cm-1为C-N伸缩振动,1 552 cm-1为N-H弯曲振动,说明该改性核-壳型松香基磁性微球含有-NH2基团[14]。
2.2.2 孔结构分析
采用静态氮气吸附法在低温条件下测定磁性微球(2.5~4 mm)的比表面积、孔体积及平均孔径,分别为23.36 m2/g、0.427 cm3/g和18.574 nm。
2.2.3 XRD分析
具有菲环骨架的高分子磁性微球的XRD图谱如3图所示。
由图3可知,2θ=30.18、35.49、43.11、56.90、62.58处的衍射峰,分别属于Fe3O4的(220)(311)(400)(511)(440)晶面的衍射,与Fe3O4的标准卡(JCPDS NO.74-0748)结果基本相符[15]。
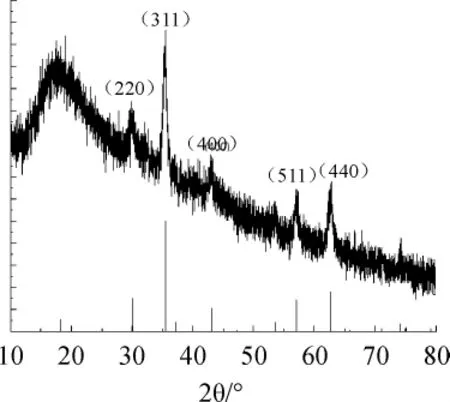
图3 松香磁性微球的XRD图谱Fig.3 XRD spectra of the rosinyl magnetic microspheres
2.2.4 SEM分析

图4 松香基磁性微球的电镜图Fig.4 SEM images of the rosinyl magnetic microspheres
由图4a可知,磁性微球表面有大量大小不一的孔洞,脂肪酶和戊二醛可以通过孔洞进入,与微球内部的官能团结合。由图4b可知,微球剖面图内部有大量空腔,比较蓬松,增大了微球内部的表面积,有利于固定在微球孔道内部的酶与底物接触发生反应。
2.2.5 磁化率测定[10]

表1 松香基磁性微球磁化结果Table 1 Magnetic structure of rosinyl magnetic microspheres
由表1可知,产品磁化率为5.375×10-4cm3/g,在10-5~10-3之间,说明产品具有顺磁性[16]。
2.3 优化固定条件
本固定化方法是利用戊二醛两端的-CHO基与载体和脂肪酶的-NH2基发生交联反应,将酶固定在载体上。交联条件对固定化酶活力的影响结果见图5。
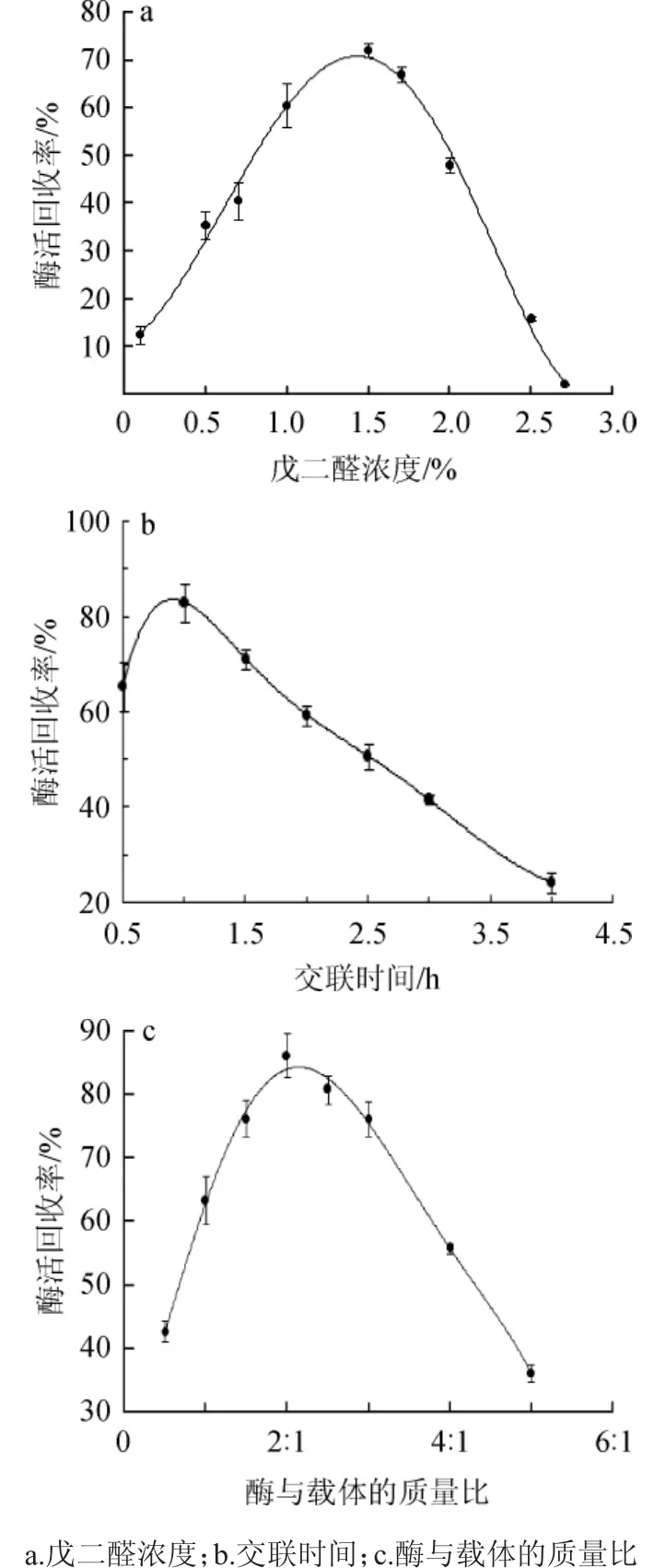
图5 交联条件对固定化酶活力的影响Fig.5 Effect of crosslinking conditions on activity of immobilizedlipase
由图5a可知,随着交联剂(戊二醛)浓度的增加,酶活回收率呈先增大后减小的趋势。当戊二醛浓度为1.5%时,所得固定化酶活性最高。可能是因为交联剂浓度较低时,游离酶分子不能完全固定在载体上,制备的固定化酶活力不高。但是随着交联剂浓度的增大,过多的戊二醛分子与固定化酶的酶分子活性中心发生交联,从而降低酶的活力[17]。
由图5b可知,随着交联时间的延长,酶活回收率呈先增大后减小的趋势。交联时间为1 h时酶活回收率达最大值。当固定化时间太短,酶没有完全结合在载体上,固定化酶活力小。戊二醛即是一种交联剂又是一种变性剂,长时间与酶接触,戊二醛有更多机会破坏起催化作用的酶的活性中心,使部分酶失去活性[18]。同时,当过多的酶拥挤在载体的孔道内,阻碍了与底物的接触,导致固定化酶活性低。
由图5c可知,随着酶与载体质量比的增加,酶活回收率呈先增大后减小的趋势。当酶与载体的质量比为2∶1时,酶活回收率最大为86.17%。当有过多的酶固定在载体表面或是孔道内部,由于酶分子间的空间位阻的关系,导致有部分酶的活性中心与底物不能充分接触。酶的有效利用率低,不经济环保。
2.4 酶学性质
2.4.1 最适温度和pH

图6 固定化酶和游离酶的最适温度(a)和pH(b)Fig.6 Optimum temperature(a)and pH(b)of immobilized lipase and free lipase
由图6可知,相比游离脂肪酶,固定化酶的最适温度提高了约5℃。可能是载体的刚性结构保护了酶分子结构,故固定化酶的耐热性提高[19]。与游离酶相比,固定酶的最适pH值向碱性方向移动0.5个单位。可能是由于固定化酶的氨基影响,使固定化酶周围产生浓度梯度导致固定化酶的最适pH值发生移动[20]。
2.4.2 热稳定性

图7 固定化酶和游离酶的热稳定性Fig.7 Thermal stability of immobilized lipase and free lipase
酶分子固定在具有刚性结构的磁性松香基载体上,有利于保护酶分子的三维结构,增强酶的刚性,减少其受外界条件的影响。游离酶在50℃保温,酶活力下降明显,240 min后,残余活力仅为最初的7.15%。而固定酶在50℃保温,其活力下降缓慢,240min后,活力仍为原来的72.56%,可见固定酶具有更好的热稳定性。
2.4.3 储存稳定性
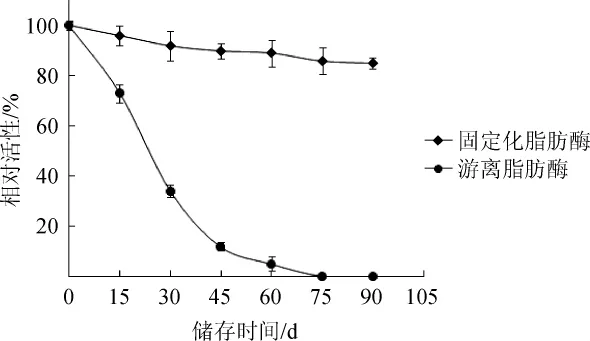
图8 固定化酶和游离酶的储存稳定性Fig.8 Storage stability of immobilized lipase and free lipase
由图8可知,游离酶的活性下降很快,而固定化酶存储3个月,活性仍保持在85%左右,说明固定化后脂肪酶的存放能力明显提高。可能原因是:(1)用交联剂(戊二醛)将脂肪酶分子固定在载体上,可防止酶分子伸展变性[21];(2)载体的刚性结构保护了酶分子的三维结构,减少外界不利因素对酶结构的破坏。
2.4.4 固定化酶的稳定性

图9 固定化酶的操作稳定性Fig.9 Operation stability of immobilized lipase
以核-壳型松香基磁性微球为载体的固定化酶重要的应用优势就是可利用外加磁场快速将固定化酶从反应媒介中分离回收,再利用。可以简化后续操作工艺,降低损耗费用,减少环境污染。由图9可知,连续循环7个批次,其相对酶活力仍保持73.52%。
3 结论
在水油体积比为2∶1,加入单体总质量1%的引发剂(过氧化二苯甲酰),转速450 r/min,反应温度为75℃时,聚合4 h,制备出核-壳型松香基磁性微球。
核-壳型松香基磁性微球为载体,交联法制备固定化脂肪酶。50%的戊二醛(交联剂)用量为1.5%(总体积);交联4 h;酶与载体的质量比为2∶1制得的固定化酶最大酶活回收率为86.17%。
固定化脂肪酶的最适温度及pH值分别为45℃、7.0;比游离酶提高了约5℃,向碱性方向移动0.5个单位;50℃保温4 h,固定化酶酶活力保留72.56%,而游离酶只有7.15%,说明酶固定在松香基磁性载体上热稳定性提高;储存稳定性及操作稳定性均有所提高。
可利用磁性快速从反应媒介中回收,再利用,可以简化后续操作工艺,降低损耗费用,减少环境污染。此方法可以作为一种通用方法,开发各种基于多孔松香基磁性载体的固定化酶。

