紫色红曲霉中新型酯酶ESM1的纯化及其酶学特性研究
张 玉,周冉冉,李可心,黄 宇,陈茂彬*
(1.湖北工业大学 生物工程与食品学院 发酵工程教育部重点实验室,湖北 武汉 430068;2.工业发酵湖北省协同创新中心,湖北 武汉 430068;3.工业微生物湖北省重点实验室,湖北 武汉 430068)
酯酶(EC 3.1.1.1)是能催化芳香酯、脂肪酸酯等水解的酶的统称[1],在化学合成、食品调味品和医药工业领域应用广泛[2-4]。源于真菌的酯酶可以催化水解作用的逆反应,即合成反应,如在非水性环境中的酯化作用和酯交换等反应[5]。酯酶在有机溶液中的催化合成反应具有增加疏水性底物的溶解度[6]、朝向合成的热力学平衡转移[7]和底物特异性改进[8]等优点。
酯酶可以从微生物,特别是细菌和真菌中高量生产[9]。根据生物学特性和保守区序列,细菌中的酯酶被划分为8个家族[10],且近些年来不断报道出新的家族成员[11-14]。然而,只有一部分酯酶进行了结构和功能的鉴定[15-17]。从真菌中也分离和纯化出一些酯酶,前期报道,在中国传统发酵红米中发现了116个紫色红曲霉(M.purpureus)M7的候选酯酶基因,在这些酯酶基因中,只有酯酶Lip10和Lip2属于新的酯酶家族成员[14,18]。
虽然一些酯酶已经被分离、鉴定,但是寻找具有更高的热稳定性和更宽的底物选择性的新型酯酶仍迫在眉睫[19]。酯酶在工业生产过程中需要反复使用,因此,需要相当好的稳定性,且真菌产生的酯酶通常是胞外酶,很容易通过纯化获得[20]。因此,本研究以白酒高温大曲中筛选出的一株耐高温酯酶产生菌株HQ为研究对象,对其进行了分子生物学鉴定,并对其所产的酯酶进行分离纯化、分子特性分析和酶学特征研究,为现代工业生产奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
菌株HQ:分离自白酒高温大曲,-4℃保存备用。
1.1.2 试剂
胰蛋白酶(250 U/mg):北京华迈科生物技术有限责任公司;PTH-氨基酸标品(纯度>98.0%):日本Shimadzu Corporation公司;其他试剂购自国药集团化学试剂有限公司,均为分析纯。
1.1.3 培养基
种子培养基:葡萄糖1%,酵母膏0.5%,NaNO30.3%,MgSO4·7H2O 0.2%,KH2PO40.2%。115℃灭菌30 min。
液体发酵培养基:蛋白胨1%,可溶性淀粉1%,K2HPO40.1%,MgSO40.05%,FeSO40.001%,KCl 0.05%,MnSO40.03%。用乳酸调pH值为6.0,115℃灭菌30 min。
1.2 仪器与设备
ZHWY-2112B恒温培养振荡器、ZHJH-1214B超净工作台:上海智城分析仪器制造公司;Tanon-1600凝胶成像系统:上海天能公司;ultrafleXtreme基质辅助激光解吸电离-飞行时间-质谱(matrix-assisted laser desorption ionizationtimeofflight-massspectroscopy,MALDI-TOF-MS)、ultimate 3000色谱仪:美国布鲁克·道尔顿公司;PPSQ-31A蛋白测序仪:日本岛津公司;AKTA prime plus柱层析系统:美国GE Healthcare公司;丁基琼脂糖柱26/60 Superdex G-200柱:美国Amersham公司。
1.3 方法
1.3.1 菌株的分子生物学鉴定
按照SAMBROOK J等[21]的方法提取菌株HQ的脱氧核糖核酸(deoxyribonucleic acid,DNA),根据18S rDNA的D2序列设计一对通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′)。采用引物对ITS1/ITS4进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,PCR扩增体系:无菌水 17.8 μL,Buffer:3 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphated,NTP)2 μL,ITS1 3 μL,ITS4 3 μL,DNA模板1 μL,Taq酶 0.2 μL;PCR扩增条件:95 ℃预变性5 min;95 ℃变性0.5 min,55℃退火0.5 min,72℃延伸1 min,35个循环;72℃延伸10min。PCR扩增产物采用1%琼脂糖凝胶进行验证,PCR扩增产物送至华大基因公司测序,测序结果在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)上进行Blast比对搜索,获得同源性较高菌株序列,采用MEGA软件中的邻接法(neighbor-joining,NJ)构建系统发育树,确定菌株的亲缘关系。
1.3.2 粗酶液的制备
种子液的制备:挑取斜面上的紫色红曲霉HQ接种于种子培养基,于30℃、180 r/min条件下培养4 d后过滤,制成种子液备用。
液体发酵:按10%(V/V)的接种量将种子液接种于含50 mL发酵培养基的250 mL三角瓶中。先静置12 h,然后在30℃、180 r/min的条件下培养。接种后每隔12 h取一批样,每批取3次,用4层纱布过滤,菌丝用无菌水冲洗几次,直至表面色素清洗干净,烘干称质量。同时测定发酵液中酯酶的酶活性。
1.3.3 胞外酯酶的分离纯化
液体发酵5 d后,将培养液在滤纸上过滤,去除菌丝体。添加终浓度为2 mmol/L的苄脒(丝氨酸蛋白酶抑制剂)到液体发酵液中,以防止整个纯化过程中蛋白质发生水解。
利用硫酸铵分级沉淀纯化发酵液中的酯酶[22]。取6份50 mL粗酶液,分别向每份粗酶液中缓慢加入碾细的(NH4)2SO4粉末,使其饱和度分别为0、20%、30%、40%、50%、60%,(NH4)2SO4溶解后静置30 min,10 000×g、4 ℃条件下离心15 min,测定上清液酯酶活力。选取酯酶活力最高的上清液按体积均分为6份,分别加入(NH4)2SO4粉末,使其饱和度分别为70%、75%、80%、85%、90%,待(NH4)2SO4充分溶解后,静置30 min,10 000×g、4℃条件下离心15 min,弃上清,收集沉淀。将上述沉淀用20mmol/LTris-HCl(pH 8.0)缓冲液充分溶解,定容至25 mL,检测剩余酯酶活力。
在上述酶活力最高的基础上,10 000×g、4℃条件下离心15 min,将上清液加入到丁基琼脂糖柱(2.5 cm×30 cm),利用10倍柱体积的含有1 mol/L(NH4)2SO4的20 mmol/L Tris-HCl(pH 8.0)缓冲液冲洗,以除去未结合的蛋白质。然后以2mL/min的流速将酯酶梯度洗脱至含(NH4)2SO4(0~1mol/L)的20 mmol/L Tris-HCl(pH 8.0)缓冲液中,总体积超过4个柱体积,收集10mL的馏分。将含有酯酶活性的组分汇集[23]。
采用Superdex G-200柱进行进一步分离。利用含有150 mmol/L NaCl的10 mmol/L Tris-HCl(pH 8.0)缓冲液洗脱柱子,流速为1 mL/min。收集组分,检测酯酶活力。所有纯化步骤在4℃进行。
1.3.4 分析检测方法
酯酶活力的测定:参照KORDEL M等[26]的方法测定酯酶活力。取10 mL环己烷、3.55 mL乙醇、6.25 mL己酸(所有试剂每500 mL中加入30 g无水硫酸钠)以及0.2 mL酶液,在100mL的密闭锥形瓶中进行酯化反应,反应温度为35℃。反应24h后取上清液0.5mL于50mL锥形瓶中,加入5mL水,2滴酚酞,用0.1 mol/L NaOH滴定至终点,测定己酸的消耗量。酯酶活力单位定义:在测定条件下每分钟消耗1 μmol己酸所需要的酶量为1个酶活力单位(U)。
蛋白质含量的测定:采用Bradford法[27]。
蛋白质分子质量的测定:采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)(12%丙烯酰胺)进行测定[28]。
1.3.5 蛋白质质谱分析
采用SDS-PAGE(12%丙烯酰胺)分离纯化酯酶后,回收蛋白条带,用胰蛋白酶裂解得到肽混合物。采用基质辅助激光解析串联飞行时间质谱(MALDI-TOF-MS)检测蛋白质结构。通过检测器收集分离的离子,并测定每个离子的质子数与电荷数的比值(m/z值),从而获得蛋白质的质谱分析结果。
1.3.6 蛋白质N端测序
采用SDS-PAGE(12%丙烯酰胺)分离0.5nmol的纯化酯酶,并用电印迹法将其转移到聚偏二氟乙烯膜(polyvinylidencefluoride,PVDF)上。从CBB-R250染色的PVDF印迹中切下酯酶条带,利用蛋白测序仪建立标准氨基酸图谱,确定纯化的非变性酯酶的N-末端序列。
1.3.7 酯酶酶学性质研究
(1)温度对酯酶活性和稳定性的影响
将纯化得到的酯酶加入到酯化反应体系中,分别置于20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃条件下进行酯化反应,测定酯酶活力。以酶活力最大值为100%,计算相对酶活。
将酶液分别置于30℃、40℃、50℃、60℃、70℃条件下水浴60 min,每隔10 min取样在37℃条件下进行酯化反应,测定剩余酯酶活力,并以未保温时的酶活力为100%,计算相对酶活。
(2)pH值对酯酶活性和稳定性的影响
分别用pH 4.0、4.5、5.0、5.5、6.0的柠檬酸-柠檬酸钠缓冲液(0.25 mol/L)、pH 5.0、6.0、7.0的磷酸氢二钾-磷酸二氢钾缓冲液(0.25 mol/L)及pH 7.5、8.0、8.5、9.0的Tris-HCl缓冲液(0.25 mol/L)配制底物反应液,测定其酯酶活力,并以酶活力最大值设定为100%,计算相对酶活。
将酶液分别置于上述对应的pH缓冲液中于4℃放置过夜,测定剩余酶活力,以pH7.2处理下的酯酶酶活力(100%)作为对照,计算相对酶活。
(3)金属离子对酯酶活性的影响
在溶解酯酶的10mmol/L Tris-HCl(pH 8.0)缓冲溶液中分别添加Ca2+(CaCl2)、Mg2+(MgSO4·7H2O)、Mn2+(MnCl2)、Zn2+(ZnSO4·7H2O)、Cu2+(CuSO4·7H2O)、Fe2+(FeSO4·7H2O)等二价金属离子至终浓度为5mmol/L,测定酯酶活力,以不加金属离子的酯酶酶活为100%,并计算相对酶活。
2 结果与分析
2.1 菌株的分子生物学鉴定
在黄山头酒厂的红心大曲中分离出一株产酯酶的红曲霉菌株,编号为HQ-1,采用分子生物学对其进行菌种鉴定,其系统发育树如图1所示。
由图1可知,菌株HQ与Monascus purpureusMp-41聚于一支,亲缘关系最近,因此,确定该菌株HQ为一株紫色红曲霉(Monascus purpureus)。

图1 菌株HQ的系统发育树Fig.1 Phylogenetic tree of strain HQ
2.2 发酵时间对酯酶活性的影响
紫色红曲霉HQ发酵过程中酯酶活性和菌体干质量的变化如图2所示。
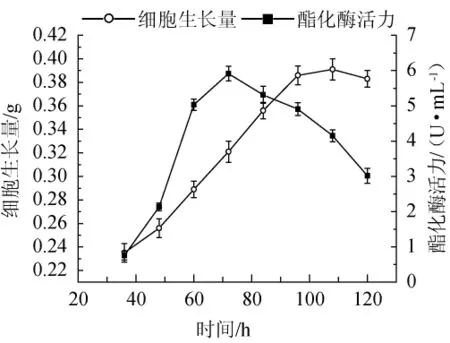
图2 紫色红曲霉HQ发酵过程中酯酶活力和菌体干质量随培养时间的变化规律Fig.2 Changes of esterase activity and dry weight of mycelia of Monascus purpureusHQ with culture time during fermentation process
由图2可知,菌株HQ在发酵过程中,培养46 h后,菌株HQ进入快速生长期,细胞生长量快速增加,96 h达到稳定期,生长110 h后,细胞生长量开始减少,进入衰亡期。发酵液中的酯酶活力随培养时间的延长呈现先升高后下降的趋势,72 h时达到最大值(5.8 U/mL),继续培养酯酶活力开始下降,96 h时达到4.8 U/mL。
2.3 胞外酯酶的分离纯化
两步硫酸铵沉淀法中硫酸铵浓度与酯酶活性的对应关系见图3。
由图3A可知,当硫酸铵饱和浓度为50%时,残留酯酶活性最高,为7.82 U/mL。因此,在第一沉淀步骤中选择50%硫酸铵饱和浓度。由图3B可知,经50%饱和硫酸铵处理后的粗酶液,再次添加硫酸铵,硫酸铵饱和浓度达到80%时,酯酶活力最大,为10.53 U/mL,饱和度>80%之后,酯酶活力急剧减小。因此在第二次沉淀步骤中选择硫酸铵饱和度为80%。
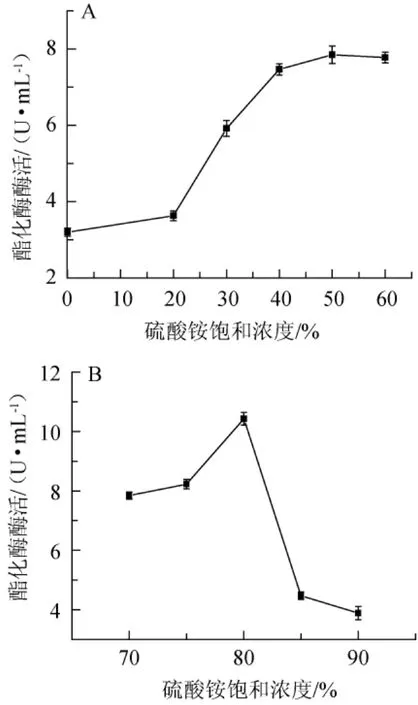
图3 两次硫酸铵盐析沉淀的硫酸铵饱和浓度与酯酶活力的对应关系Fig.3 Correspondence relationship between ammonium sulfate saturation of ammonium sulfate two-stage precipitation and esterase enzyme activity
二步饱和硫酸铵盐析处理得到的沉淀用20 mmol/L Tris-HCl(pH 8.0)溶解,加入到丁基琼脂糖柱中,以含不同浓度硫酸铵的20mmol/LTris-HCl(pH8.0)缓冲液梯度洗脱,将具有最大酯酶活力的组分收集合并,然后利用Superdex G-200柱纯化,纯化后进行SDS-PAGE(12%丙烯酰胺),结果如图4所示。

图4 SDS-PAGE图Fig.4 Electrophoretogram of SDS-PAGE
由图4可知,经二步饱和硫酸铵盐析、丁基琼脂糖凝胶柱和Superdex G-200柱纯化,酯酶经SDS-PAGE(12%丙烯酰胺)分离后显示出单一的蛋白条带,表明该蛋白具有高纯度,且其分子质量为60 kDa,命名该蛋白质为ESM1。酯酶ESM1的纯化结果见表1。
表1 肽段序列比对结果Table 1 Comparison results of peptide sequence
由表1可知,经二步硫酸铵沉淀和丁基琼脂糖凝胶柱纯化后,检测到的总蛋白含量为0.59 mg,经过Superdex G-200柱纯化后,最终获得的酶蛋白含量为0.06mg。200mL粗酶液经纯化后大约能获得0.06 mg的纯酯酶蛋白。
2.4 蛋白质质谱分析
通过MALDI-TOF-MS分析,获得酯酶ESM1的肽质量指纹图谱,结果如图5所示。酯酶ESM1的肽段序列比对结果见表2。
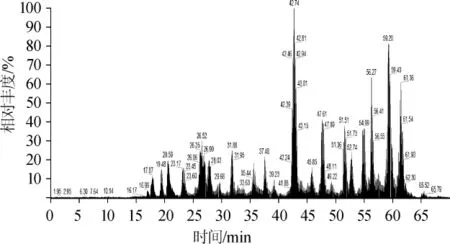
图5 酯酶ESM1的质谱图Fig.5 Mass spectrogram of esterase ESM1

表2 肽段序列比对结果Table 2 Comparison results of peptide sequence
注:OS代表物种名;GN代表在Genbank中名字;PE代表蛋白质存在(后面数字代表蛋白质存在的个数);SV代表序列版本。
由表2可知,在NCBI中经比对发现,在红曲中有一种酸性蛋白质与筛选得到的蛋白质匹配得分最高为199分。纯化得到的酯化酶分子质量在60 kDa,而最高得分的酸性蛋白质只有41 kDa,可以说明纯化得到的蛋白质包含有一部分酸性蛋白质的肽段序列。
2.5 酯酶N-末端氨基酸序列分析
使用蛋白质测序仪检测纯酯酶ESM1的前10个N-末端氨基酸残基序列,N-末端氨基酸残基序列为AOPEEDAAND。通过氨基酸残基比对发现,该酯酶与其他真菌菌株的酯酶无同源性。
2.6 酯酶ESM1酶学性质的研究
2.6.1 酯化温度对酯酶活性及稳定性的影响
酯化温度对酯酶ESM1活性及稳定性的影响如图6所示。

图6 温度对酯酶ESM1活性(a)及稳定性(b)的影响Fig.6 Effect of temperature on the activity(a)and stability(b)of esterase ESM1
由图6a可知,酯酶ESM1的最适温度为60℃。当温度<60℃时,酶活性随温度的升高而增加;温度>65℃之后,酶活性急剧下降。由图6b可知,在30℃条件下水浴60min内,酯酶活性变化不显著(P>0.05),因此酯酶ESM1在30℃时具有较好的稳定性;当温度升高至50℃时,酯酶ESM1活性随水浴时间的延长而降低,40min后趋于稳定,相对酶活为60%;温度达到60℃时,酯酶ESM1的半衰期为15 min;水浴温度达到70℃时,水浴8min后相对酶活<50%,随后,随着水浴时间的延长,酯酶活性迅速下降,70℃时酯酶半衰期为8min。
2.6.2 pH值对酯酶活性和稳定性的影响
pH对酯酶ESM1活性及稳定性的影响结果如图7所示。
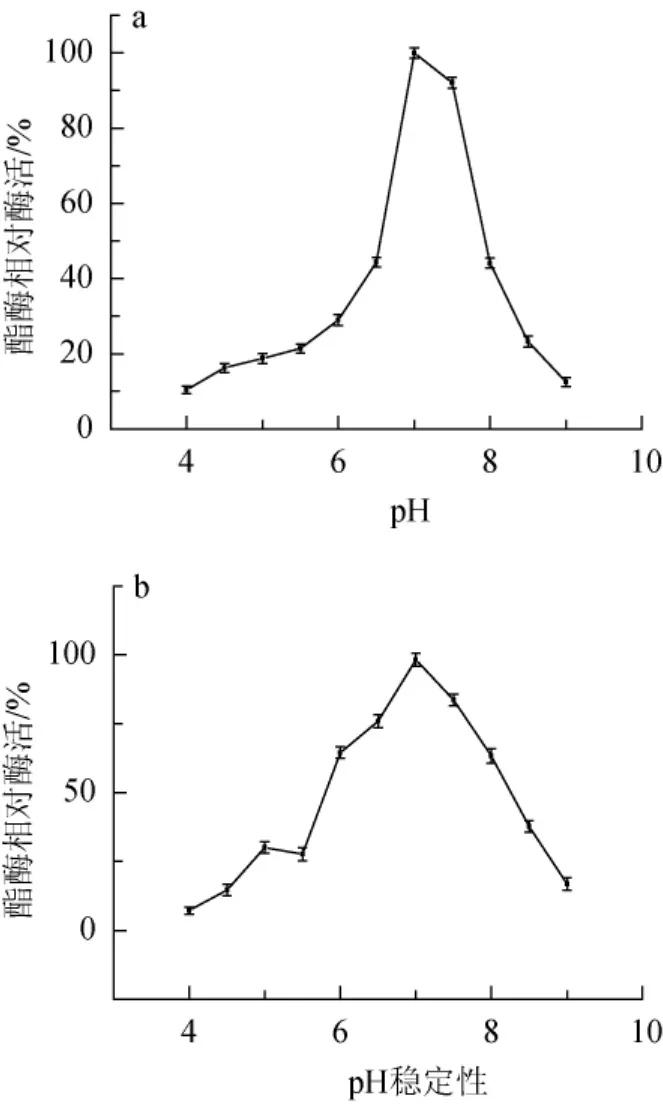
图7 pH对酯酶ESM1活性(a)及稳定性(b)的影响Fig.7 Effect of pH on the activity(a)and stability(b)of esterase ESM1
由图7a可知,当反应体系的pH值为4.0时,相对酶活仅为10%,说明在该pH条件下酯酶ESM1活性受到抑制;随着pH的升高,酯酶ESM1活性在pH值为7.0时达到最大值;在pH值为7.5时,酯酶活性略有下降;当pH>7.5之后,酯酶ESM1活性急剧下降,表明ESM1在中性条件下具有较高的活性。由图7b可知,当pH值为4.0时,酯酶ESM1相对酶活最低,为8%,表现出对强酸的不耐受性;随着pH值的增加,酯酶活性逐步升高,pH值为7.0时酯酶ESM1相对酶活达到最大,且表现出较好的稳定性。随着pH的进一步升高,酯酶活性下降,在pH为9.0时,酯酶ESM1活性最低。
2.6.3 金属离子对酯酶ESM1活性的影响
不同金属离子对酯酶ESM1活性的影响结果见图8。
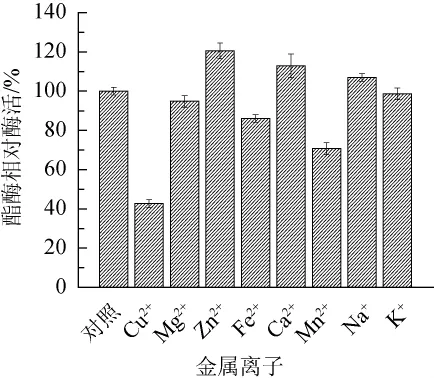
图8 金属离子对酯酶ESM1活力的影响Fig.8 Effect of metal ions on the activity of esterase ESM1
由图8可知,Zn2+、Ca2+和Na+对酯酶ESM1活力有促进作用,其中Zn2+促进作用最高,而Cu2+、Mg2+、Fe2+和Mn2+对酯酶ESM1活力有抑制作用,其中Cu2+表现出较强的抑制作用,抑制60%的酯酶活力,分析原因可能是由于Cu2+影响底物与酯酶的催化活性中心结合,使酯酶利用底物效率降低。Mg2+、Fe2+、Mn2+分别表现出97%、86%、70%、98%的抑制。
3 结论
本研究从白酒高温大曲中筛选出一株产酯酶的菌株HQ,经分子生物学鉴定为紫红曲霉(Monascus purpureus)。从M.purpureus的液体发酵液中分离纯化得到高活性酯酶,命名为ESM1。经质谱分析和N端测序发现,纯化后的酯酶分子量为60 kDa,具有酸性蛋白酶序列,是一种尚未报道的新型酯酶。ESM1酶学性质研究表明,ESM1在60℃、pH 7.0条件下具有良好的酯化能力,在温度为50℃的环境和中性环境中表现出良好的稳定性,Zn2+有助于提高酯酶ESM1的活性,而Cu2+抑制ESM1的活性。紫色红曲霉为传统发酵白酒生产中的菌种选择、优化或酶的直接添加提供了基础,同时也为生产更优质的白酒提供了可能。

