植物乳杆菌发酵对猕猴桃抗氧化物质含量及抗氧化活性的影响
张业芳,唐 诗,周 艳*,杨 娜,张清海
(贵州医科大学 食品安全学院,贵州 贵阳 550000)
猕猴桃(Actinidia)属于猕猴桃科猕猴桃属浆果类藤本植物,又名奇异果、杨桃、基维果。其果汁多肉厚,质地柔软,含有丰富的糖、蛋白质、矿物质、维生素、多酚、黄酮类化合物[1]。研究表明,猕猴桃具有润肠通便[2]、抑制癌细胞增殖[3-4]、调节脂肪细胞分化[5]等生理功能。因此,猕猴桃成为了消费者日常食用较多的水果之一。近年,我国猕猴桃产业发展迅速,已经成为了世界上猕猴桃种植面积和产量最大的国家,在陕西、四川、贵州、浙江等地形成了一定的产业规模。
猕猴桃属于典型的呼吸跃变型水果,采摘后容易变软,甚至失去食用价值,每年由此而造成的损失高达25%[6]。因此,深入研究猕猴桃的营养、保健价值,开发猕猴桃系列健康食品是促进我国猕猴桃产业可持续、健康发展的必由途径。益生菌发酵果蔬类制品由于能改善新鲜蔬菜的感官特性,并提高果蔬的营养价值,以及良好的健康促进作用[7-8],引起了学术界和市场的强烈关注。研究表明,乳酸菌发酵提供的酸性环境,可以保护维生素不被氧化[9];同时乳酸菌影响果蔬多酚的组成,进而影响果蔬的抗氧化能力[10-11]。DI C R等[12]发现,通过植物乳杆菌(Lactobacillus plantarum)发酵的番茄汁在保藏过程中能维持抗坏血酸含量在120~140mg/L,而直接保藏的番茄汁其含量下降至60~90mg/L;XIAO Y等[13]研究显示,相比于未发酵的大豆乳清,植物乳杆菌B1-6发酵大豆乳清能提高其总酚酸和异黄酮苷元的含量,提高自由基清除能力,降低脱氧核糖核酸(deoxyribonucleic acid,DNA)的氧化损伤;BISAKOWSKI B等[14]利用植物乳杆菌S1对红洋葱发酵72 h,促使槲皮素二糖苷向抗氧化活性更强的槲皮单糖苷的转化。然而,益生菌发酵对果蔬抗氧化活性变化的机制并不清楚。
因此,本研究以贵州优势猕猴桃品种——“贵长”为研究对象,在实验室前期研究得到的植物乳杆菌发酵猕猴桃果浆的最适发酵条件基础上,分析猕猴桃果浆在发酵过程中总酚酸、总黄酮及维生素C(vitamin C,VC)含量和抗氧化活性的变化,分析抗氧化物质含量与抗氧化活性的相关性,并采用液质联用(liquid chromatography-mass spectrum,LC-MS)仪测定酚酸和黄酮的组成,探讨植物乳杆菌发酵对猕猴桃果浆抗氧化活性影响的因素,同时可以为猕猴桃乳酸菌发酵饮料生理功能的进一步探讨提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌冻干粉:山东中科嘉亿生物工程有限公司。
1.1.2 试剂
草酸、碳酸氢钠、碳酸钠、无水乙醇、甲酸(均为分析纯):天津市科密欧化学试剂有限公司;2,6-二氯靛酚钠盐、福林酚试剂、1,1-二苯肼-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):北京索莱宝科技有限公司;2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2′-azino-bis(3-ethylbenzothiazolin-6-sulfonic acid)diammonium salt,ABTS)(纯度≥98%)、抗坏血酸标准品(纯度≥99%)、甲醇(色谱纯):美国Sigma公司。
1.2 仪器与设备
LT1002C型电子天平:常熟市天量仪器有限责任公司;721型可见分光光度计:上海菁华科机仪器有限公司;Waters Xevo TQ-S Micro三重四极杆LC-MS仪:美国Waters公司。
1.3 方法
1.3.1 植物乳杆菌发酵猕猴桃果浆的制备
按照文献[15]中植物乳杆菌发酵猕猴桃果浆的最佳工艺条件制备猕猴桃果浆,测定其理化指标(乳酸菌活菌数、总酸含量、pH值)、抗氧化物质(维生素C、总酚酸、总黄酮)含量及其抗氧化活性(DPPH自由基清除能力、ABTS自由基清除能力)、酚酸和黄酮的组成。
1.3.2 理化指标的测定
乳酸菌活菌数的测定:参照国标GB 4789.35—2016《食品微生物学检验乳酸菌检验》进行测定[16]。
总酸含量的测定:参照国标GB/T 12456—2008《食品中总酸的测定》中酸碱滴定法检测总酸含量[17]。
pH的测定:采用pH计测定猕猴桃果浆的pH值。
1.3.3 抗氧化物质含量的测定
VC含量的测定:参照国标GB/T 5009.86—2016《食品中抗坏血酸的测定》,采用2,6-二氯靛酚法检测VC的含量[18]。
总酚酸含量的测定:取10 mL发酵后的猕猴桃果浆样品,加入30 mL体积分数80%的甲醇,在60℃、450 W条件下超声20 min,离心取上清,待测。采用福林酚法检测样品中总酚酸的含量[19]。以没食子酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制没食子酸标准曲线。标准曲线回归方程为y=0.009 0x+0.103 5,R2=0.999 4。
总黄酮含量的测定:采用亚硝酸钠-硝酸铝比色法测定样品中总黄酮的含量[20]。以芦丁质量浓度(x)为横坐标,吸光度值(y)为纵坐标测绘制芦丁标准曲线。标准曲线回归方程为y=0.001 6x+0.005 5,R2=0.999 2。
1.3.4 抗氧化能力的测定
DPPH自由基清除能力的测定参考文献[19],并稍作修改:取一定量的各处理猕猴桃果浆于4500r/min条件下离心10 min,取上清待测。吸取各待测样本45 μL,加入5 mL DPPH溶液,漩涡振荡混匀,37℃条件下避光水浴30 min,在波长517 nm处测定吸光度值,记为A1,同时以45 μL蒸馏水替代样品作对照,其所测得的吸光度值为A2。DPPH自由基清除率的计算公式如下:

ABTS自由基清除能力的测定参考文献[19],并稍作修改:取一定量的各处理猕猴桃果浆于4 500 r/min条件下离心10min,取上清待测。吸取各待测样本50μL,加入5mL ABTS溶液,漩涡振荡混匀,37℃条件下避光水浴30 min,在波长746 nm处测定吸光度值,记为A1,同时以50 μL蒸馏水替代样品作对照,其所测得的吸光度值为A2。ABTS自由基清除率的计算公式如下:

1.3.5 多酚组成的测定
分别取发酵前、后的猕猴桃果浆样品的提取液,经过0.22 μm的有机滤膜过滤后备用。采用LC-MS法测定样品中的酚酸和黄酮的组成[21]。
液相色谱条件:色谱柱为WatersACQUITYUPLCBEH C18(2.1 mm×100 mm);流动相A为0.25%甲酸水溶液;流动相B为0.25%甲酸-甲醇溶液;流速为0.3 μL/mL;进样量为10 μL;柱温为35℃;光电二极管阵列(photo-diode array,PDA)检测,200~500 nm连续扫描。梯度洗脱程序见表1。
质谱检测条件:多反应监测(multiple reaction monitoring,MRM)模式,喷雾电压2.0 kV,锥孔电压30 V,脱溶剂温度400℃,脱溶剂气(N2)1 000 L/h。质谱扫描条件:电喷雾电离(electronic spray ionization,ESI)正离子模式(喷雾电压3.0 kV,锥孔电压30 V,脱溶剂温度400℃,脱溶剂气(N2)1 000 L/h,扫描范围100~2 000 m/z);ESI负离子模式(喷雾电压0.5 kV,锥孔电压30 V,脱溶剂温度400℃,脱溶剂气(N2)1 000 L/h,扫描范围100~2 000 m/z)。

表1 梯度洗脱程序Table 1 Gradient elution program
采用峰面积归一化法进行定量,其结果用相对含量(%)表示。
1.3.6 统计学分析
实验均重复3次,结果以平均数±标准误差(x¯±s)表示。采用SPSS 17.0软件中的单因素方差分析对试验数据进行处理,数据多重比较采用Turkey法,P<0.05表示差异有统计学意义。采用Person进行相关性分析。
2 结果与分析
2.1 猕猴桃果浆发酵过程中理化指标的变化
猕猴桃果浆经植物乳杆菌发酵后,发酵过程中乳酸菌数、总酸含量和pH值的变化如图1所示。
由图1A可知,随着发酵时间的延长,猕猴桃果浆中植物乳杆菌的含量呈现先降低后增高的趋势,与发酵0 h相比,发酵7 h时,植物乳杆菌的活菌数(5.82 lgCFU/g)显著降低(P<0.05),随后逐渐升高;发酵28 h时,植物乳杆菌的活菌数为9.95 lgCFU/g。由图1B可知,随着发酵时间的延长,猕猴桃果浆中总酸的含量逐渐升高,与发酵0 h相比,发酵14 h时,总酸含量显著升高(P<0.05),为7.97 g/kg;发酵28 h时,总酸含量达到16.18 g/kg。由图1C可知,随着发酵时间的延长,猕猴桃果浆的pH值逐渐降低,发酵14 h后,pH值与初始发酵时的pH值呈现显著差异(P<0.05);发酵28 h时pH值为4.43。发酵初期,植物乳杆菌的含量降低,可能是对发酵体系不适应,经过一段时间的适应后,植物乳杆菌利用体系中营养物质(碳水化合物、蛋白质等)快速增殖,产生乳酸等小分子有机酸,从而使总酸的含量升高、pH值下降。
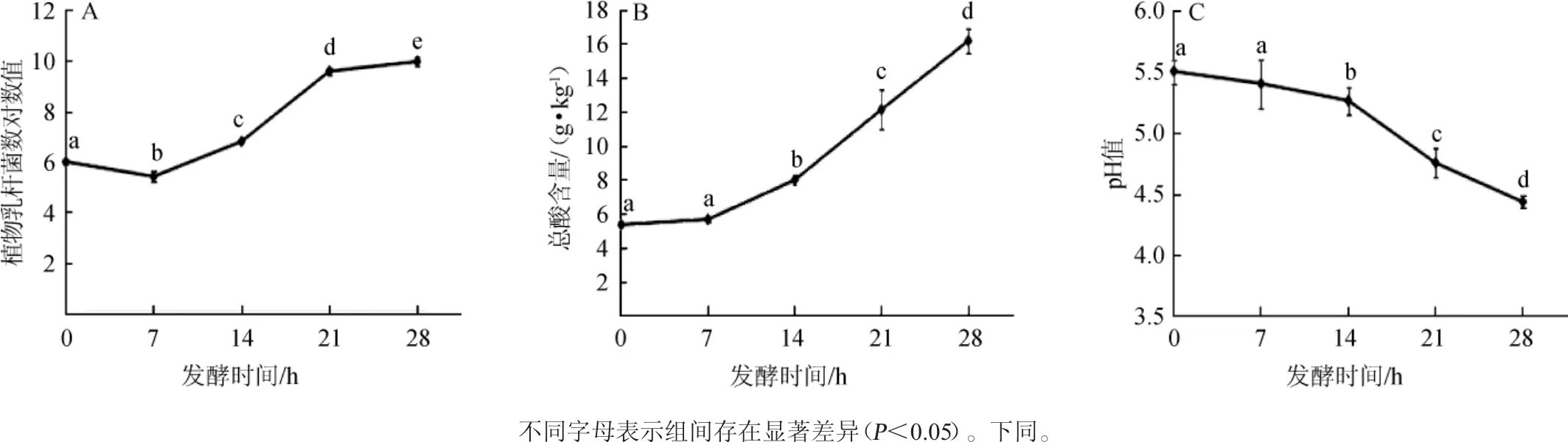
图1 发酵过程中猕猴桃果浆中植物乳杆菌数(A)、总酸含量(B)和pH值(C)的变化Fig.1 Changes of Lactobacillus plantarumcount(A),total acid content(B)and pH value(C)in kiwifruit pulp during fermentation process
2.2 植物乳杆菌发酵对猕猴桃果浆中抗氧化物质含量的影响
植物乳杆菌发酵对猕猴桃果浆中抗氧化物质含量的影响结果见图2。
由图2A可知,与发酵前猕猴桃果浆中的总酚酸含量(103.16mg/100g)相比,发酵14h时,猕猴桃果浆中的总酚酸含量(108.55 mg/100 g)无显著提高(P>0.05);发酵21 h时,总酚酸含量(150.73mg/100g)显著提高(P<0.05);发酵28 h时,总酚酸含量上升至168.04mg/100g,较发酵前提高62.89%。
由图2B可知,随着发酵时间的延长,猕猴桃果浆中总黄酮的含量呈现先升高后降低的趋势。与发酵前(21.75mg/100 g)相比,发酵7 h时,总黄酮含量(34.50 mg/100 g)显著升高(P<0.05);到发酵21 h时,总黄酮含量达到最高,为42.55 mg/100 g;发酵21 h后,总黄酮的含量开始降低;发酵28 h时,总黄酮的含量为36.75 mg/100 g,但仍显著高于发酵前(P<0.05),较发酵前提高68.97%。结果表明,植物乳杆菌发酵有利于提高猕猴桃果浆中总酚酸和总黄酮的含量,与SZWAJGIER D等[22-23]的研究结果一致。
由图2C可知,发酵过程中猕猴桃果浆中VC的含量比较稳定,在发酵过程中无显著差异性(P>0.05)。分析原因可能是乳酸菌代谢产生大量乳酸,降低体系pH值,形成了一个酸性环境,使VC含量相对稳定[9,12]。

图2 发酵过程中猕猴桃果浆中总酚酸(A)、总黄酮(B)及VC(C)含量的变化Fig.2 Changes of the contents of total phenolic acid(A),total flavonoids(B)and VC(C)in kiwifruit pulp during fermentation process
2.3 植物乳杆菌发酵对猕猴桃果浆抗氧化能力的影响
乳酸菌发酵果蔬对果蔬抗氧化能力的影响比较复杂。PIANPUMEPONG P等[24]发现植物乳杆菌发酵能增强姜黄的铁离子还原能力,同时降低小鼠血液中自由基数量;DI C R等[25]应用戊糖片球菌(Pediococcus pentosaceus)SWE5和植物乳杆菌FP3混合发酵甜樱桃果泥,提高了其抗氧化能力;同时也有文献报道[26-27],乳酸菌发酵能降低果蔬对自由基的清除能力。植物乳杆菌发酵对猕猴桃果浆抗氧化能力的影响结果见图3。
由图3A可知,与发酵前猕猴桃果浆的DPPH自由基清除率(46.79%)相比,发酵7 h时,植物乳杆菌对猕猴桃果浆的DPPH自由基清除率(46.33%)无显著影响(P>0.05);发酵14h时,DPPH自由基清除率(58.13%)显著提高(P<0.05);发酵28 h时,猕猴桃果浆对DPPH自由基的清除率为75.25%,与发酵前相比提高60.82%。
由图3B可知,与发酵前猕猴桃果浆的ABTS自由基的清除率(54.60%)相比,发酵7 h时,猕猴桃果浆对ABTS自由基的清除率(51.24%)略微降低(P>0.05);发酵28 h时,其对ABTS自由基的清除能力(69.19%)显著提高(P<0.05),较发酵前提高了26.72%。由此可知,植物乳杆菌发酵猕猴桃果浆有利于提高猕猴桃果浆的抗氧化能力。

图3 发酵过程中猕猴桃果浆的DPPH自由基(A)及ABTS自由基(B)清除率的变化Fig.3 Changes of scavenging rate of DPPH free radical(A)and ABTS free radical(B)of kiwifruit pulp during fermentation process
2.4 相关性分析
为了进一步分析植物乳杆菌发酵猕猴桃果浆过程中引起猕猴桃果浆抗氧化能力变化的因素,将自由基清除能力与总酚酸、总黄酮以及VC的含量进行相关性分析。DPPH自由基清除能力与总酚酸、总黄酮以及VC的含量的相关性分析结果见图4。
由图4可知,植物乳杆菌发酵后的猕猴桃果浆中总酚酸的含量与DPPH自由基清除能力呈正相关性,R2=0.892,P=0.000;总黄酮含量与DPPH自由基清除能力呈正相关性,R2=0.603,P=0.017;VC含量与DPPH自由基清除能力无相关性。
ABTS自由基清除能力与总酚酸、总黄酮以及VC的含量的相关性分析结果见图5。

图4 DPPH自由基清除能力与总酚酸(A)、总黄酮(B)、VC(C)含量的相关性分析Fig.4 Correlation analysis of DPPH radical scavenging capacity with total phenolic acid(A),total flavonoids(B)and VC(C)contents

图5 ABTS自由基清除能力与总酚酸(A)、总黄酮(B)、VC(C)含量的相关性分析Fig.5 Correlation analysis of ABTS radical scavenging capacity with total phenolic acid(A),total flavonoids(B)and VC(C)contents
由图5可知,植物乳杆菌发酵后的猕猴桃果浆中总酚酸的含量与ABTS自由基的清除能力呈正相关,R2=0.785,P=0.001;总黄酮含量与ABTS自由基清除能力呈正相关,R2=0.519,P=0.047;VC含量与ABTS自由基清除能力无相关性。
由此得出,植物乳杆菌发酵过程中,猕猴桃果浆的自由基清除能力主要与总酚酸和总黄酮的变化有关。
2.5 植物乳杆菌发酵对猕猴桃果浆酚酸和黄酮组成的影响
经相关性分析,猕猴桃经植物乳杆菌发酵后,影响了总酚酸和总黄酮的含量,而它们的变化与抗氧化能力密切相关,因此通过LC-MS检测植物乳杆菌发酵前、后猕猴桃果浆中酚酸和黄酮组成的变化,结果如表2所示。
由表2可知,发酵前猕猴桃果浆中共检测出7种物质,以新绿原酸、儿茶素和咖啡酸为主,占总量的89.5%。猕猴桃果浆经植物乳杆菌发酵后,共检测出9种物质,新绿原酸、6,7-二羟基香豆素和原儿茶酸相对含量较高,占总量的80.21%。与发酵前相比,咖啡酸未检出,新增加了6,7-二羟基香豆素、芥子酸、原儿茶酸。分析原因可能是植物乳杆菌在发酵过程中,会产生一些酚酸脱羧酶,使酚类物质之间实现相互转化,从而改变其抗氧化活性[28]。儿茶素又称单宁,可在儿茶素加氧酶的作用下代谢生成原儿茶酸和间苯三酚羧酸[29]。ALBERTO M R等[30]研究发现,从葡萄酒中分离的希氏乳杆菌(Lactobacillushilgardii)具有代谢儿茶素和没食子酸的能力。推测猕猴桃果浆中新检测出的原儿茶酸可能是植物乳杆菌代谢儿茶素生成的。而芥子酸和6,7-二羟基香豆素如何产生,还值得进一步研究。
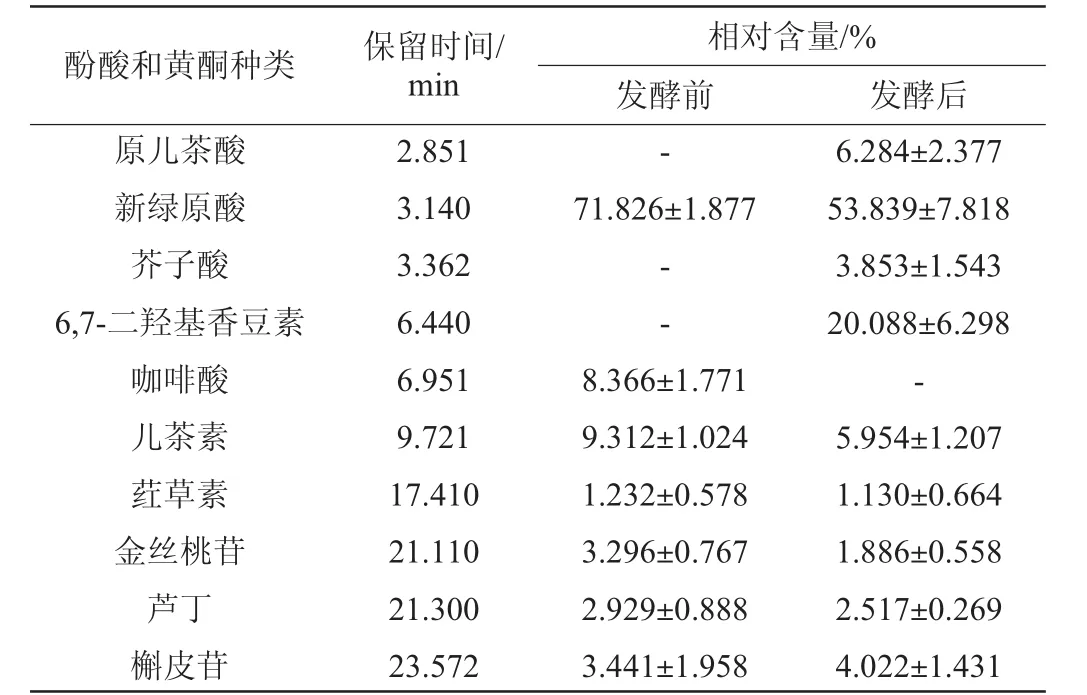
表2 植物乳杆菌发酵对猕猴桃果浆中酚酸和黄酮组成的影响Table 2 Effect of Lactobacillus plantarumfermentation on phenolic acid and flavonoids composition in kiwifruit pulp
由此得出,植物乳杆菌可能参与了猕猴桃酚酸和黄酮的代谢转化,进而引起发酵后猕猴桃果浆抗氧化能力增强。
3 结论
本研究探讨了植物乳杆菌发酵对猕猴桃果浆中抗氧化物质含量及抗氧化能力的影响。结果表明,植物乳杆菌发酵过程中,猕猴桃果浆中植物乳杆菌活菌数、总酸含量升高,pH值下降;显著提高了猕猴桃果浆中总酚酸和总黄酮的含量(P<0.05),进而提高猕猴桃果浆的抗氧化能力;猕猴桃果浆抗氧化能力的变化与总酚酸、总黄酮含量的变化密切相关;植物乳杆菌发酵参与了猕猴桃酚酸和黄酮的代谢转化,植物乳杆菌发酵后的猕猴桃果浆中新生成了2,6-二羟基香豆素、芥子酸和原儿茶酸。因此,植物乳杆菌发酵提高猕猴桃果浆抗氧化能力,是一种提高猕猴桃营养价值的加工方式。但是,植物乳杆菌发酵对果蔬酚酸和黄酮发生代谢转化的机制,以及这一变化对果蔬的生物活性产生何种影响并不明确,需要进一步研究。

