EIF-GT/PCL纳米纤维电纺膜体外诱导hADSCs向表皮细胞表型转化的相关研究
燕丽 郑蕊 沈征宇
皮肤是人体最大的器官,位于人体表面,具有吸收营养、排泄废物、调节体温和保护机体免受外界伤害的作用[1]。皮肤的完整性破坏时,易导致急慢性感染、电解质紊乱和体液流失等问题[2]。当皮肤创面超过4 cm直径时,需借助皮肤移植才能较好愈合[3]。但无论是皮肤的自体移植、异体移植或异种移植,都存在着来源不足、疾病传播和免疫排斥等问题,组织工程皮肤成为解决这些问题并极具应用前景的可能的方法,近年来得到越来越多的关注[4-5]。
静电纺丝技术是通过高压静电场,将符合目标组织化学、生物、物理要求的组分进行交联,从而制作亚微米至纳米级别的复合型组织工程支架的常用技术[6]。 明胶(Gelatin,GT)/聚己内酯(Polycaprolactone,PCL)纳米纤维电纺膜被证实在组织工程皮肤领域具有良好的应用前景。其中,GT是一种细胞外基质中提取的水溶性天然成分,为细胞黏附、增殖、分化提供适宜空间;PCL是一种脂溶性人工合成材料,其降解速率较缓,具有良好的机械特性[7]。将GT与PCL等质量比例结合并进行混合电纺,制作的支架材料具有孔隙率大、比表面积高、力学强度好等优点,且生物相容性好。动物实验证实,GT/PCL纳米纤维电纺膜能显著提高皮肤修复能力[8]。
皮肤创面愈合过程包含炎症期、增殖期和皮肤结构重塑期[2],这些过程中不仅需要力学支撑,还需要众多细胞、细胞因子和生长因子的参与。表皮生长因子(Epidermal growth factor,EGF)可以促进表皮细胞的增殖和迁移,胰岛素可减轻炎症反应,氢化可的松和维甲酸(Retinoic acid,RA)能促进表皮生长和诱导干细胞分化[9]。研究证实,联合这些活性物质能促进表皮生长和加速伤口愈合,并将其简称为表皮诱导因子复合体(Epidermal inducing factors,EIF)[10]。
本研究拟通过混合静电纺丝技术制备含有EIF的可降解的GT/PCL纳米纤维电纺膜,研究其生物学特性和体外促进hADSCs向表皮细胞表型转化的可行性,为制备可应用于临床的组织工程表皮提供实验基础。
1 材料和方法
1.1 试剂和设备
GT(Gelatin Powder,G1890)、RA(Retinoic acid,R2625)、氢化可的松(Hydrocortisone,H0888)、胰岛素(Recombinant insulin human,I2643)购自美国 Sigma公司;PCL(Polycaprolactone,440744-500G)购自美国Aldrich公司;人表皮生长因子重组蛋白(Human EGF Recombinant Protein,BMS320)购自美国eBioscience公司。
磁力搅拌器 (巩义予华仪器有限责任公司);精确微量注射泵(LSP01-1A,保定市兰格恒流泵有限公司);静电纺丝仪器(KDS-100型,美国Le-Parmer公司);静电纺丝高压电源 (天津市东文高压电源厂);真空冷冻干燥仪(上海实验室仪器有限公司);场发射扫描电子显微镜(SEM,S-4800型,日本JEOL公司);全自动透射电子显微镜 (TEM,JEM-2010F型,日本JEOL公司);生物力学测试仪(Instron-5542,美国Instron公司);生物力学分析仪(Instron 5542-C4598,美国);全波长酶标仪(BioTek ELx800,美国BioTek公司);倒置荧光显微镜(奥林巴斯IX53,日本奥林巴斯株式会社);单反相机(黑卡DSC-RX100 M3,日本索尼公司)。
1.2 纳米纤维电纺膜的制备与分组
EIF-GT/PCL纳米纤维电纺膜(实验组):称取等质量的 GT 与 PCL 粉剂 (GT∶PCL 质量比例=1∶1)溶于六氟异丙醇(HFIP),调节质量体积比为10%,配置GT/PCL溶液。微量天平称取EIF各组分粉剂,加入GT/PCL溶液中搅拌均匀,使各组分终浓度为:1 μg/mL EGF、40 μg/mL 氢化可的松、0.5 mg/mL 胰岛素、0.5 μmol/L RA,得到EIF-GT/PCL溶液。将EIF-GT/PCL溶液置于精确微量注射泵中,连接静电纺丝仪器,接通静电纺丝高压电源。调整静电纺参数:电压为15 KV,推进速度0.6 mL/h,接收距离为15 cm,室温为25℃,环境湿度40%~50%;行混合静电纺丝,以铝箔接收(图1)。
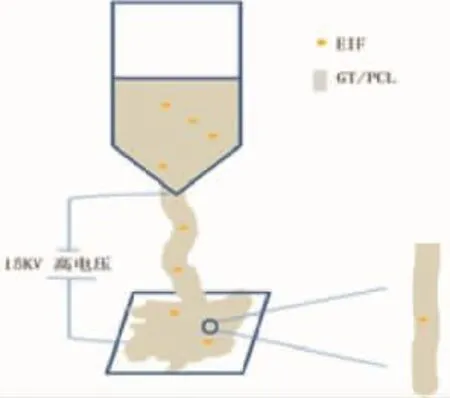
图1 混合静电纺丝法制备EIF-GT/PCL纳米纤维电纺膜模式图Fig.1 The schematic view of EIF-GT/PCL electrospun nanofibrous membrane by blending electrospun technology
GT/PCL纳米纤维电纺膜(对照组):将单纯GT/PCL溶液置于精确微量注射泵中,余同实验组。
将上述两组所得静电纺丝分别置入含有25%戊二醛蒸汽的密闭容器皿中熏蒸30 min,以达到充分交联,最终真空冻干24 h取出备用。
1.3 纳米纤维电纺膜检测指标
1.3.1 大体和微观形貌表征
将实验组和对照组纳米纤维电纺膜裁减为直径15.6 mm的圆片,比较两种材料的大体表面形态。两组静电纺丝过程中,直接将部分纺丝收集在300目铜网碳支持膜(苏州晶硅科技有限公司)上,将这部分纺丝行透射电镜观察单根纳米纤维特征,并以扫描电镜观察纳米纤维排布情况。
1.3.2 力学特性比较
将实验组和对照组两种纳米纤维电纺膜裁剪为30 mm×10 mm×(0.1~0.2) mm 的长方形,各取 5片,设定最大拉力10 N,拉伸速度10 mm/min,最终拉伸长度40 mm,进行拉力测试。比较实验组和对照组的弹性模量和样品破裂前能承受的最大拉力载荷。
1.3.3 药物释放曲线
将两组电纺膜分别裁减为每片质量 (50±2)mg,分别浸泡于装有10 mL PBS的离心管中,置于37℃恒温摇床中避光震荡。每组设5个平行样本。在第1、3、6、9、12 和 15 天,从每个离心管中分别取 1 mL上清液待测,并加入1 mL新鲜PBS。用EGF代表EIF的生物活性因子成分,采用人EGF免疫定量试剂盒,参照说明书进行上清液中EGF含量测定,计算EGF的累积释放率。

1.4 hADSCs的培养
hADSCs(第3代)取自上海市组织工程研究重点实验室细胞样本库。将保存有hADSCs的冻存管从液氮罐取出并迅速复苏,以1×104cells/mL的密度将hADSCs接种于24孔板,置于37℃,5%CO2恒温培养箱中进行培养。
1.5 hADSCs增殖曲线测定
光学显微镜下观察hADSCs形态,通过CCK-8法测定细胞增殖曲线。检测当天吸除24孔板中原有培养液,再加入500 μL新鲜培养液及50 μL CCK-8试剂,置于37℃恒温CO2培养箱2 h,然后每孔吸取100 μL培养液于96孔板中,450 nm处测定每孔吸光度值,绘制增殖曲线。
1.6 hADSCs-纳米纤维电纺膜复合物的制备
实验组和对照组各取6片直径15.6 mm的圆形纳米纤维电纺膜,平铺入24孔板内。紫外线消毒2 h。将hADSCs以1×106cells/mL的密度接种于纳米纤维电纺膜上并覆盖其表面,加入低糖DMEM培养液,将24孔板置入37℃、5%CO2的恒温培养箱中培养,每2天换液。
1.7 hADSCs-纳米纤维电纺膜复合物检测指标
1.7.1 hADSCs黏附情况和增殖情况
分别于第1天和第7天将hADSCs-纳米纤维电纺膜复合物取出,以2.5%戊二醛固定,扫描电镜观察hADSCs在两组电纺膜上的黏附情况;CCK-8法测定第1、3、5、7天时hADSCs在纳米纤维电纺膜上的增殖情况。
1.7.2 电纺膜诱导hADSCs向表皮细胞表型转化
CK10是一种干细胞向表皮细胞表型转化早期标志;CD105是间充质干细胞特异性标志。将hADSCs分别接种于两组电纺膜上培养7 d后,加入CK10和CD105单克隆抗体(一抗),4℃冰箱孵育过夜,PBS冲洗3次后,加入AlexaFluro 594和AlexaFluro 488(二抗),室温下孵育 60 min,PBS清洗 3遍,加入DAPI复染细胞核,荧光显微镜下观察。
1.8 统计学分析
以SPSS软件行统计学分析,计量资料以(x±s)表示,两两比较采用t检验,计数资料以率(%)表示,采用卡方检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组电纺膜形貌特征
两组大体结构相似,均呈光滑、白色膜片,无明显凹凸不平。透射电镜显示,实验组和对照组单根纤维结构相似,粗细、密度均匀,未见明显液相分离。扫描电镜显示,实验组与对照组纤维均无黏连,无串珠;纤维间相互交错,具有一定的孔隙率(图2)。

图2 实验组和对照组大体和微观形貌观察Fig.2 The morphology of experimental group and control group
2.2 纳米纤维电纺膜理化特性比较
2.2.1 力学特性比较
实验组弹性模量(0.376±0.027) MPa,对照组弹性模量(0.381±0.021)MPa,无统计学差异(P>0.05)。实验组拉力载荷最大值(1.164±0.333)N,对照组拉力载荷最大值(1.267±0.183)N,无统计学差异(P>0.05)(图 3A、B)。
2.2.2 药物释放率比较
实验组EGF的释放曲线显示,EGF可平稳释放15 d以上,在第15天时释放率达到36.5%,释放曲线仍呈上升趋势;对照组无EGF释放(图3C)。

图3 实验组和对照组的力学特征及药物释放率比较Fig.3 Mechanical properties and the EGF accumulative release rate of the experimental group and control group
2.3 hADSCs的形态学和增殖曲线
光学显微镜下,hADSCs呈纺锤形,类成纤维细胞样;CCK-8法结果显示,细胞可稳定增殖15 d以上,在第6天进入快速增殖期,于第12天进入平台期(图 4)。

图4 hADSCs的形态学观察和增殖曲线Fig.4 Morphology of hADSCs and the proliferation assay
2.4 hADSCs-纳米纤维电纺膜复合物表征
2.4.1 hADSCs-纳米纤维电纺膜黏附情况
将hADSCs种植于实验组和对照组纳米纤维电纺膜上,扫描电镜图像示第1天时实验组与对照组细胞-纳米纤维电纺膜黏附均良好,细胞总表面积/纳米纤维电纺膜总表面积相似;第7天时黏附于纳米纤维电纺膜上的细胞相比第1天均有所增加,实验组细胞排布更紧密(图5A-D)。
2.4.2 hADSCs在纳米纤维电纺膜上增殖情况
CCK-8法显示,OD值随时间推移逐渐增加,证明两组纳米纤维电纺膜均具有良好的生物相容性。实验组上hADSCs增殖速率快于对照组(图5E)。
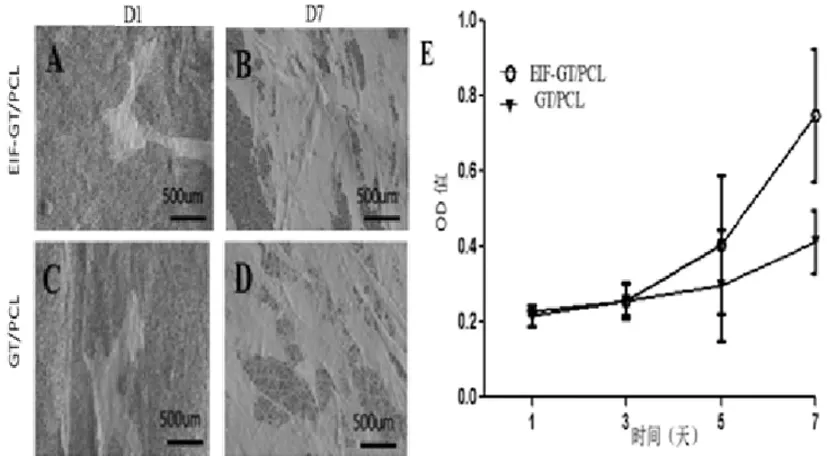
图5 细胞-纳米纤维电纺膜复合物黏附情况及细胞增殖情况Fig.5 The cell-electrospun nanofibrous membrane integrity and the growth curve of hADSCs on the two groups
2.5 电纺膜体外诱导hADSCs向表皮细胞分化
将hADSCs分别种植于两组纳米纤维电纺膜培养7 d后,实验组上的hADSCs相比对照组,CK10高表达,CD105表达减弱,形态呈扁圆形,铺路石样外观,胞间连接更为紧密,特征与角质形成细胞相似;而对照组上的hADSCs细胞不表达CK10,CD105强表达,形态类似于24孔板中培养的hADSCs原有形态(图 6)。
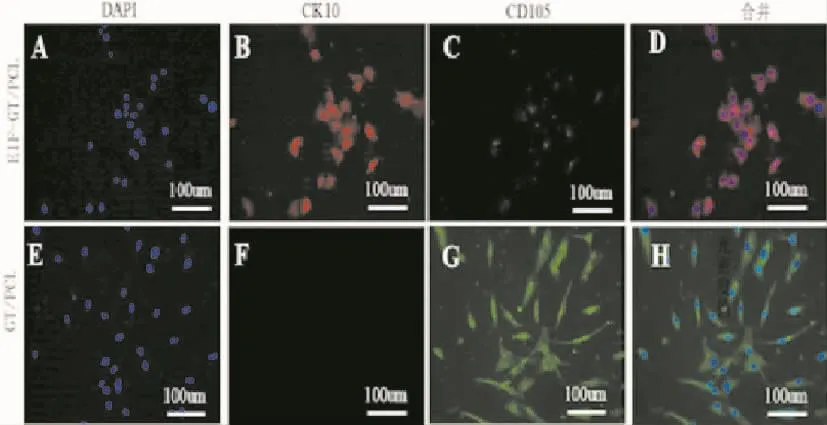
图6 两组电纺膜诱导hADSCs向表皮细胞表型转化能力Fig.6 The ability of transferring hADSCs into epithelial cell lineage of experimental group and control group
3 讨论
组织工程支架材料可覆盖皮肤创面,提供力学支撑,促进真皮胶原纤维有序排布,在皮肤缺损愈合中可广泛应用。通过静电纺丝技术制备的GT/PCL纳米纤维电纺膜,在皮肤组织工程领域已显示出良好的应用前景[11]。龙剑虹等[12]将GT/PCL纳米纤维电纺膜应用于家兔背部皮肤缺损修复,观察到修复段真皮层肉芽组织增生少,胶原排列规则。
表皮细胞的增殖和功能修复过程更为复杂,需要多种生物活性因子的动员,是皮肤组织愈合过程中的重点和难点,制备可释放刺激表皮再生的各种生长因子,从而促进表皮愈合的组织工程支架材料成为关键。
文献表明,应用组分包括EGF、胰岛素、氢化可的松和RA在内的表皮诱导因子复合体(EIF)可以促进表皮细胞的增殖和迁移,促进表皮生长和加速伤口愈合。能否利用EIF载入改良GT/PCL纳米纤维电纺膜的生物学活性,促进种子细胞向表皮细胞表型转化,目前尚无相关报道。hADSCs是一种从抽脂术后多余脂肪组织中提取出的一种具有自我更新能力和多向分化潜能的间充质干细胞[13],可促进角质形成细胞生长,抑制瘢痕形成,对伤口愈合起到促进作用[14],提高皮肤愈合质量。因此,我们以hADSCs作为本实验的种子细胞。
本实验对于EIF-GT/PCL纳米纤维电纺膜的研究主要聚焦于以下4个问题。其一,EIF的载入是否改变传统GT/PCL纳米纤维电纺膜原有形貌和力学特征;其二,载入的EIF能否达到持久缓释,从而长期发挥作用;其三,EIF的载入能否使得hADSCs黏附和增殖情况更佳;其四,EIF的载入能否具有促进hADSCs向表皮细胞表型转化的作用,从而为促进表皮细胞再生提供可能。
我们利用混合静电纺丝技术成功制备了EIFGT/PCL纳米纤维电纺膜。①大体形貌上,EIF-GT/PCL纳米纤维电纺膜表面光滑平整,无串珠;微观结构中,纳米纤维均匀细腻,无明显液相分离,说明EIF充分融合并均匀分布于GT/PCL材料中;纳米纤维相互交错,具有一定的孔隙率,有助于细胞的黏附、增殖与细胞外基质的释放;在材料力学特性上,具有一定的抗拉力和弹性,与传统GT/PCL纳米纤维电纺膜相似,EIF的载入未改变材料原有的优良的形貌特征和力学特性。②通过对EIF-GT/PCL纳米纤维电纺膜中EGF释放率进行分析显示,EIF能平稳释放15 d以上,使EIF-GT/PCL相较于传统GT/PCL材料具备长久的药物释放能力。③光学显微镜下,24孔板上培养的hADSCs细胞呈纺锤形,类成纤维细胞样;细胞增殖旺盛,活性较强。将hADSCs作为种子细胞,接种到两组纳米纤维电纺膜上,经过7 d培养后,细胞增殖旺盛,EIF-GT/PCL纳米纤维电纺膜相比于GT/PCL纳米纤维电纺膜,与hADSCs黏附更佳,hADSCs在其上增殖速度更快,故EIFGT/PCL纳米纤维膜是负载种子细胞生长的更佳载体;④通过对两组纳米纤维电纺膜上的hADSCs表面标志的免疫荧光分析,EIF-GT/PCL纳米纤维电纺膜组上的hADSCs表达向表皮细胞表型转化早期标志CK10,而间充质干细胞标志CD105表达减弱,细胞形态扁圆,胞间连接更为紧密,类似于角质形成细胞;而GT/PCL纳米纤维电纺膜上的hADSCs不表达CK10,CD105强表达。证实了EIF-GT/PCL纳米纤维电纺膜具有在体外诱导hADSCs向表皮细胞表型转化的能力;亦说明EIF-GT/PCL纳米纤维电纺膜中,EIF的活性能够正常维持,并在原位发挥作用。
综上所述,以混合静电纺丝法制备的EIF-GT/PCL纳米纤维电纺膜理化性能良好,力学特性和生物相容性佳,具有负载和维持生长因子活性并平稳释放生长因子,诱导hADSCs向表皮分化的作用,相较于单纯GT/PCL纳米纤维电纺膜,在修复皮肤缺损领域拥有更广阔的应用前景。下一步我们将把EIF-GT/PCL纳米纤维电纺膜应用于动物皮肤缺损模型的修复中,观察在体实验中其促进表皮细胞再生的能力,为制备具有我国自主知识产权的新型载药皮肤组织工程材料提供理论和实验基础。

