梅花鹿鹿茸总蛋白对庆大霉素诱导肾毒性的保护作用及其机制
孙 航,阮豪南,王露露,张 晶,
(1.吉林农业大学中药材学院,吉林长春 130118;2.长春科技学院,吉林长春 130600)
氨基糖苷类药物是较为常见的革兰阴性菌抗生素,其中庆大霉素(gentamicin,GM)具有一定的代表性[1]。有研究发现,GM的抗菌作用具剂量依赖性,但其耳毒性、肾毒性和速发型过敏性休克等严重不良反应亦会随剂量增加而增强[2]。GM用药过程中,有10%~25%患者被诱导出肾毒性,并伴有急性肾衰竭症状[3-4]。如何减轻或预防GM肾毒性仍然是当前的研究热点。
GM的肾毒性机制主要分2方面:①近端肾小管上皮细胞积聚GM,导致上皮细胞缺血或坏死等[5];② 降低肾小球滤过率,升高血清肌酐(creati⁃nine,Cr)和血尿素氮(blood urea nitrogen,BUN)含量[6]。组织病理学分析发现,GM可严重损伤肾组织结构,出现大面积组织坏死,肾小管空泡化,肾小球皱缩,细胞排列疏松,刷状缘不规则等现象。GM肾毒性产生的分子机制复杂,有研究表明,GM积聚于肾组织,从而诱导大量活性氧(reactive oxygen species,ROS)产生,导致内源性抗氧化酶活性下降和脂质过氧化产物增加,进而影响细胞膜功能及完整性、氧化还原系统失衡和线粒体膜电位下降[7-9]。同时还伴有促炎细胞因子的上调,如白细胞介素1β(interleukin-1β,IL-1β)和IL-6,并导致随后的炎症反应发生[10-11]。
《中华人民共和国药典》2015版记载,鹿茸具有壮肾阳、强筋骨和益精血等功效,主治肾阳不足,阳痿滑精、冷宫不孕、精血亏虚、神疲等证[12]。已知鹿茸中含有蛋白质、氨基酸、多肽、多糖、脂溶性成分和无机元素等[13]。鹿茸蛋白作为其主要的活性成分,具有清除自由基、修复组织、消炎和神经保护等作用[14-16]。研究发现,梅花鹿鹿茸总蛋白(Sika deer velvetantler protein,SVPr)对顺铂诱导的肾毒性具有一定改善作用[17-18]。本研究旨在探讨SVPr对GM诱导的肾毒性的保护作用及其机制。
1 材料与方法
1.1 药品、试剂和仪器
梅花鹿二杠茸于2017年采购于吉林双阳鹿场(瑞龙鹿业有限公司),经吉林农业大学王全凯教授鉴定为梅花鹿(Cervus nipponTemminck)二杠茸。SVPr由吉林农业大学中药材学院中药学研究室提取。梅花鹿茸粉碎过80目筛,取鹿茸粉末50 g,按料液比1∶10加入蒸馏水,60℃,80 Hz超声30 min,过滤,重复5次,合并提取液[14]。提取液4℃恒温搅拌,缓慢加入95%乙醇,使醇含量达85%(V/V),4℃静置4 h后,6000×ɡ离心10 min,弃上清液,以适量蒸馏水迅速溶解沉淀,冷冻干燥得SVPr,收率为20.78%。经Bradford法检测,蛋白质含量>90%。
GM(长春市修正药业有限公司,纯度≥95%,批号:20160616);芥子酸(sinapic acid,SA,合肥市博美生物科技有限责任公司,纯度≥98%,批号:20160306);DMEM/HIGH培养基、青霉素/链霉素、PBS(HyClone,美国);胎牛血清(Clark,美国);0.25%胰蛋白酶、四甲基偶氮唑盐(MTT)和二甲亚砜(DMSO)(Amresco,美国);丙二醛(malondial⁃dehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、乳酸脱氢酶(lactate dehydro⁃genase,LDH)、谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)、Cr和BUN测定试剂盒(南京建成生物工程研究所);小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-6 ELISA试剂盒(博士德生物工程有限公司);其余化学试剂均为分析纯。
BP211D电子天平(Switzerland,德国);倒置相差显微镜(Olympus,日本);XSP-BM-8CA生物显微镜(上海彼爱姆光学仪器制造有限公司);连续光谱扫描式酶标仪(美谷分子仪器有限公司);二氧化碳培养箱(Selecta,西班牙);超净工作台和高压蒸汽灭菌锅(Sanyo,日本);KQ-250DB数控超声清洗器(昆山超声波仪器有限公司);恒温鼓风干燥箱(上海申贤恒温设备厂);高速冷冻离心机(Thermo Fisher,美国);低速离心机(安徽中科中佳公司);水平摇床(东联电子技术公司);石蜡切片机(Leica,德国)。
1.2 实验动物和细胞
雄性ICR小鼠42只,SPF级,体质量18~22 g,购于长春市亿斯实验动物技术有限责任公司,动物许可证号SCXK-(吉)2011-0007。动物饲养条件符合实验动物福利伦理委员会要求,小鼠自由饮水摄食,在室温24~26℃、湿度55%~65%、明暗交替12 h(7∶00~19∶00照明)的环境下适应性饲养1周。
人胚肾细胞(HEK293细胞)由吉林农业大学动物科学技术学院分子免疫实验室提供。以含10%胎牛血清和1%青霉素、链霉素混合液的DMEM培养液在恒温37℃、5%CO2的培养箱中培养。每2 d换液,待细胞密度达75%~85%用0.25%胰蛋白酶消化并传代。取对数生长期细胞用于实验。
1.3 MTT法测定HEK293细胞存活
将HEK293细胞消化后,用含10%胎牛血清的DMEM培养液终止消化,制成单细胞悬液,并接种于96孔板,每孔1.0×104细胞,培养24 h后用于实验。设置空白对照组(含等量培养液,无细胞)。GM和SVPr以PBS溶解,以0.22 μm滤膜过滤除菌后用于实验。药物处理分2部分进行,①将HEK293细胞与GM(终浓度分别1,2,3,4,5,6,7,8和9 g·L-1)共同孵育24 h后;② 将HEK293细胞分为正常对照组(给予等量PBS)、GM模型组(给予GM 3.00 g·L-1孵育24 h)和模型+SVPr组(分别给予SVPr 1,2和4 g·L-1孵育24 h后,加入GM 3.00 g·L-1共同孵育24 h)。药物处理后,每孔加入MTT(5 g·L-1)20 μL继续培养4 h,吸弃上清液,加入DMSO 150 μL,振荡10 min,待结晶充分溶解后,于酶标仪570 nm处测定各孔吸光度(A570nm)值。细胞存活率(%)=(给药组A570nm-空白对照组A570nm)/(正常对照组A570nm-空白对照组A570nm)×100%。
1.4 HEK293细胞LDH,GSH和MDA含量及SOD活性测定
将HEK293细胞以每孔6×104细胞接种于6孔板中培养24 h,细胞分组和药物处理同1.3。药物处理后:①收集各孔培养上清液,按照LDH微板法试剂盒说明书操作,测A450nm值,计算LDH释放量。②吸弃孔内培养液,以PBS洗细胞2次后反复冻融2~3次,3500×g离心10 min,收集上清液,按照GSH微板法试剂盒说明书操作,测A405nm值,计算GSH含量。③吸弃孔内含药培养液,PBS洗细胞2次,加50 μL细胞裂解液裂解10 min,3500×g离心10 min取上清液,按SOD WST-1法试剂盒说明书操作,测A405nm值,计算SOD活性。④吸弃孔内含药培养液,加MDA提取液0.5 mL,混匀2 min,超声波(功率20%,超声3 s,间隔10 s,重复30次)破碎细胞制成悬浮液,按MDA微板法试剂盒说明书操作,测A530nm值,计算MDA含量。
1.5 动物分组和处理
42只ICR小鼠随机分为6组,每组7只。正常对照组:连续ig给予等量蒸馏水10 d,在第3~10天ip给予等量生理盐水;模型组:连续ig蒸馏水10 d,在第3~10天 ip给予GM 100 mg·kg-1[8];阳性对照组:连续ig给予SA 20 mg·kg-1[7]10 d,第3~10天,在SA给药前6 h ip给予GM 100 mg·kg-1;SVPr组:连续ig给予SVPr(50,100和200 mg·kg-1)10 d,第3~10天,在SVPr给药前6 h ip给予 GM 100 mg·kg-1。所有小鼠末次给予GM前12 h禁食禁水,SVPr末次给药2 h后眼眶内静脉取血,取血后乙醚麻醉处死。
1.6 小鼠体质量和肾指数的测定
未次给药前记录小鼠体质量。处死小鼠后立即取新鲜双侧全肾,去除肾外膜和脂肪后称取肾质量,计算肾指数。肾指数=肾质量(g)/体质量(g)×100。
1.7 小鼠血清BUN和Cr水平的检测
取收集的小鼠血液样本,待血液凝固约30 min后,3500×g离心15min取上清。按照试剂盒说明书操作,测定小鼠血清中BUN和Cr水平。酶标仪405 nm波长处测定吸光度,根据说明书计算BUN和Cr含量。
1.8 小鼠肾组织SOD和CAT活性及GSH和MDA含量的检测
剪取右肾肾皮质按1∶9比例加入冰浴0.9%NaCl溶液研磨制备10%匀浆组织液,4℃、3500×ɡ离心10 min。按CAT可见光法试剂盒说明书操作,测A405nm值,计算CAT活性。SOD活性及GSH和MDA含量的测定按试剂盒说明书操作,具体方法同1.4。
1.9 ELISA法测定小鼠血清中TNF- α和IL-6含量
小鼠血液样本处理方法同1.7。按试剂盒说明书操作,测A450nm值,根据标准曲线计算TNF-α和IL-6含量。
1.10 HE染色观察小鼠肾组织病理变化
将新鲜的左肾修剪为4 mm×3 mm×3 mm的组织块,经固定、脱水、透明化、包埋、切片(6 μm)处理后按常规方法进行HE染色,中性树胶封片,用光学显微镜观察肾组织病理学变化。病理标本进行编号,每组随机选取3个标本在光学显微镜下随机选取7个视野,根据肾小管损伤程度进行评分。0分:无损伤;1分:肾小管上皮肿胀,出现炎症浸润;2分:肾小管出现大面积炎症细胞浸润及管腔扩张;3分:肾小管上皮细胞核染色消失;4分:肾小管结构破坏,上皮细胞核无着色。
1.11 统计学分析
实验结果中,计量资料数据采用±s表示,用SPSS 17.0软件进行分析,采用单因素方差分析(ANOVA),组间比较采用t检验;计数资料数据(HE染色实验结果)采用Ridit检验分析。以P<0.05为有统计学差异。
2 结果
2.1 SVPr对GM诱导HEK293细胞存活的影响
与正常对照组相比,GM 1~9 g·L-1组显著抑制HEK293细胞存活(P<0.01),半数抑制浓度(IC50)为3 g·L-1(图1)。SVPr 1,2和4 g·L-1显著缓解GM 3 g·L-1对HEK293细胞存活的抑制作用(P<0.01),与GM模型组相比,细胞存活率显著上升(P<0.01)(图2)。
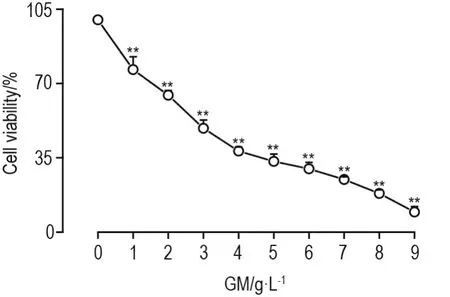
Fig.1 Effect of gentamicin(GM)on HEK293 cell viability by MTT assay.HEK293 cells were exposed to various concentra⁃tions of GM for 24 h.Cell viability(%)=[(A570nmof treatment group-A570 nmof blank group)/(A570 nmof control group-A570 nmof blank group)]×100%.±s,n=6.**P<0.01,compared with normal control(0)group.
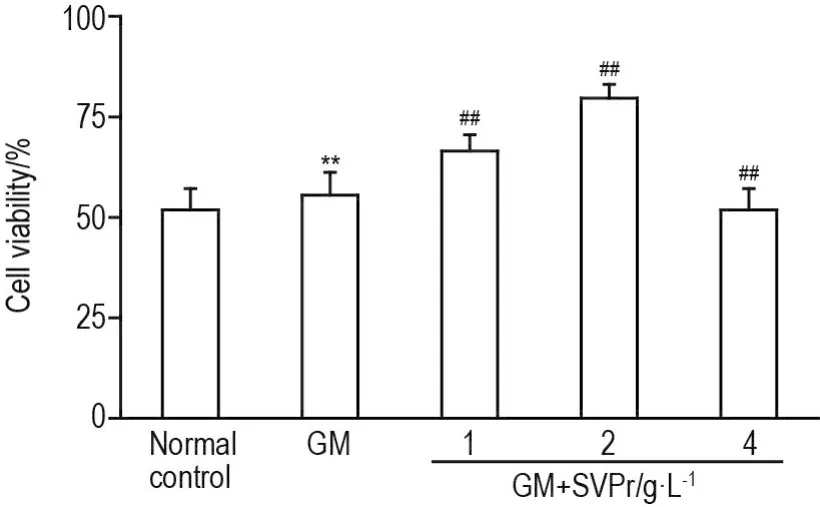
Fig.2 Effect of Sika deer velvet antler protein(SVPr)on HEK293 cell viability induced by GM by MTT assay.HEK293 cells were pretreated with SVPr(1,2 and 4 g·L-1)for 24 h,then were added with GM(3 g·L-1)and co-cultured for 24 h.±s,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with GM group.
2.2 SVPr对GM诱导HEK293细胞LDH、GSH和MDA含量及SOD活性的影响
与正常对照组相比,GM模型组HEK293细胞内GSH含量和SOD活性显著降低(P<0.01),LDH释放量及MDA含量明显升高(P<0.01)。与GM模型组相比,SVPr 4 g·L-1组GSH含量和SOD活性分别升高了49.03%和60.98%(P<0.01),LDH释放量及MDA含量显著降低(P<0.01),与GM模型组相比,分别降低45.57%和54.71%(图3)。
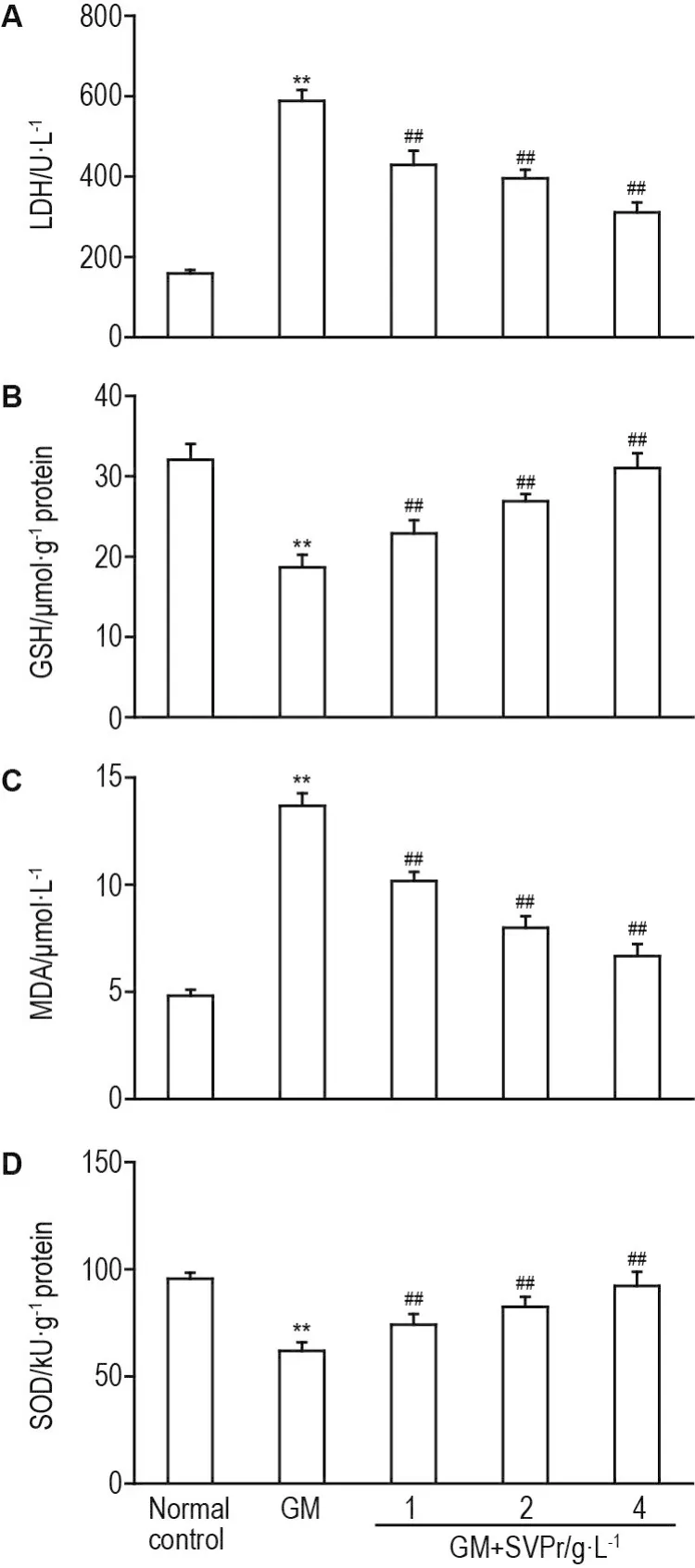
Fig.3 Effect of SVPr on lactate dehydrogenase(LDH,A),glutathione(GSH,B),malondialdehyde(MDA,C),and superoxide dismutase(SOD,D)of HEK293 cells with GM-induced oxidative stress damage.See Fig.2 for HEK293 cell treatment.±s,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with GM group.
2.3 SVPr对GM诱导肾损伤小鼠体质量和肾指数的影响
与正常对照组相比,GM模型组小鼠体质量减少(P<0.01),肾质量及肾指数均显著增加(P<0.01),表明GM对小鼠具有肾损伤作用,造模成功。与GM模型组相比,SVPr 50,100,200 mg·kg-1和阳性药均显著降低小鼠肾质量与肾指数(P<0.05,P<0.01),升高小鼠体质量(P<0.05,P<0.01)(表1)。
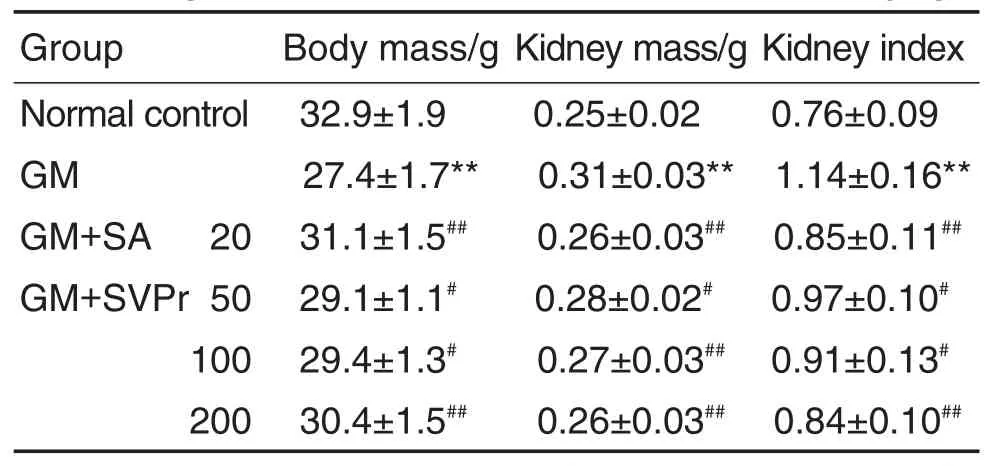
Tab.1 Effect of SVPr on body mass,kidney mass and kidney index of mice with GM-induced renal injury
2.4 SVPr对GM诱导肾损伤小鼠血清BUN和Cr的含量影响
与正常对照组相比,GM模型组小鼠血清Cr和BUN含量显著升高(P<0.01),提示肾小球过滤功能紊乱;与GM模型组相比,不同剂量的SVPr和阳性药均显著降低血清Cr和BUN的含量(P<0.01)(图4)。
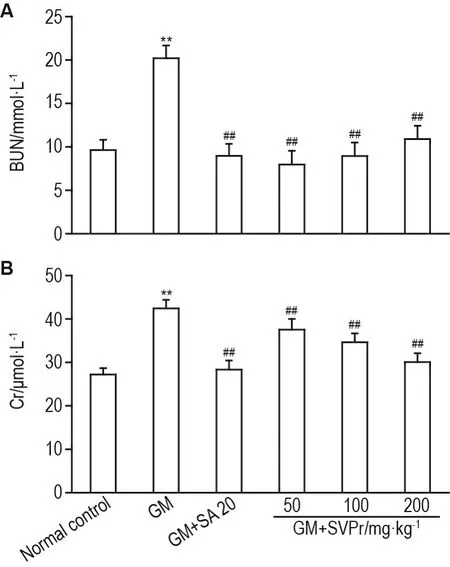
Fig.4 Effect of SVPr on levels of blood urea nitrogen(BUN,A)and creatinine(Cr,B)in serum of mice with GM-induced renal injury.See Tab.1 for the mouse treat⁃ment.±s,n=7.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with GM group.
2.5 SVPr对GM诱导肾损伤小鼠肾组织SOD和CAT活性及GSH和MDA含量的影响
与正常对照组相比,GM模型组小鼠肾组织中SOD和CAT的活性及GSH的含量显著降低(P<0.01),MDA含量显著升高(P<0.01)。与GM模型组相比,不同剂量SVPr和阳性药组小鼠肾组织中SOD和CAT活性显著升高(P<0.01),MDA含量显著降低(P<0.05,P<0.01);SVPr 100和200 mg·kg-1以及阳性药组GSH含量显著升高(P<0.01),而SVPr 50 mg·kg-1组GSH含量无显著变化(图5)。
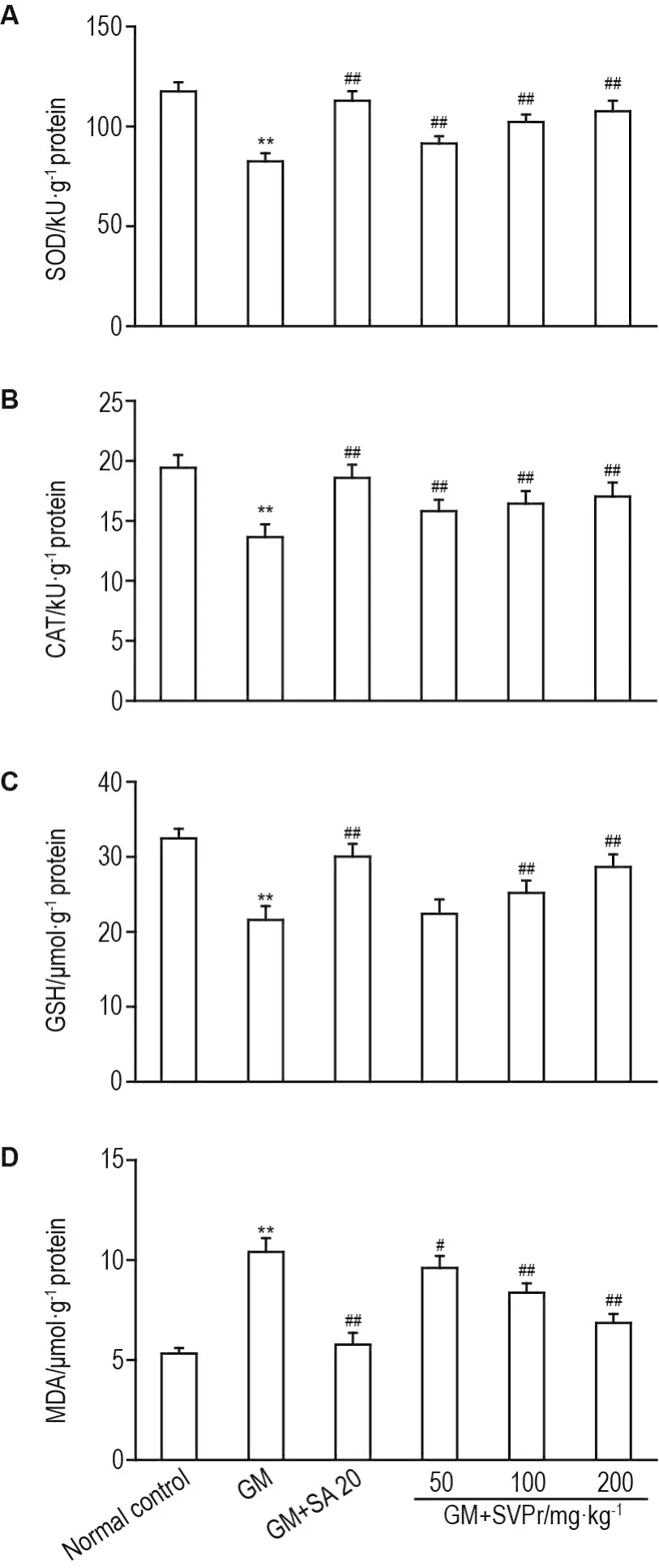
Fig.5 Effect of SVPr on SOD(A),catalase(CAT,B),GSH(C)and MDA(D)of mice with GM-induced renal injury.See Tab.1 for the mouse treatment.±s,n=7.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with GM group.
2.6 SVPr对GM诱导肾损伤小鼠血清中TNF- α和IL-6水平的影响
与正常对照组相比,GM模型组小鼠血清中TNF-α和IL-6水平明显升高(P<0.01)。与GM模型组相比,不同剂量SVPr和阳性药组小鼠血清中TNF-α和IL-6水平显著下降(P<0.05,P<0.01),但均未恢复至正常水平(图6)。
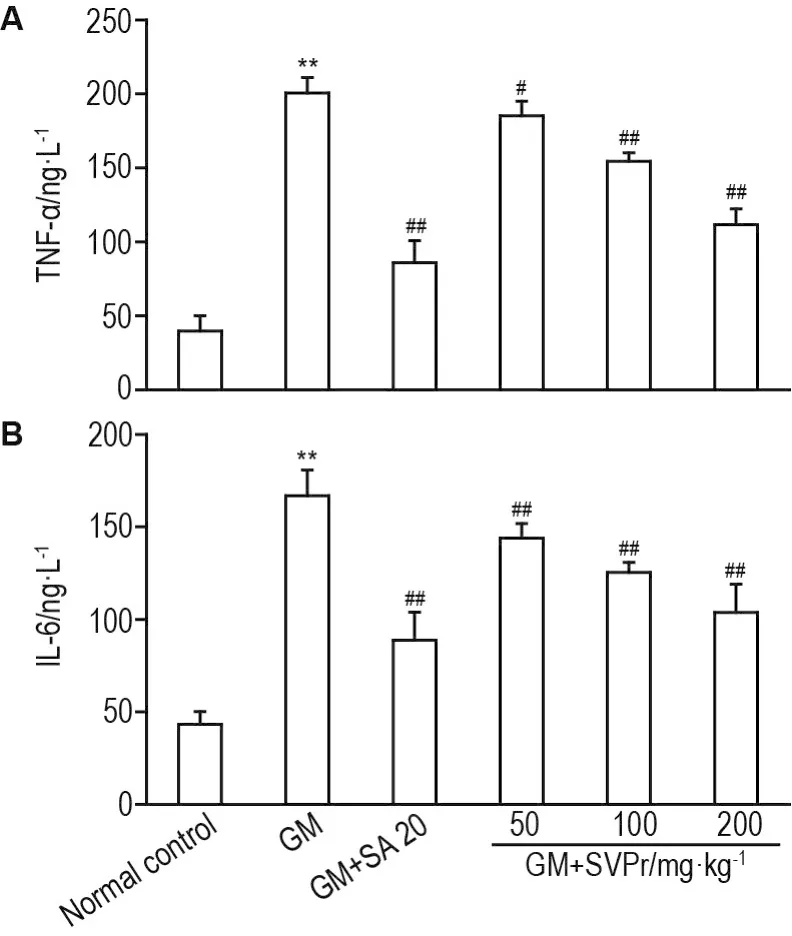
Fig.6 Effect of SVPr on levels of tumor necrosis factor- α(TNF- α,A)and interleukin-6(IL-6,B)in serum of mice with GM-induced renal injury.See Tab.1 for the mouse treatment.±s,n=7.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with GM group.
2.7 SVPr对GM诱导肾损伤小鼠肾组织病理变化的影响
HE染色结果(图7,表2)显示,正常对照组肾组织中,肾小球及周围肾小管结构正常且清晰,细胞外基质均匀,无病变现象。与正常对照组相比,GM模型组小鼠肾小管管腔出血,肾小管空泡变性,上皮细胞脱落和变性坏死,肾小球皱缩,肾小管坏死程度等级显著升高(P<0.05)。与GM模型组相比,SVPr给药组小鼠肾组织病理变化均有不同程度的改善,Ridit分析显示,SVPr 200 mg·kg-1组和阳性药组小鼠肾小管坏死程度等级显著降低(P<0.05),但均未恢复至正常水平。
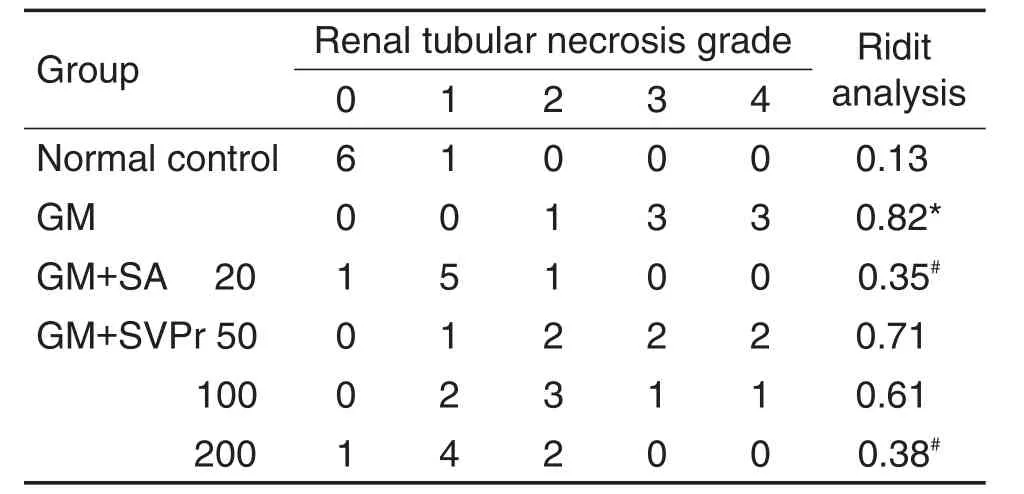
Tab.2 Effect of SVPr on renal tubular pathological changes in mice with GM-induced renal injury.
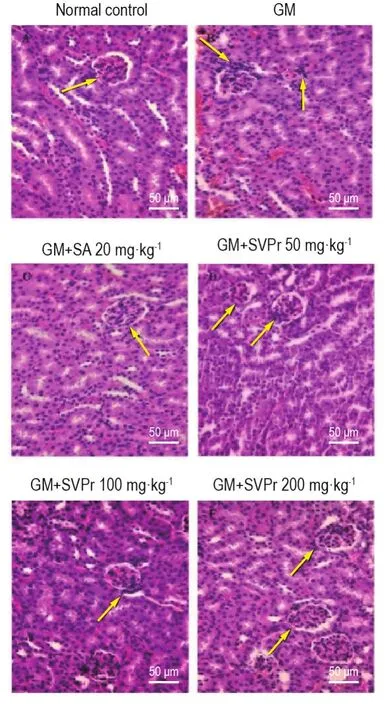
Fig.7 Histopathological changes in renal tissues of mice with GM-induced renal injury.See Tab.1 for the mouse treatment.The arrows show renal pathological changes including renal tubular epithelial cell necrosis,cell structure collapse and inflammatory infiltration.
3 讨论
本研究体外实验结果表明,SVPr对GM诱导HEK293细胞损伤具有保护作用,使HEK293细胞存活率显著升高,内源性抗氧化酶活性升高,LDH释放量和MDA含量下降。
GM 100 mg·kg-1可诱导血清中BUN和Cr水平显著升高,并诱导小鼠肾组织中SOD和CAT活性及GSH含量降低,以及MDA含量升高,呈现肾损伤症状。SVPr给药后,小鼠血清中BUN和Cr水平下降,SOD和CAT活性、GSH含量升高及脂质过氧化产物MDA含量下降,GM所致小鼠肾功能损伤得到不同程度的恢复。GM诱导氧化应激损伤时,大量活性氧物质积聚于肾组织中[19],且常伴有细胞色素系统紊乱[20]。研究结果表明,SVPr可恢复内源性抗氧化酶活性及降低脂质过氧化产物,推测SVPr对活性氧物质的清除和恢复细胞色素系统稳定具有潜在的药理活性作用。值得注意的是,BUN和Cr的下降无显著的量效关系,这可能与BUN和Cr作为肾损伤标志物的灵敏度低和延迟性有关[21]。因此,应选用更为灵敏的、早期性的标志物,如肾损伤分子-1、中性粒细胞明胶酶相关脂质运载蛋白、N-乙酰-β-D-葡萄糖苷酶和胱抑素C等作为检测早期肾损伤的指标[22-23]。
GM诱导肾毒性的另一个分子机制是炎症反应,GM激活相应炎症通路及促炎因子,从而诱导中性粒细胞黏附到肾皮质细胞引起肾损伤[24]。然而经SVPr治疗后,GM诱导的肾毒性小鼠血清中TNF-α和IL-6水平显著降低,表明SVPr可通过抑制炎症反应对GM肾毒性发挥改善作用。核转录因子E2相关因子2/抗氧化反应元件(nuclear factorerythroid 2 related factor2/antioxidant response element,Nrf2/ARE)信号通路作为氧化应激反应的关键通路,与肾疾病密切相关,其调控的下游抗氧化酶和Ⅱ相解毒酶在细胞防御中发挥重要作用,其中Nrf2调控的下游靶基因血红素加氧酶1(heme oxygenase,HO-1)不仅在生理状态下发挥作用,更主要是在机体处于病理或应激状态下发挥抗炎和抗氧化等作用[25]。本实验结果表明,SVPr改善GM诱导的小鼠肾组织中内源性抗氧化酶活性和GSH、脂质过氧化产物MDA含量及血清中炎症因子TNF-α和IL-6水平,推测Nrf2/HO-1信号通路可能是SVPr改善GM诱导氧化应激、炎症损伤的药物靶点。与此同时,病理切片检验结果显示,GM肾毒性小鼠给予SVPr后,肾小管管腔出血明显减少,肾小球囊腔内结构清晰,肾小管上皮细胞坏死明显减少,透明管型现象减少,间充质内水肿及中性粒细胞浸润减少,细胞形态基本恢复正常。进一步表明,SVPr对GM诱导的肾组织损伤具有改善作用。
综上所述,SVPr通过改善氧化应激水平、炎症反应对GM诱导的小鼠肾损伤发挥保护作用。

