Sigma-1受体激活减轻心脏缺血再灌注损伤
廖小平, 喻溥蛟,许嘉鸿
(1.上海市安亭医院心血管内科,上海201805;2.同济大学附属同济医院心血管内科,上海200065)
急性心肌梗死(acute myocardial infarction,AMI)已成为目前发病率及死亡率非常高的疾病之一[1].仅在美国,每年就有约150万人发生急性心肌梗死.而随着生活水平的提高以及生活方式的改变,目前我国的急性心肌梗死发病率也逐渐升高.而随着再灌注治疗技术的发展,急性的心肌梗死已能够在发生的短期内得到有效治疗.尽管极大地提高了急性心肌梗死患者的存活率,但也催生出了新的问题.心脏缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)指的是心肌梗死罪犯血管打开后,快速血流重新流入心肌,在途经受损的心肌细胞时由血液中HbO2造成二次打击的氧化应激损伤[1-3].这种损伤往往会造成心肌细胞的进一步坏死和凋亡、存活心肌细胞的线粒体功能障碍、蛋白激酶的激活、大量的炎症反应等,继而导致患者的远期预后不良,甚至死亡[4-5].因此,如何改善心脏缺血再灌注损伤是目前心血管病领域一个亟待解决的重要问题.
Sigma-1受体是一个长度为25 kD的分子伴侣,主要位于内质网以及线粒体相关的内质网膜上[6],可以通过调节钾离子通道、电压敏感性的钙离子通道来调节钙离子进入细胞膜的浓度,还可以调节胞浆内储存的钙离子流通,促进蛋白的折叠,提高细胞对于氧化应激反应的抗性[7-9].Sigma-1受体广发地分布在身体的各个组织中,包括心脏、大脑、肺脏、肾脏等[10].已有研究发现,sigma-1受体对于多种器官的缺血再灌注损伤(ischemia reperfusion injury,IRI)有着重要的调节作用[11-14].Sigma-1受体的配体之一——BHDP(N-benzyl-N'-(2-hydroxy-3,4-dimethoxybenzyl)-piperazine,N-苄基-N'-(2-羟基-3,4-二氧苄基)-哌嗪),能够有效改善肝脏受到的氧化应激反应[11].在大鼠肾脏缺血再灌注损伤模型中,使用sigma-1受体激动剂氟伏沙明,能够通过Akt介导的NO信号通路显著改善肾脏功能,提高大鼠的存活率[12].而在心脏相关的研究中,研究者也发现,sigma-1受体参与了心脏重构的病理生理过程[15-20],sigma-1受体激动剂SA4503以及氟伏沙明都可以改善压力负荷所致的心脏重构,保护心脏功能不受损.然而,sigma-1受体在心脏缺血再灌注损伤中的作用尚不清楚.因此,本工作的目的旨在探索sigma-1受体对于心脏缺血再灌注损伤的作用,以期为心脏缺血再灌注的诊疗提供一个全新的分子靶点.
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验动物
雄性C57BL/6小鼠,8~10周龄,质量28±1 g,饲养于SPF级动物房,温度22±2°C,湿度50%~60%.所有操作均依照美国国立卫生院(National Institutes of Health,NIH)的相关规定.
1.1.2 实验仪器
多功能酶标仪、微量移液器、旋涡混匀器、恒温水浴锅、离心机、半干转膜槽、电泳仪、电泳凝胶成像系统、倒置显微镜、体视镜、显微手术器械、小动物呼吸机.
1.1.3 实验试剂
实验中所涉及的抗体包括一抗Bcl-2抗体、Bax抗体、Caspase-3、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrgenase,GAPDH)抗体,均购于Abclonal公司.Sigma-1受体激动剂SA4503以及抑制剂BD1047购于Sigma公司.
1.2 实验方法
1.2.1 动物实验方案
采用冠脉结扎法构建小鼠的缺血再灌注模型.8周龄的C57BL/6小鼠经过3 d的尾静脉注射药物SA4503(1 mg·kg-1·d-1)以及BD1047(1 mg·kg-1·d-1)后进行手术. 手术步骤如下:①手术区域用75%的酒精擦拭消毒;②用1%戊巴比妥钠按0.01 mL/g浓度腹腔注射麻醉小鼠;③在声门下两个气管软骨环之间切一个小孔,插入气管插管,固定;④打开胸腔,用7-0线将冠状动脉左前降支弓结扎;⑤逐层关胸,用6-0缝线固定肋骨,4-0缝线缝皮;⑥用5 mL注射器通过胸管边抽气边拔出胸管,避免术后发生气胸;⑦30 min后,再次打开胸腔,将结扎的线剪断,关闭胸腔,缝合肋骨和皮肤;⑧24 h后收取心脏样本.
1.2.2 四氮唑红染色方法
心脏损伤的评估方式采用TTC/Evans蓝双染色法,其中TTC为四氮唑红(2,3,5-triphenyl-2H-tetrazolium chloride).首先,将2%的Evans蓝通过冠脉结扎的方式,仅灌注于心脏未缺血部分,未着色的部分称为危险区(area at risk,AAR).接着从小鼠体内快速取出心脏,置于-20°C冰箱中冷冻,冰冻后用刀片将心脏横切为1~2 mm厚度的切片.将切片浸泡于37°C的1%TTC溶液中孵浴15 min后使用磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗.TTC未着色部分心肌组织呈现白色,为坏死的心肌组织,视为梗死区(infarction area,INF),着色的红色区域为缺血但未坏死的组织.染色后使用倒置显微镜拍摄心肌切片照片,利用ImageJ软件对图形进行量化分析.
1.2.3 蛋白的提取
取适当大小的心肌组织样本,加入适量的细胞裂解液,用匀浆机将组织样本破碎.随后置于冰上裂解样本15 min.接下来,将蛋白样品置于离心机中以12 000 r/min离心30 min后,将蛋白上清液转移至新的离心管中,加入上样缓冲液后100°C使蛋白变性,迅速放入冰中冷却,短时离心.采用标准牛血清白蛋白(albumin from bovine serum,BCA)定量方法对样本进行蛋白含量均一化后待用.细胞裂解液配方(以1 mL为例)如下:1 mL细胞裂解液,10µL磷酸酶抑制剂,10µL苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF).
1.2.4 免疫印迹法
根据目的蛋白的分子量配制不同浓度的分离胶,一般大多采用浓度为8%,10%与12%的分离胶.电泳条件如下:电压80 V(浓缩胶)~120 V(分离胶),电泳时间约2~3 h,溴酚蓝至胶底边即可停止电泳.选用聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)作为蛋白转膜载体,转膜条件为恒流200 mA转2 h.转在PVDF上的样品用PBS配制5%的BSA作为封闭液常温封闭处理1 h后,用PBST(PBS溶液加上Tween-20)清洗干净.一般按照1∶1 000的比例用5%BSA配置一抗,并将样品于4°C冰箱内孵育一抗过夜.第二天弃去一抗,用PBS清洗干净后,用5%BSA按照1∶10 000的比例配制二抗,并于常温孵育二抗2 h.使用化学发光显影试剂对蛋白表达情况进行检测.
1.2.5 统计方法
数据以均值±标准差(mean±SD)表示,使用SPSS 17.0统计软件进行方差分析,3组及3组以上单因素样本运用单因素方差分析(analysis of variance,ANOVA),方差齐性时再运用Bonferroni分析作两两比较.统计结果以P<0.05为具有统计学差异.
2 结果
2.1 Sigma-1受体抑制剂BD1047对小鼠心脏缺血再灌注损伤的影响
为了明确sigma-1受体对于心脏缺血再灌注损伤的作用,首先检测了使用sigma-1受体抑制剂后小鼠心脏缺血再灌注损伤的面积.经过3 d的尾静脉注射sigma-1受体抑制剂BD1047后发现,接受了BD1047预处理后的小鼠心肌受损面积即梗死区与危险区比值(INF/AAR)要远大于对照组,如图1所示,图中LV为左心室(left ventricle),***代表P<0.01,n=6.
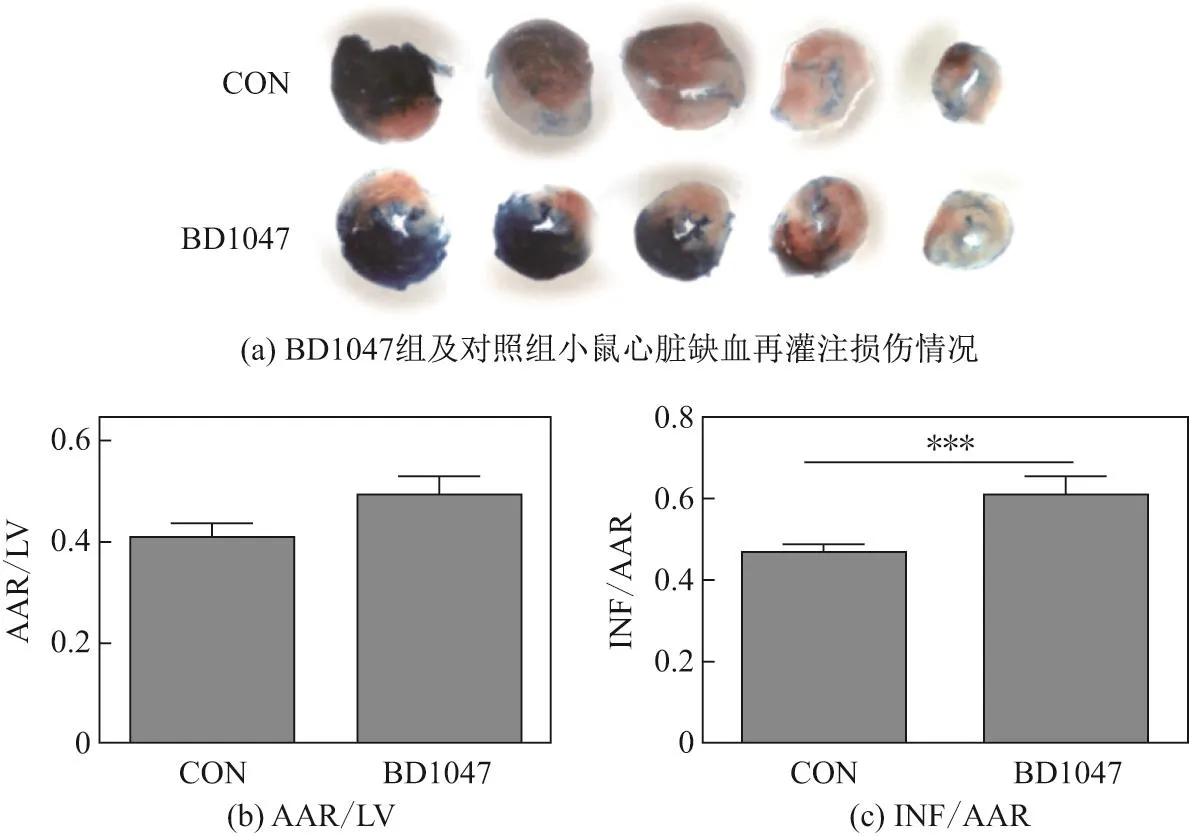
图1 BD1047对心脏缺血再灌注损伤面积的影响Fig.1 Effects of BD1047 on myocardial infarction size induced by MIRI
2.2 Sigma-1受体抑制剂BD1047对心肌细胞中凋亡相关蛋白表达的影响
同时,在蛋白水平使用了蛋白免疫印迹法检测心肌组织中的凋亡相关蛋白,结果发现,相较于对照组,BD1047组的抗凋亡相关蛋白Bcl-2表达明显下调,而与促凋亡相关的蛋白Bax以及Capase-3的活化水平明显升高,如图2所示,图中*代表P<0.05,**代表P<0.01,***代表P<0.001,n=3.
2.3 Sigma-1受体激动剂SA4503对小鼠心脏缺血再灌注损伤的影响
在明确了抑制sigma-1受体对心脏缺血再灌注损伤有协同作用后,检测了sigma-1受体的激活对小鼠心脏缺血再灌注损伤的作用.经过3 d的尾静脉注射sigma-1受体激动剂SA4503后发现,接受了SA4503预处理后的小鼠心肌受损面积要远小于对照组(见图3,图中***代表P<0.001,n=6).
2.4 Sigma-1受体激动剂SA4503对心肌细胞中凋亡相关蛋白表达的影响
同样地,在蛋白水平使用蛋白免疫印迹法检测心肌组织中的凋亡相关蛋白,结果发现,相较于对照组,SA4503组的抗凋亡相关蛋白Bcl-2表达明显上调,而与促凋亡相关的蛋白Bax以及Capase-3的活化水平明显降低(见图4,图中*代表P<0.05,**代表P<0.01,n=3).
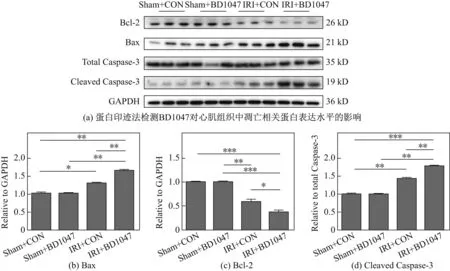
图2 BD1047对Bax,Bcl-2以及Caspase-3蛋白表达的影响Fig.2 Effects of BD1047 on expression of Bax,Bcl-2 and Caspase-3 proteins
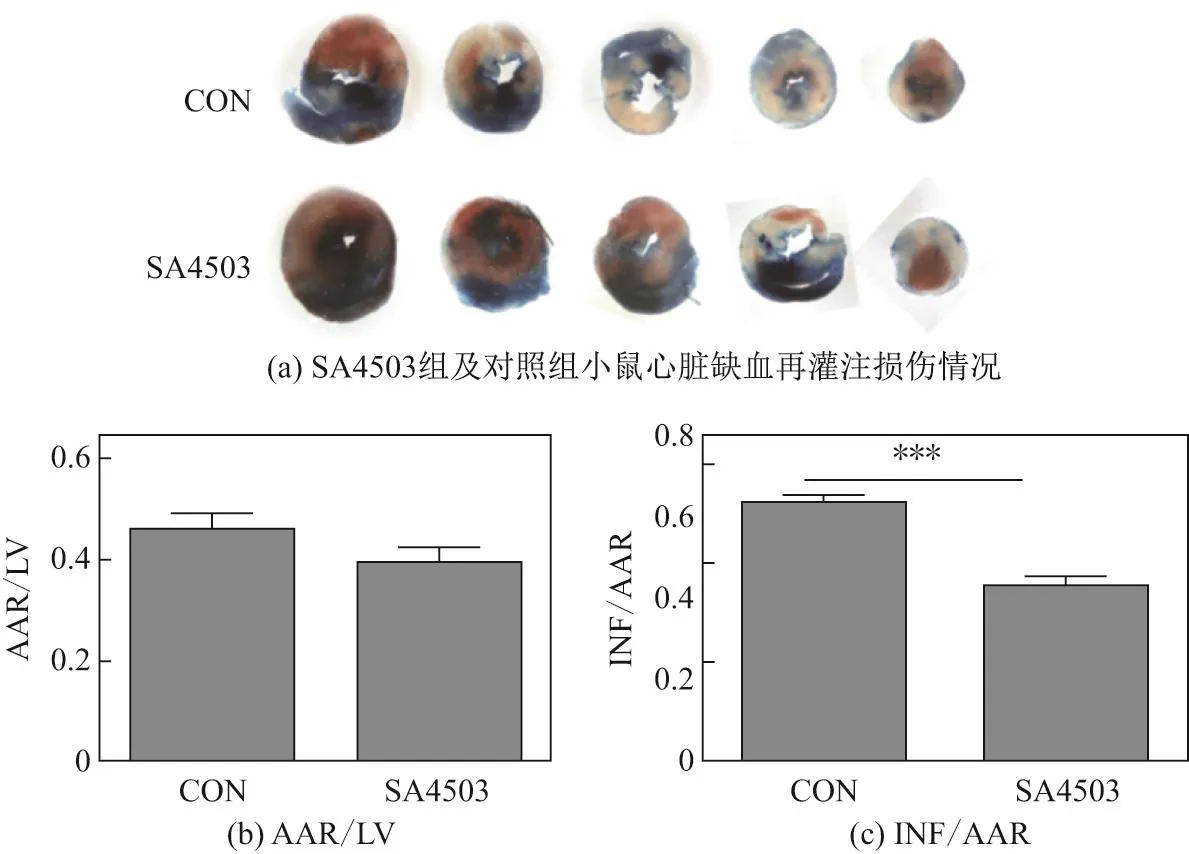
图3 SA4503对心脏缺血再灌注损伤面积的影响Fig.3 Effects of SA4503 on myocardial infarction size induced by MIRI
3 讨论
随着药物溶栓、经皮冠状动脉介入治疗、冠脉旁路移植术等再灌注治疗技术日益完善且广泛普及,心脏再灌注损伤的干预治疗备受重视.目前,已有观点多集中于心肌梗死后缺血再灌注引起的氧化应激损伤及其产生的强烈炎症反应.这些损伤反应的最终结果是大片细胞的坏死和进一步的心肌细胞凋亡.
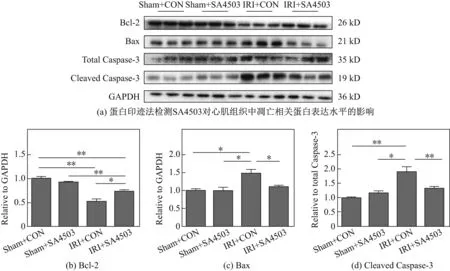
图4 SA4503对Bax,Bcl-2以及Caspase-3蛋白表达的影响Fig.4 Effects of SA4503 on expression of Bax,Bcl-2 and Caspase-3 proteins
通常来说,心肌细胞凋亡发生在心肌梗死缺血后的几分钟内[21-22]以及冠脉闭塞被打通后血液再灌注时[23].一些基础研究以及临床试验认为,凋亡是心脏缺血再灌注损伤最重要的病理生理机制[24].当再灌注发生时,血流快速恢复的同时带来了大量的氧分子以及细胞外pH值的变化,这些均导致氧自由基的释放以及钙离子的超载,继而发生线粒体膜渗透性的增加,线粒体通透性转换孔的开放,进而导致更多的促凋亡因子从线粒体中被释放出来[24-29].
Sigma-1受体本身对于线粒体离子通道有着重要的调控作用.本工作的研究中发现了抑制sigma-1受体将会加重小鼠心脏缺血再灌注损伤时心肌细胞的凋亡水平,进而加重心脏的损伤程度.相反,激活sigma-1受体则可以改善心肌细胞的凋亡水平,减少心脏的损伤.从已有研究中可知,通过激动剂SA4503激活sigma-1受体后,线粒体钙离子通道的激活、三磷酸腺苷(adenosine triphosphate,ATP)的正常生产为心脏的收缩舒张功能提供了稳定的钙稳态环境以及充足的能量供给,从而改善了心脏的功能[15,30-31].除此之外,sigma-1受体对于Akt信号通路也有一定的激活作用,而这也是一条控制细胞凋亡、自噬、生长的经典信号通路[18].

