中山杉组织培养中无菌体系建立的初步研究
黄志伟,曹 剑
中山杉组织培养中无菌体系建立的初步研究
黄志伟,曹 剑
(重庆三峡职业学院 农林科技系,重庆 404155)
为建立中山杉Zhongshanshan’无菌体系,从中山杉外植体消毒及腋芽启动两方面开展研究。外植体消毒试验以枝条类型、HgCl2浓度及其处理时间为试验因素,采用3因素随机区组试验设计,试验结果表明:采用木质化嫩梢作为外植体的消毒处理污染率都高达100%,而采用未木质化嫩梢作为外植体,0.2% HgCl2处理10 min进行消毒效果最好,污染率为0;外植体腋芽启动试验则以NAA,6-BA和活性炭为试验因素,采用正交试验设计L9(34),试验结果表明:NAA,6-BA对中山杉腋芽萌动都有促进作用,其中6-BA起主导作用,而活性炭则对中山杉腋芽萌动有抑制作用,其腋芽启动效果最佳培养基为MS+6-BA1.0 mg·L-1+NAA0.5 mg·L-1,腋芽启动率达84.62%。
中山杉;无菌体系;外植体消毒;腋芽启动
中山杉Zhongshanshan’为杉科Taxodiaceae落羽杉属半常绿高大乔木,具有耐水淹、耐盐碱、抗风力强、病虫害少、树形美观等特点。目前中山杉作为长江三峡库区消落带植被恢复的绝佳树种[1-2],用苗量激增,采用传统的扦插繁殖,其繁殖系数较低且受季节影响较大[3],苗木市场上出现一苗难求现象,制约了三峡库区消落带生态植被恢复的发展,故必须寻求更好地中山杉种苗繁育途径。
目前,中山杉组织培养育苗的报道极少,仅唐兴国、朱跃珍、郝树芹等做了中山杉组培快繁技术的初步研究[4-6],存在污染率偏高,存活率较低及芽诱导率不高等诸多问题,其组培育苗技术在生产上难以应用。本试验采用中山杉当年生健壮嫩枝作为外植体,就中山杉组织培养中无菌体系建立,包括外植体消毒及腋芽启动培养开展研究,以期建立起较稳定的中山杉组织培养体系,为探索适合中山杉工厂化育苗的组织培养快繁技术提供实验材料及技术支撑,同时为该树种的推广种植提供技术支持。
1 材料与方法
1.1 材料
试验材料采自重庆市禾佳香料植物开发有限公司中山杉118品种采穗圃,以8年生优良单株当年生健壮枝条作为试验材料。
试剂HgCl2(广州化学试剂厂),α-萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)、琼脂粉、活性炭试剂来自上海伊卡生物公司,酒精(无锡市亚泰联合化工有限公司),蔗糖(天津市福晨化学试剂厂),洗衣粉采用的是雕牌速溶快洁无磷洗衣粉,超净工作台(上海贝塔,型号CA-S-11)。
1.2 外植体采集及预处理
1.2.1 中山杉外植体消毒 于2017年11月16日,采集健壮、茎粗约0.5 cm、无病虫害的当年生春梢(木质化)及秋梢(未木质化),带回实验室仔细剪掉其针叶及萌生的小侧枝,并剪成长约2 cm的茎段,用0.5%洗衣粉溶液浸泡5 min,并轻柔搓洗15 min,再用自来水冲洗30 min,置于超净工作台备用。
1.2.2 中山杉腋芽启动试验 2017年6月7日采集当年生半木质化嫩梢为试验对象,预处理方法同上。
1.3 试验设计
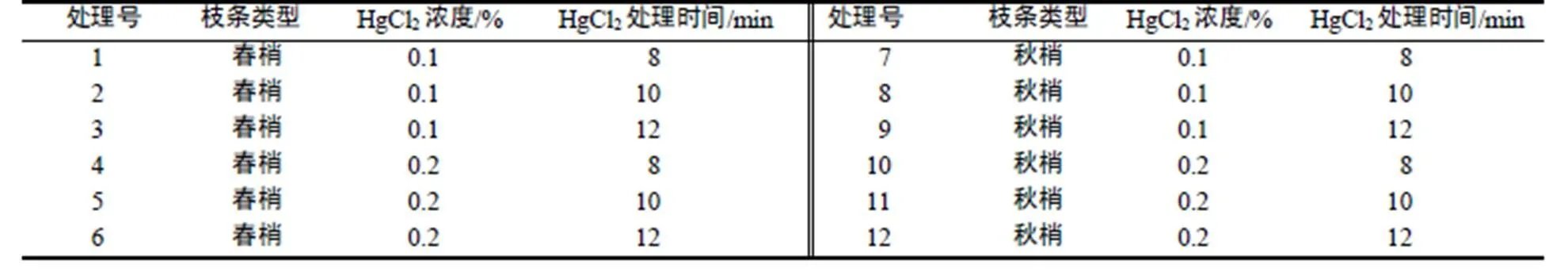
1.3.1 外植体消毒试验设计 采用3因素随机区组试验设计,以枝条类型、HgCl2浓度及其处理时间为试验因素,其中枝条类型和HgCl2浓度设2水平,HgCl2处理时间设3水平(表1)。
表1 外植体消毒试验处理设计
Table 1 Different treatments of disinfection of explants
1.3.2 腋芽启动试验设计 采用正交试验设计,以NAA(A),6-BA(B),活性炭(C)为因素,每因素设3个水平,得到L9(34)正交试验设计表(表2)。
表2 腋芽启动正交试验设计L9(34)
Table 2 Experiment on germination of axillary bud by orthogonal design L9(34)

1.4 试验步骤及培养条件
1.4.1 外植体消毒试验 将已经预处理好的枝条用75%酒精处理30 s后用无菌水漂洗3次,再按表1试验设计进行消毒,最后用无菌水冲洗4次,滤干后进行接种。每处理接种10瓶,每瓶接1个外植体,3次重复。培养基为MS,6.5 g·L-1琼脂粉,30.0 g·L-1蔗糖,pH值调节至5.8 ~ 6.2,不添加植物生长剂;培养温度25±1℃、光照强度2 000 ~ 2 500 lx、光照时间12 h·d-1。
1.4.2 腋芽启动试验 外植体消毒方法及步骤同上,仅0.2% HgCl2处理时间固定为10 min。每处理接种30瓶,每瓶接1个外植体。培养条件同上。
1.5 数据记录及处理
外植体消毒试验每隔5 d采集1次数据,连续记录4次。记录外植体污染发生类型、部位及数量,腋芽初始萌动时间、萌动程度、材料的生理状态(是否褐化、玻璃化)等情况。腋芽启动试验记录每隔10 d采集1次数据,连续记录4次,记录腋芽萌动情况,腋芽启动标准为腋芽打破休眠,出现芽体积变大及逐渐变绿现象。根据统计结果计算污染率、启动率等,公式如下:

试验数据用Excel和DPS软件进行统计分析。
2 结果与分析
2.1 不同消毒处理对中山杉外植体污染率的影响
由表3可以看出,以春梢(木质化)作为外植体的6个处理在接种后5 d时就出现大量外植体霉菌污染,在接种后10 d就全部污染;而以秋梢(未木质化)作外植体的6个处理在接种后5 d时,仅有零星污染,在随后的10 d,15 d,20 d观察中新增污染数也极少,20 d时,7-12号处理平均污染率仅为12.2%,污染率最高的7号处理也仅为26.7%,而11号处理污染率为0。20 d时7-12号处理的外植体平均启动率达90%以上,9,10号处理启动率为100%,最低的12号处理为75.9%。
表3 外植体消毒试验结果
Table 3 Effect of different disinfection on contamination rate of explants
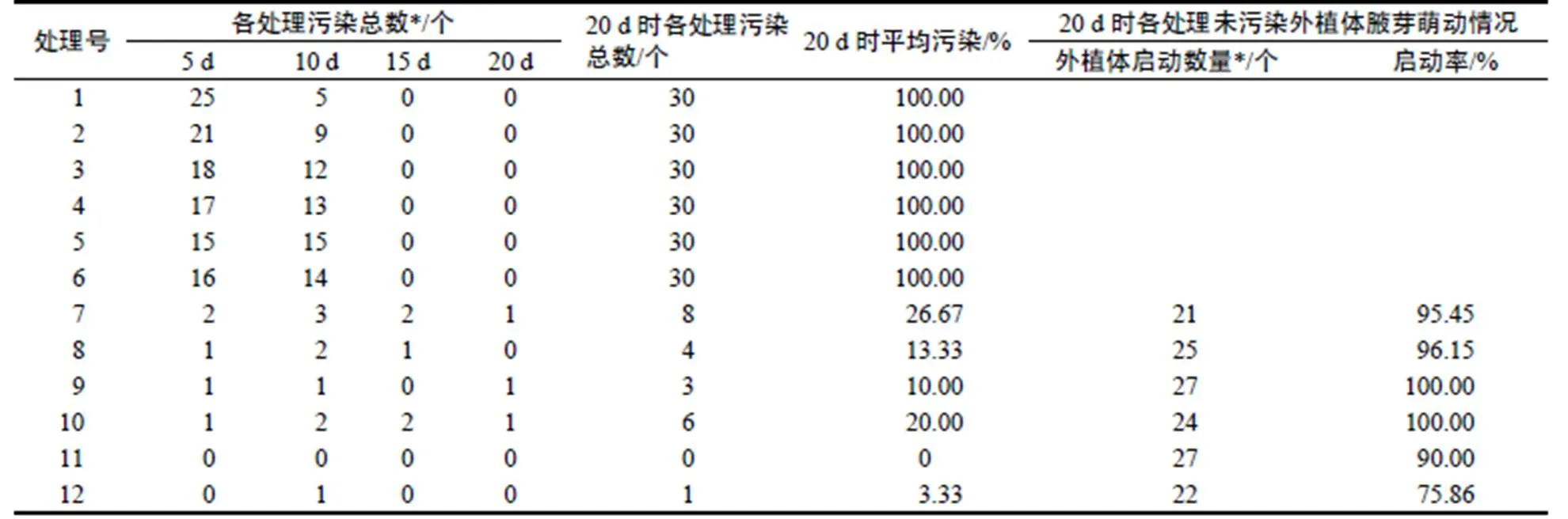
注:*表示的数值特指腋芽已萌动的外植体数,不是已萌动腋芽的数量。
通过方差分析得出枝条类型、HgCl2浓度、HgCl2处理时间以及枝条类型与HgCl2浓度、枝条类型与HgCl2处理时间对外植体消毒效果差异极显著(<0.01,表4)。进一步进行各因素的差异显著性检验,结果表明,春梢与秋梢2水平间差异极显著(<0.01),0.1% HgCl2与0.2% HgCl22水平之间差异显著(<0.05),HgCl2处理8 min与10 min及12 min之间显著(<0.05),而HgCl2处理10 min与12 min之间不显著。由此得出选用未木质化嫩梢作为外植体,用0.2% HgCl2处理10 min为佳。
表4 消毒试验方差分析
Table 4 ANOVA on disinfection effect
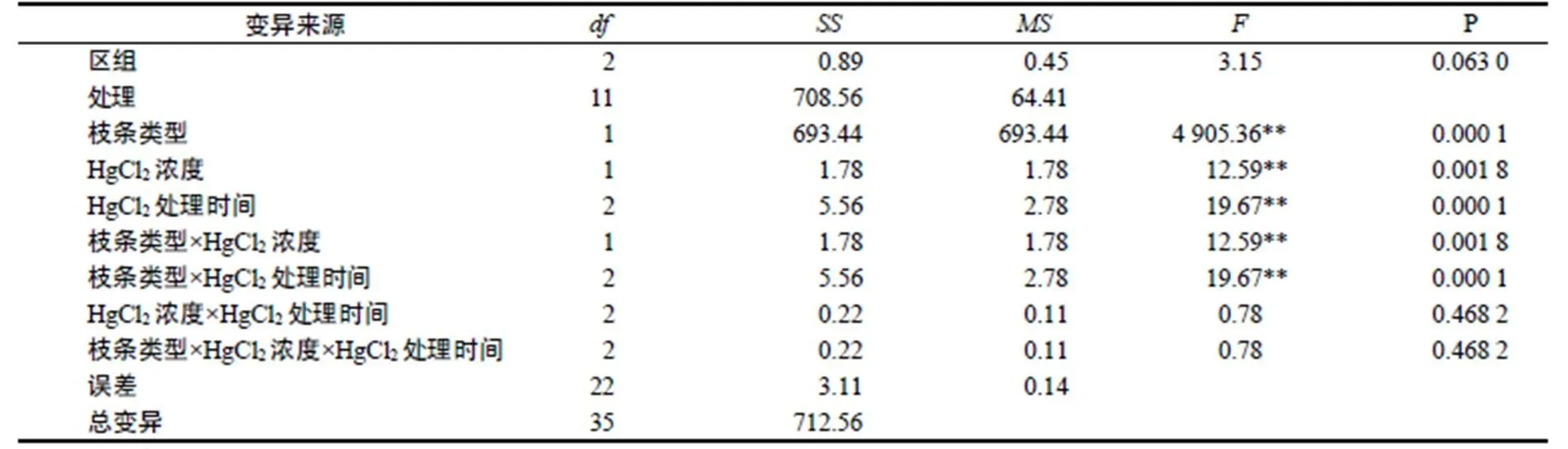
注:**表示差异极显著。
2.2 不同培养基对外植体腋芽启动培养的影响
接种后10 d观察时就有部分外植体的腋芽开始萌动,出现芽体变大变绿现象,到20 d时尤为突出,但到30 d时腋芽萌动的外植体新增现象减缓,此时大量腋芽开始展叶并生长,到40 d时腋芽进入伸长生长阶段,部分嫩梢长度达1.0 ~ 1.5 cm。
通过极差分析(表5)可知,各因素作用的主次顺序为B>A>C,即6-BA对中山杉腋芽萌动起主导作用,其次是NAA,而活性炭对腋芽萌动有抑制作用,随着活性炭浓度增加,腋芽萌动越困难。理论上得出适合中山杉腋芽启动培养的最优组合为B3A3C1,即MS+6-BA 1.0 mg·L-1+NAA 1.0 mg·L-1。值得注意的是40 d时观察发现8,9号处理虽然启动率很高,但芽体过于膨大且萌发时间较晚,最早的都需要30 d,存在新芽长度短,新芽展叶慢等特点。
表5 腋芽启动正交试验分析
Table 5 Orthogonal test for germination of axillary bud
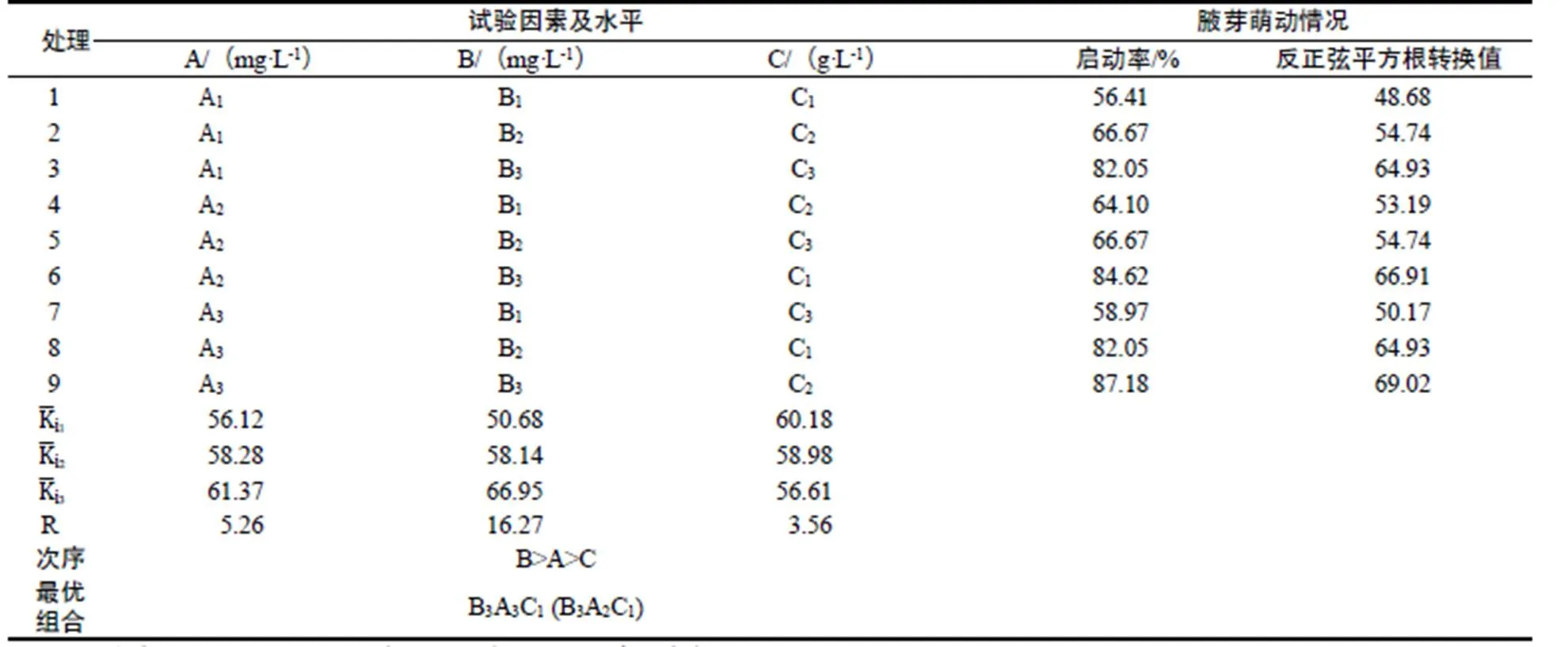

6号处理表现则较好,首先腋芽萌动早且芽体也较饱满,到40 d时最长的嫩梢达到1.5 cm(见图1)。从成本、育苗时间考虑,以枝条为外植体的最佳组合可调整为B3A2C1,即MS+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1。

图1 40 d时中山杉腋芽启动情况(左:6号处理,右:1号处理)曹剑摄
Figure 1 Growth of axillary bud 40 days later of treatment
3 结论与讨论
在中山杉外植体消毒的一系列前期试验中,外植体的污染率都一直居高不下,特别是在2017年9-10月先后进行的外植体消毒试验,最终在接种后10 d时都全部污染。通过试验观察及查阅文献资料[7-10]后推测,已经木质化的健壮枝条为外植体其自身带菌量太多导致消毒不彻底,此次试验充分证实了上述推测。可以看到木质化枝条由于生长时间长,长期暴露在外,加之随着时间的推移枝条的皮层纵裂明显,容易滋生大量杂菌且不易去除;而未木质化的枝条,由于暴露在外的时间较短,加之枝条皮层光滑未曾开裂,杂菌不易滋生及附着,因此在消毒过程中能彻底清除杂菌。观察中也发现用0.2% HgCl2处理12 min后,外植体启动率最低,且未启动的外植体都出现不同程度的褐化现象,这与HgCl2处理时间较长导致腋芽受损重有关系[8,11-12]。
众所周知,木本植物无菌体系建立时外植体消毒技术很难把控,而目前的资料表明仅唐兴国等[6]开展了中山杉外植体消毒试验,但该试验方法其外植体预培养时间相对较长,试验效果方面虽然污染率可低至6.7%,但外植体的存活率也降至20%,这在实际生产上的指导意义不大。本试验外植体消毒试验中,外植体不进行预培养,通过对外植体类型、HgCl2浓度及处理时间进行对比试验,其消毒试验结果甚为理想,在实际生产上有节省时间、可操作性强等实用价值。然而采用未木质化嫩梢作为外植体,其萌动抽生的腋芽质量不佳,芽体也较瘦弱,而采用木质化的粗壮枝条作为外植体,其抽生的腋芽饱满壮实。因此,针对木质化中山杉枝条为外植体探索出一套行之有效的消毒方案,将会更有实际应用价值。
腋芽启动培养过程中,6-BA作为细胞分裂素类物质,表现出极为明显的促进作用,在一定浓度范围内能促进细胞分裂,促进芽的形成与生长;而NAA作为生长素类物质,也能明显促进体内细胞的生长,但当浓度过高时则会抑制芽的产生,当6-BA/NAA比值大时更有利于腋芽启动,李庆伟等[7,13-14]也得出过相似的结论。但此次研究也发现在消毒试验中未添加任何植物生长调节剂的情况下,未木质化嫩枝的腋芽启动率为90%,但在后续观察中发现幼芽黄绿且瘦弱,实际应用价值不高;而腋芽启动试验外植体采用的是春季萌生的半木质化嫩枝,消毒难度较秋季萌生嫩枝更难,扣除外植体污染样本数量后,一定程度上影响了腋芽启动数据的统计,但腋芽启动率仍达到了87.5%,仅稍低于秋季嫩枝,同时,腋芽启动试验所获得的幼芽质量极高。因此在后续的研究工作中,将进一步对中山杉枝条木质化程度、枝条萌发季节等纳入因素进一步深入研究。
中山杉无菌体系的建立尤为重要,特别是外植体的消毒是最为关键的环节。试验表明外植体以未木质化、表皮无裂纹的新梢为佳,以0.2% HgCl2处理时间10 min为好,接种20 d时外植体污染率为0,且启动率也达90%。在中山杉启动培养中,腋芽萌动集中出现在接种后10 ~ 20 d,30 d时腋芽便开始展叶及伸长生长。通过正交试验得出NAA,6-BA对其腋芽萌动都有促进作用,其中6-BA起主导作用,而活性炭则相反,对中山杉腋芽萌动有抑制作用。中山杉外植体腋芽启动培养的最佳组合是MS+6-BA1.0 mg·L-1+NAA0.5 mg·L-1。
[1] 张虹. 三峡库区消落带土地资源特征分析[J]. 水土保持通报,2008,28(01):46-49.
[2] 殷云龙,於朝广,华建峰,等. 重庆万州三峡库区消落带中山杉造林试验[J]. 林业科技开发,2014,28(02):110-114.
[3] 陆小清,陈永辉,李乃伟,等. 中山杉优良品种的扦插繁殖技术研究[J]. 安徽农业科学,2011,39(31):19209-19210.
[4] 唐兴国,张美璐. 中山杉离体快繁技术初探[J]. 安徽农业科学,2012,40(16):8836-8838.
[5] 朱跃珍,杨宝明,刘芳,等. 中山杉组培快繁技术研究[J]. 西部林业科学,2013,42(02):107-109.
[6] 郝树芹,朱坤,陈昆. 中山杉微体快繁技术研究[J]. 西部林业科学,2017,46(05):135-138.
[7] 李庆伟,梁明勤,樊亚敏,等. 不同取材时期和处理方法对瓦松无菌体系建立的影响[J]. 江苏农业科学,2014,42(01):55-58.
[8] 金为民. 梅花‘美人梅’组织培养中无菌体系建立的初步研究[J]. 江苏林业科技,2007,34(04):9-11,56.
[9] 张玲玲,郭军站,张敏,等. 垂丝海棠无菌体系建立研究[J]. 北方园艺,2012,265(10):126-129.
[10] 本玛丽,王晓明,李永欣,等. 光皮树优良无性系组织培养的无菌体系建立[J]. 湖南林业科技,2010,37(02):5-7,11.
[11] 于婷乔,秦栋,霍俊伟,等. 不同灭菌条件对蓝果忍冬组培苗成活率的影响[J]. 南方农业学报,2014,45(2):259-265.
[12] 王晓明,易霭琴,宋庆安,等. 灰毡毛忍冬新品种组织培养的无菌体系建立[J]. 经济林研究,2005,23(04):14-16,31.
[13] 刘柏玲,李守洁,张凯,等. 彩叶植物红叶石楠离体再生体系的研究[J]. 林业科技,2016,41(5):1-4.
[14] 施琼,胡峰,黄烈健,等. 马大杂种相思腋芽高效组培增殖体系[J]. 林业科学, 2014,50(6):55-60.
Preliminary Test on Establishment of Sterile Culture of‘Zhongshanshan’
Huang Zhi-wei,Cao Jian
(Chongqing Three Gorges Polytechnic College, Chongqing 404155, China)
Current spring and autumn shoots of 8-year‘Zhongshanshan’ were collect on 16 November of 2017 at cutting orchard in Chongqing for test of sterile culture of explant and axillary bud germination. Sterile culture test was designed by randomized block of three factors, namely type of shoot, concentration and treatment time of HgCl2. The results showed that the best sterile culture of explant was autumn shoot treated by 0.2% HgCl2for 10 minutes, with contamination rate of 0. Axillary bud germination test was designed by orthogonal of L9(34), with NAA, 6-BA and activated carbon as factors. The results indicated that NAA and 6-BA had the positive effect on germination of axillary bud, especially 6-BA, while activated carbon had inhibitory effect. The optimal medium of bud germination was MS + 1.0 mg∙L-1of 6-BA + 0.5 mg∙L-1NAA.
‘Zhongshanshan’; sterile culture; explant disinfection; axillary bud germination
S791
A
1001-3776(2018)05-0061-06
2018-03-29;
2018-07-15
重庆市高职院校新技术推广项目-三峡库区消落带植被恢复中山杉118良种中试与示范(GZTG201611)
黄志伟,工程师,从事林业生态工程研究;E-mail:475221232@qq.com。
曹剑,副教授,从事森林病虫害及林业生态相关研究;E-mail:407586199@qq.com。
10.3969/j.issn.1001-3776.2018.05.010

