外源添加巨桉两种挥发性化合物对受体植物萌发、生长及四种生理指标的影响
李金金, 张健, 余俊里, 汤智群, 王春子, 张丹桔
外源添加巨桉两种挥发性化合物对受体植物萌发、生长及四种生理指标的影响
李金金, 张健, 余俊里, 汤智群, 王春子, 张丹桔*
四川农业大学生态林业研究所, 林业生态工程省级重点实验室, 成都 611130
在前期巨桉挥发性物质鉴定及其林龄效应研究的基础上, 结合预备实验选择含量较高且随林龄变化较为明显的两种挥发性化合物(正癸烷和2,2,4,6,6-五甲基庚烷), 研究其对受体植物(萝卜绿豆莴苣)萌发、生长及四种生理指标的影响。结果显示: 1)两种化感物质对三种受体植物种子萌发均具有抑制作用, 且随浓度升高而增强。两物质对三种受体植物根长呈低促高抑现象且随浓度的增加抑制作用逐渐增强。正癸烷对三种受体植物苗高具有低浓度促进高浓度抑制作用; 2,2,4,6,6-五甲基庚烷对萝卜和莴苣苗高具有低促高抑的作用, 对绿豆苗高呈现高浓度显著抑制作用。正癸烷对萝卜、绿豆苗/根鲜重比随浓度增加呈现不显著或促进作用, 对莴苣苗/根鲜重比作用不显著; 2,2,4,6,6-五甲基庚烷对萝卜和绿豆的苗/根鲜重比呈现低浓度无显著变化高浓度促进作用, 而对莴苣苗/根鲜重比影响不显著。2)正癸烷和2,2,4,6,6-五甲基庚烷对莴苣、2,2,4,6,6-五甲基庚烷对萝卜的SOD活性含量无显著影响, 这两种物质对其它受体植物的SOD、CAT活性均具有低浓度促进或影响不显著, 高浓度时显著抑制作用。两物质对三种受体植物MDA含量具有低浓度抑制或无显著变化, 高浓度促进作用。两种化感物质对三种受体植物幼苗根系活力(TTC)均呈现低浓度促进或影响不显著高浓度抑制作用。
巨桉人工林; 挥发性有机化合物; 种子萌发; 幼苗生长; 生理指标
1 前言
世界人工林正以每年200—300万公顷的速度发展, 目前面积已经超过5000万hm2。我国是人工林面积最大发展最快的国家[1–2]。桉树是一类重要的速生优质树种, 由于其生长速度快、轮伐期短、适应性强、用途广等特点被世界各国大量引种, 目前已成为我国南方地区重要的速生用材林树种[3–4]。但是, 桉树人工林的快速发展也带来了如生物多样性下降、耗水耗肥、地力衰退等一些负面效应, 桉树的化感作用备受争议[5–10]。一些研究发现桉树人工林生物多样性比邻近乡土树种人工林低[11–12], 桉树不同器官水浸提液及林下土壤对幼苗生长生理指标具有显著影响[13–14]; 但也有研究发现桉树人工林的化感作用并不显著, 而水分和土壤表面的硬度是影响林下种子萌发和幼苗生长的主要因子[15]。化感作用是由植物或微生物向环境释放某些化学物质而影响自身或其它有机体(包括植物、动物、微生物)生长发育的现象[16–17]。化感物质主要通过挥发、淋溶、根系释放和腐烂分解等4种途径释放到环境中[18–19]。现有桉树人工林化感作用研究多关注植物器官及土壤水浸提液对受体植物生理作用的影响[20–21], 以萜类为主的挥发性化感物质因其挥发性和较低的水溶性很少受到关注[22–25], 这不利于桉树人工林化感作用的客观评价。有研究表明, 一些萜类化合物在水中具有一定的溶解度并能被土壤颗粒吸附, 能够在土壤中积累达到有效化感浓度从而表现化感活性[26–27]。因此, 研究桉树挥发性化合物(volatile organic compounds: VOCs)对植物的化感作用对全面揭示桉树人工林的化感作用机制具有重要意义。前期, 我们从一个年龄序列巨桉人工林(2、4、6、8、10年)根际土壤中鉴定出38种挥发性化合物[28], 通过这些物质种类、含量与环境因子的相关性分析, 并结合预备实验, 从中选取随环境因子变化较显著且对植物作用较强的2种物质(正癸烷和2,2,4,6,6-五甲基庚烷)做为外源添加物, 进行其对萝卜()、绿豆()、莴苣() 3种植物种子萌发、幼苗生长及四种生理指标的影响研究, 为揭示巨桉人工林挥发性物质化感作用机制提供一定的理论依据。
2 材料与方法
2.1 实验材料
前期在四川省丹棱县杨场镇一个年龄序列巨桉人工林(2、4、6、8、10年)根际土壤中鉴定出38种挥发性化合物, 其中相对含量较高的主要包括烷烃类、芳香酯、芳烃类及苯酚类四类化合物(表1)。选择6种环境因子即郁闭度、土壤容重、土壤含水量、土壤有机质含量、林龄、植物多样性指数与这些物质的种类与相对丰度进行canonical correlation analysis (CCA) 排序(附图1)。经Monte Carlo Test检验, 第一排序轴和其余所有排序轴均显著。由表2, 土壤容重和郁闭度与第一、二排序轴显著相关, 我们将这些VOCs分为4个组, 通过分析及预备实验, 最终初步筛选出8种(正辛烷、十一烷、正癸烷、3-甲基-庚烷、2,4-二甲基庚烷, 3,3-二甲基庚烷, 2,2,4,6,6-五甲基庚烷, 2,4-二叔丁酚)对植物有影响的化合物。本研究选择其中作用较为明显的2种(正癸烷和2,2,4,6,6,-五甲基庚烷)化合物作为外源添加VOCs。正癸烷、2,2,4,6,6-五甲基庚烷(纯度99%)购于GENERISE公司。供试种子萝卜()、绿豆()、莴苣()购买于成都市温江区种子零售点。
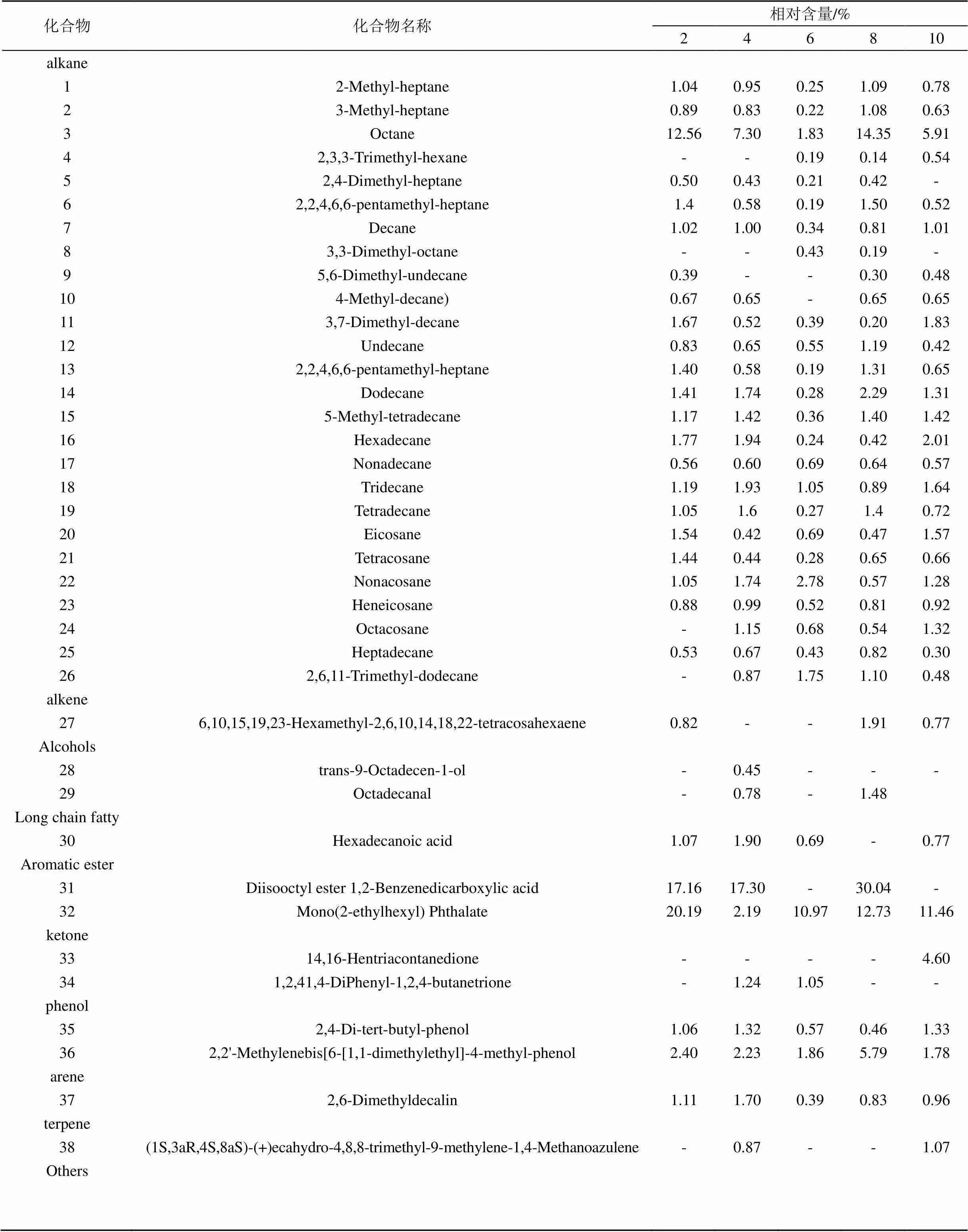
表1 一个年龄序列巨桉人工林根际土壤中的挥发性化学物质组成
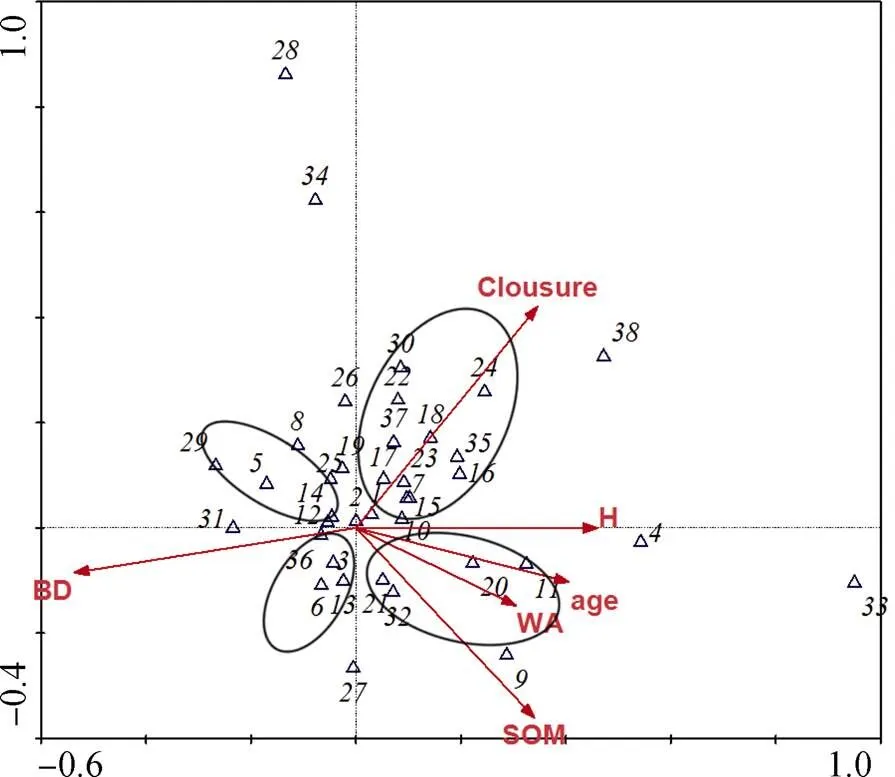
图1 巨桉人工林根际土壤中挥发性化合物与环境因子CCA分析
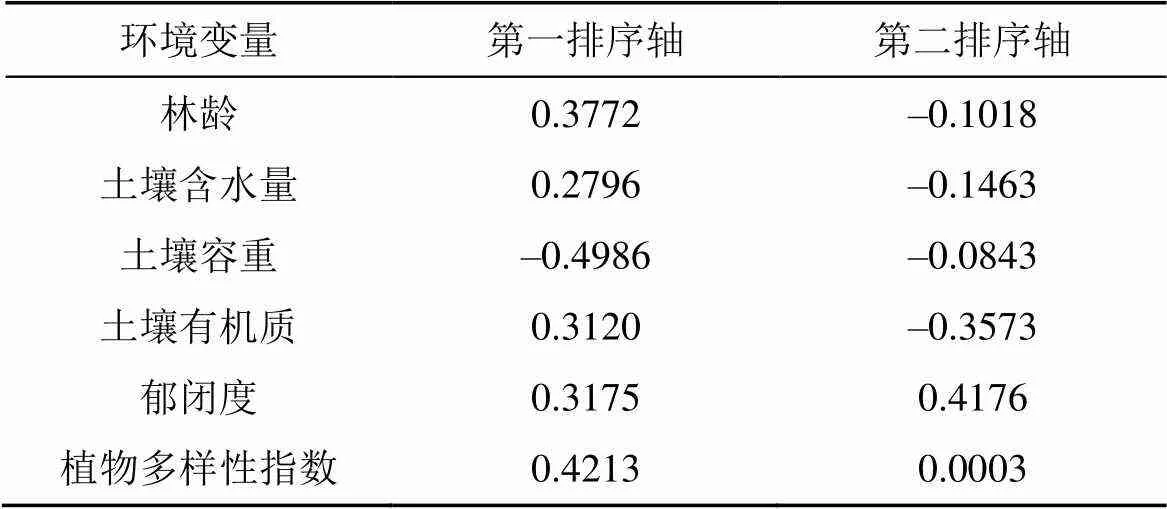
表2 环境因子与排序轴的相关性
2.2 实验方法
种子萌发及幼苗生长: 挑选色泽、大小、饱满度一致的三种受体植物的种子, 经0.15% 的高锰酸钾溶液消毒2 h, 用蒸馏水冲洗干净, 均匀放在已消毒且放有3层滤纸的培养皿(直径10 cm)中, 由于不同受体的种子大小不同, 其中萝卜种子放置100粒, 绿豆种子放置30粒, 莴苣种子放置100粒。通过预实验设定预制浓度(表3), 添加相应体积的正癸烷、2,2,4,6,6-五甲基庚烷至放有受体种子的培养皿中, 每个处理3次重复, 迅速用封口膜封口以防止挥发。将培养皿置于(25±1)℃的恒温培养箱中培养, 湿度保持在60%—70%, 萌发周期为7 天, 当胚根突破种皮则认为已萌发。
2.3 指标测定
记录萌发的种子数。采用微尺法测定根长, 苗高; 用称重法测定苗根鲜重比。
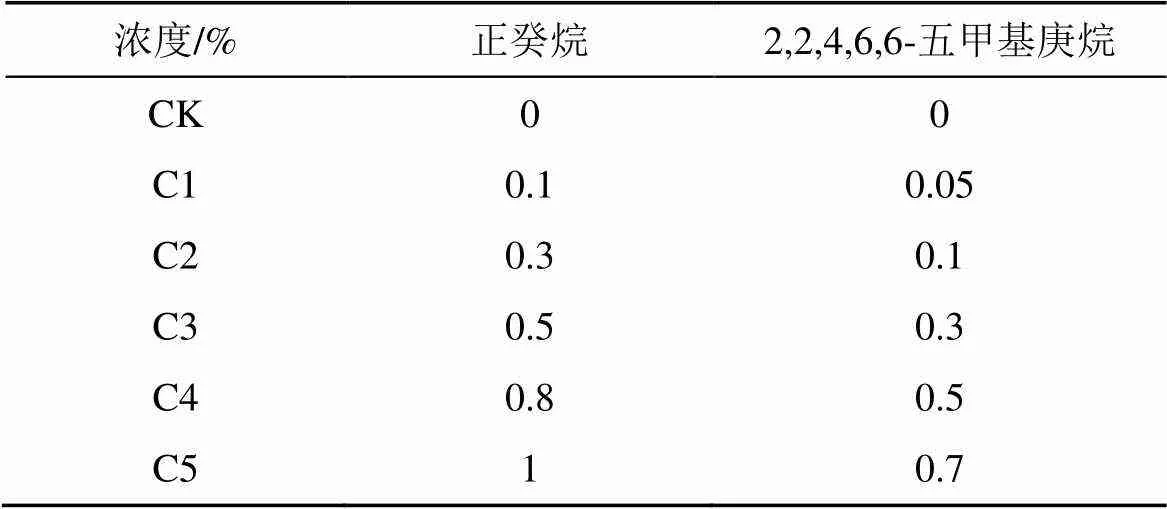
表3 两种挥发性化合物对受体植物的预制浓度
注: CK为对照。
生理指标的测定: 各生理指标除根系活力(TTC)以外均采用南京建成生物研究所提供的试剂盒测定。超氧化物歧化酶(SOD)活力测定采用黄嘌呤氧化酶-羟胺法[29]。丙二醛(MDA)含量采用硫代巴比妥酸比色法测定[30]。过氧化氢酶(CAT)采用紫外吸收法测定[31]。根系活力采用氯化三苯基四氮唑(TTC)法测定[32]。
2.4 数据处理
数据处理按文献(Williamson and Richardson, 1988)[33]进行,采用响应指数()表示化感作用的强弱。
=1-/当≥时
=/-1 当<时
其中为对照,为处理值;<0为抑制,>0为促进,绝对值大小与作用强度一致。各指标数据均为平均值±标准差, 首先对各指标进行方差齐次性检验, 而后采用单因素方差分析(one-way ANOVA)和Tukey多重比较进行挥发性物质浓度对形态及生理指标的差异显著性分析, 显著水平为0.05。所有数据均采用SPSS 17.0统计软件和Origin 8.0软件分析和绘制。
3 结果与分析
3.1 植物萌发、生长指标及化感指数
由表4可知, 正癸烷对萝卜()的萌发率呈现随浓度增加而增强的抑制作用, 但C3-C4浓度间差异不显著, 对绿豆()和莴苣()的萌发率在C2浓度时有所促进, 此后随浓度增加呈显著增强的抑制作用, 但C3-C4浓度间无显著差异。随浓度的增加, 正癸烷对萝卜根长在C1浓度时有促进作用, 此后呈现随浓度增加而增强的抑制作用; 对萝卜苗高随浓度呈现减弱的促进作用; 对萝卜的苗/根鲜重比呈现C1-C4浓度作用不显著而C5浓度时显著促进作用。在C1-C3浓度时对绿豆根长、苗高和苗/根鲜重比作用不显著, 此后呈现显著抑制作用。对莴苣根长C1-C4时显著促进而C5浓度时表现为显著抑制作用; 对莴苣苗高C1-C3浓度呈促进作用此后为显著增强的抑制作用; 对莴苣苗/根鲜重比在各浓度均无显著影响。
由表5可知, 随处理浓度的增加, 2,2,4,6,6-五甲基庚烷对受体植物种子萌发率均呈现抑制作用, C5浓度时抑制作用最强。2,2,4,6,6-五甲基庚烷对萝卜根长的影响表现为随浓度升高显著降低; 对萝卜苗高C1-C3浓度时呈现逐渐减弱的显著促进作用此后则为增强的抑制作用; 对萝卜苗/根鲜重比均呈现促进作用。对绿豆根长呈现C1、C2浓度时无显著变化此后显著降低作用, 但C3-C5浓度间无显著变化; 对绿豆苗高则呈现C1浓度时无变化此后为增强的抑制作用, 但C3-C5浓度间差异不显著; 对绿豆苗/根鲜重比具有随浓度增强的促进作用但C1-C3各浓度间变化不显著。对莴苣根长表现为C1-C3浓度时显著促进此后显著抑制作用; 对莴苣苗高表现为C1-C3无差异C4促进C5抑制作用; 对莴苣苗/根鲜重比在各浓度均无显著影响。
3.2 植物生理指标及化感指数
3.2.1 不同浓度正癸烷对受体植物SOD、CAT、MDA和TTC及化感指数的影响
由图1和2可知, 正癸烷对萝卜幼苗SOD活性C1-C4浓度时无显著变化此后显著降低; 对萝卜CAT活性在C1-C3浓度呈减弱的促进作用此后为>抑制作用; 对萝卜MDA含量在C1-C3浓度时呈减弱的抑制作用此后为显著促进作用; 对萝卜根系活力在C2-C3浓度时显著促进, 此后呈现不显著或抑制作用。对绿豆幼苗SOD活性C1-C3浓度为减弱的促进作用此后呈增强的抑制作用; 对绿豆CAT活性在C1-C3浓度时无显著影响但C4-C5浓度时呈显著抑制作用; 对绿豆MDA含量在各浓度均为促进作用; 对绿豆根系活力呈现低浓度促进(C1和C3)高浓度抑制(C4-C5)作用。对莴苣幼苗SOD活性无显著变化; 对莴苣CAT活性呈现C1-C3浓度无显著影响此后抑制作用增强; 对莴苣MDA含量表现为低浓度(C1-C3)影响不显著此后呈促进作用, 对莴苣根系活力呈低浓度(C1-C3)影响不显著高浓度抑制作用。
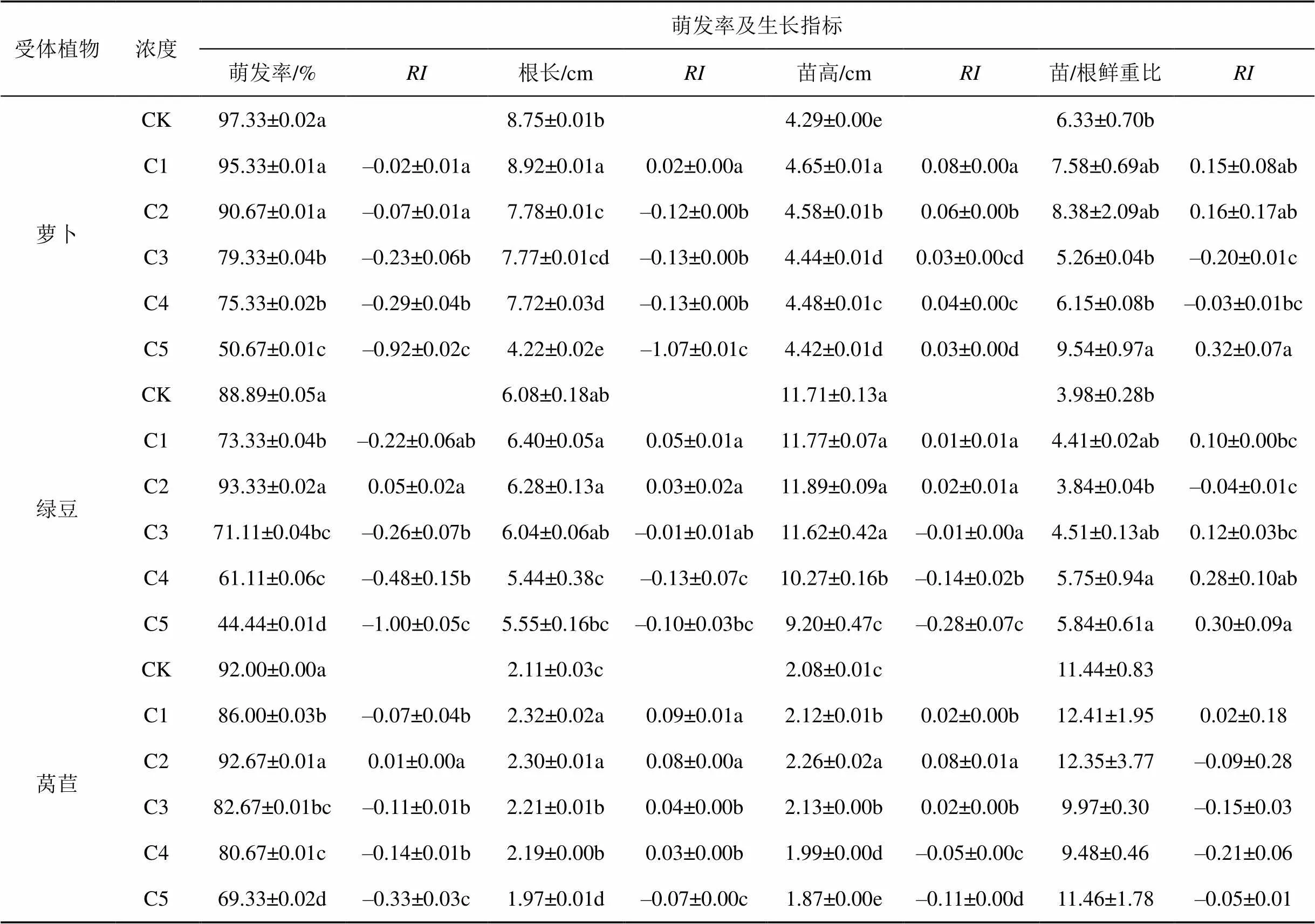
表4 正癸烷不同浓度处理对植物萌发率、生长指标的影响及其化感作用指数
注: 同列字母后不同小写字母表示同一受体植物在不同浓度处理时的差异显著性, 字母不同表示差异显著(<0.05),下同。
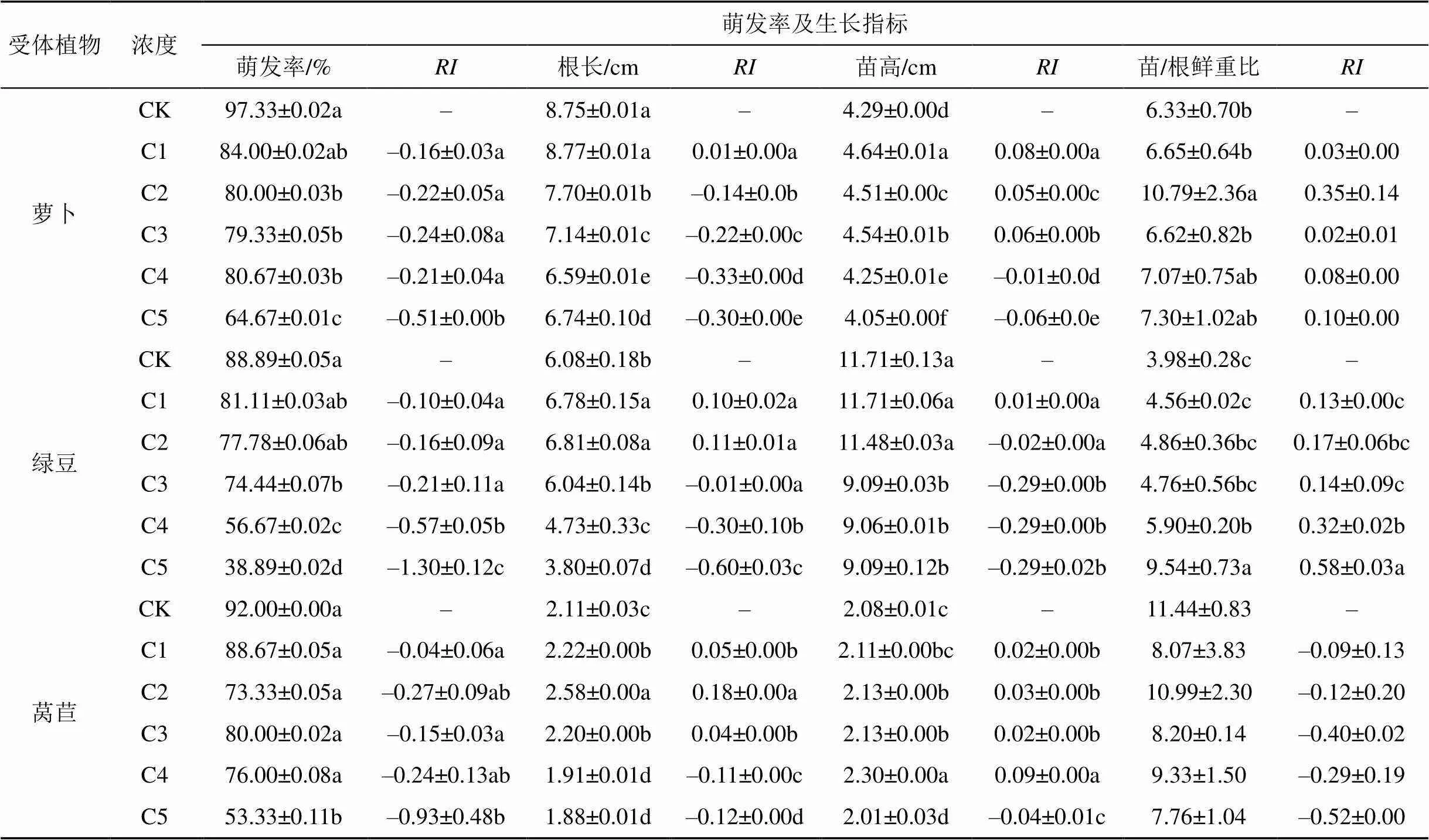
表5 2,2,4,6,6-五甲基庚烷不同浓度处理对植物萌发率、生长指标及其化感作用指数
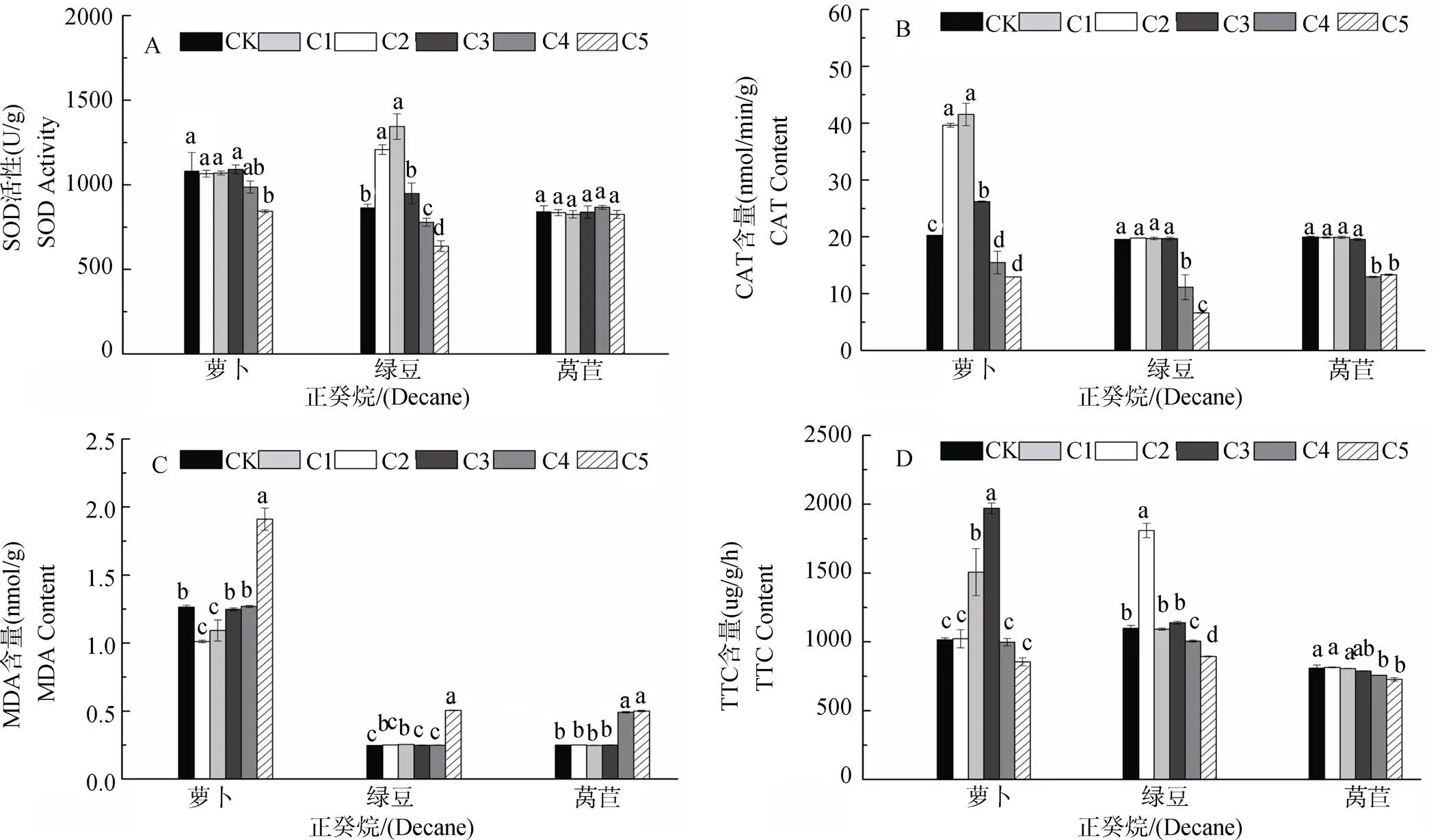
图1 不同浓度正癸烷对受体植物SOD、CAT、MDA和TTC的影响。不同字母表示差异显著(P<0.05)。下同。
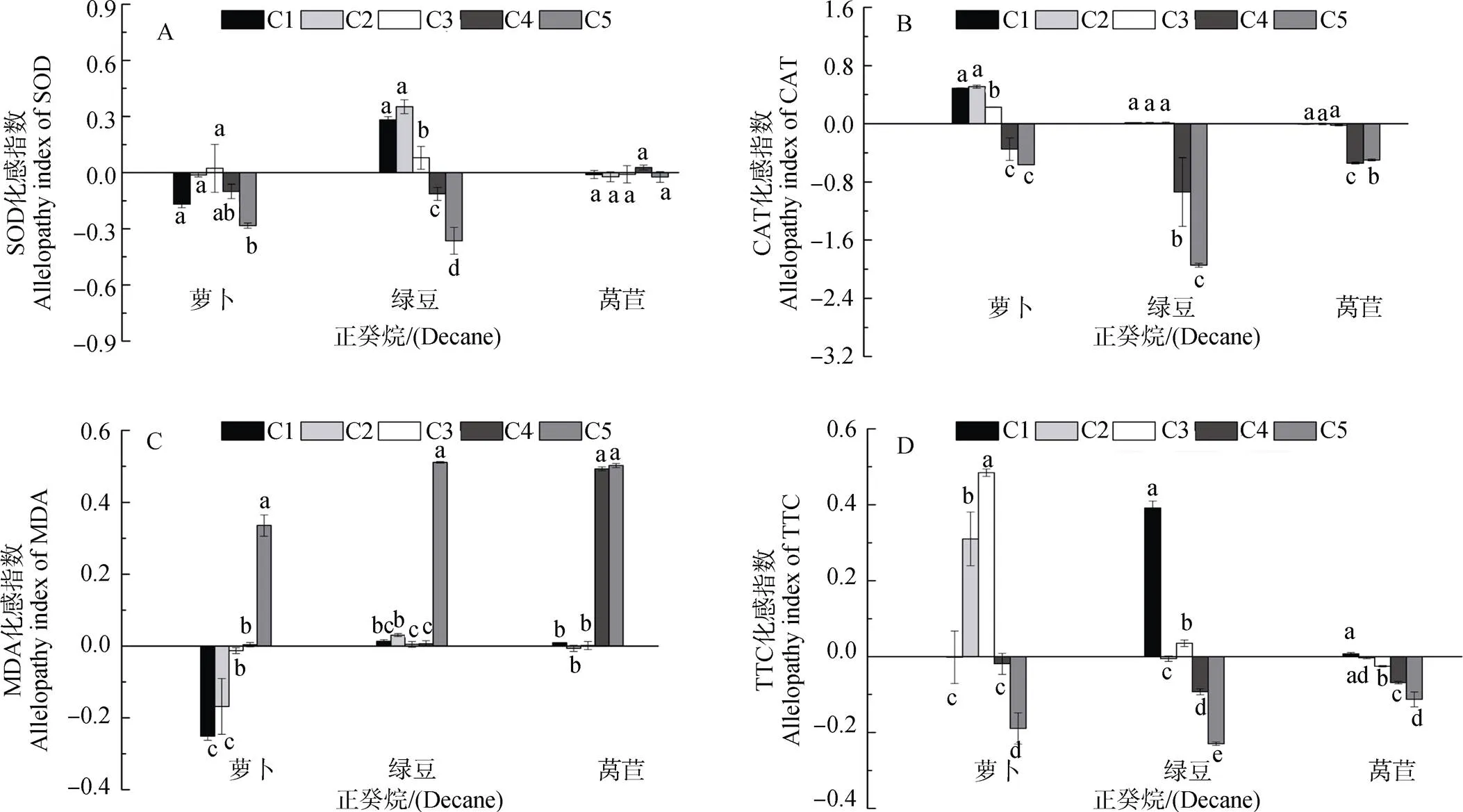
图2 不同浓度正癸烷对受体植物SOD、CAT、MDA和TTC化感指数的影响
3.2.2 不同浓度2,2,4,6,6-五甲基庚烷对受体植物SOD、CAT、MDA和TTC及化感指数的影响
由图3和4可知, 2,2,4,6,6-五甲基庚烷对萝卜幼苗SOD活性C1-C3浓度时显著促进此后呈抑制作用; 对萝卜CAT活性在各浓度均为抑制作用, 但各浓度间无显著差异; 对萝卜MDA含量C1-C2浓度显著抑制此后呈逐渐增强的促进作用; 对萝卜根系活力呈现C1-C3浓度显著促进此后为不显著的抑制作用。对绿豆幼苗SOD活性C1-C3浓度为逐渐减弱的促进作用此后作用不显著; 对绿豆CAT活性C1-C3浓度时显著促进此后呈显著抑制作用; 对绿豆MDA含量在各浓度均呈促进作用; 对绿豆根系活力C1-C3浓度时显著促进此后为逐渐增强的抑制作用。对莴苣幼苗SOD活性在C1浓度时显著促进, 其余各浓度均呈现抑制作用; 对莴苣CAT活性呈现随浓度增加逐渐增强的抑制作用; 对莴苣MDA含量在各浓度均表现为促进作用; 对莴苣根系活力在C1、C3浓度呈促进作用, 其余各浓度均为抑制作用, 且随浓度增加抑制作用逐渐增强。
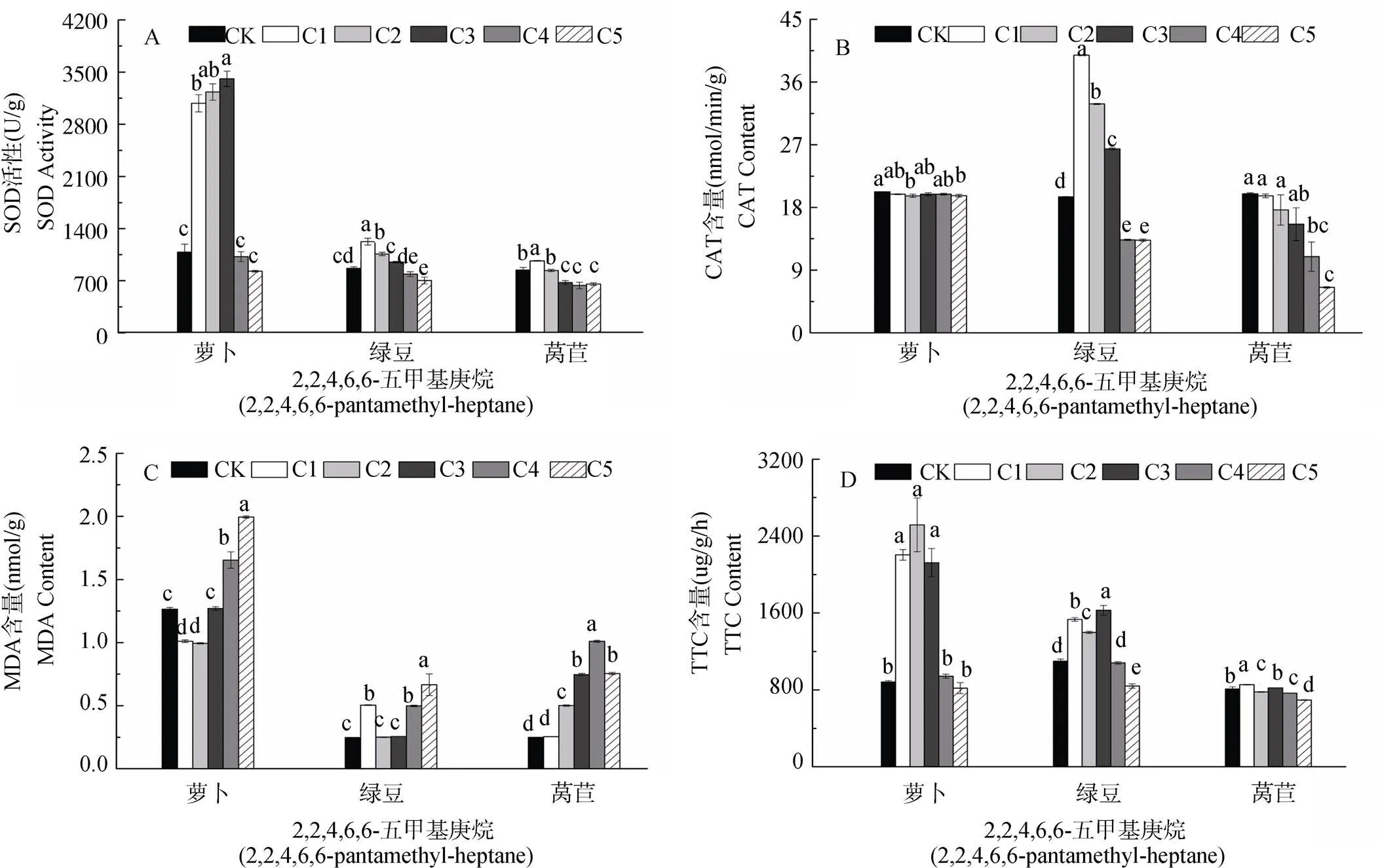
图3 不同浓度2,2,4,6,6-五甲基庚烷对受体植物SOD、CAT、MDA和TTC的影响
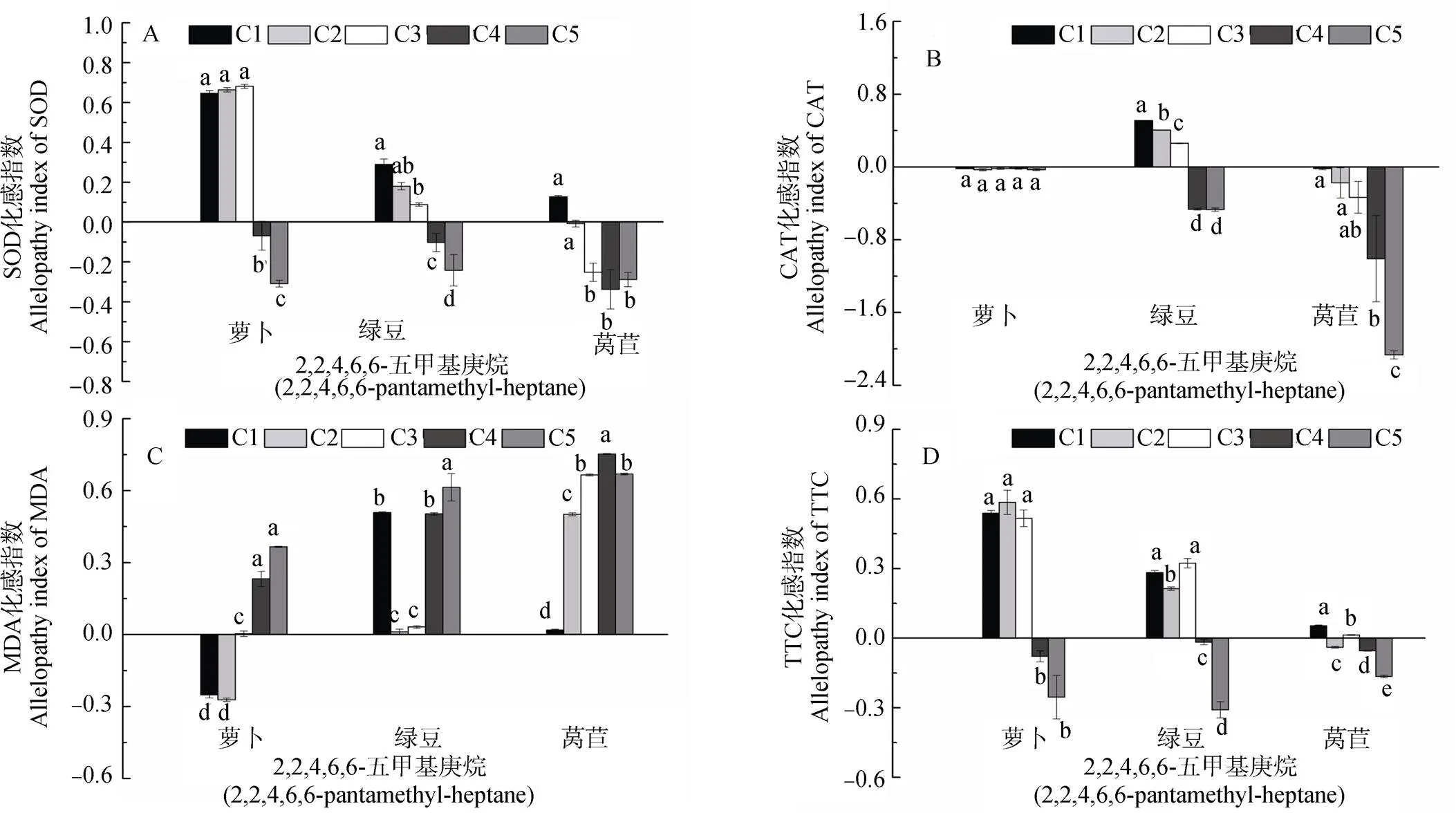
图4 不同浓度2,2,4,6,6-五甲基庚烷对受体植物SOD、CAT、MDA和TTC化感指数的影响
4 讨论
桉树的主要器官如树叶、树皮、树根以及其它器官都会产生一些挥发性化感物质, 这些挥发性化感物质通过挥发、雨雾淋溶及土壤颗粒吸附等途径进入土壤后, 会在土壤生物和非生物因子作用下影响植物生长[34–35]。目前有关桉树人工林挥发性化感物质研究局限在以空气为载体对其他植物的直接作用, 根际土壤中挥发性化感物质对植物的化感作用研究还十分少见[36–37]。前期研究发现, 一个年龄序列巨桉人工林(2、4、6、8、10年)根际土壤中共存在由巨桉产生的38种挥发性单萜化合物, 通过其年龄效应分析及预备实验, 从中选取两种作用较强的物质即正癸烷、2,2,4,6,6-五甲基庚烷, 进行外源添加这两种物质对受体植物生长和生理指标的影响。发现这两种物质对受体植物种子萌发率有抑制作用且表现浓度效应, 对三种受体植物生长及生理指标有不同程度的影响。
本研究中, 正癸烷、2,2,4,6,6-五甲基庚烷对受体植物萌发率均有显著抑制作用。化感物质对植物种子萌发的抑制作用主要是由于化感物质影响了种子萌发所需要的关键酶以及细胞分裂, 使种子萌发过程中缺乏必须的能量以及合成代谢所需的中间产物从而抑制其萌发; 此外, 化感物质能够改变萌发时种皮的渗透性以及种子的吸水作用影响其萌发[38–39]。正癸烷对萝卜苗高呈促进作用; 对绿豆和莴苣苗高在高浓度(C4, C5)时呈显著抑制作用; 2,2,4,6,6-五甲基庚烷对萝卜和莴苣苗高呈现低促高抑的作用, 对绿豆苗高呈现高浓度抑制作用。随浓度增加, 两物质对受体植物根长的作用强于苗高, 且均呈现低促高抑现象。以往研究发现挥发性萜类化合物能抑制根部细胞分裂和伸长, 从而抑制胚根和下胚轴的伸长, 这是由于幼根是最初接触到化感物质的部位, 化感物质对其抑制作用可能更强[40–41]。和以往多数研究的结果一样, 研究发现, 两物质对受体植物根长和苗高均呈现低浓度促进, 而当浓度达到一定水平时则对植物生长有抑制作用[42]。“低促高抑”是植物化感作用常见现象之一, 然而机理尚不清晰, 这种现象可能和低浓度下光合组织资源分配有关, 低浓度的化感物质可能激发活性氧分子的产生, 使细胞壁松弛从而促进生长。植株幼苗的鲜重比可以反映根系吸收水分及幼苗通过光合作用积累光合产物的多少, 且对外界胁迫较为敏感[43]。本研究中, 正癸烷对萝卜苗/根鲜重比呈现促进作用或作用不显著, 对绿豆呈现促进作用, 对莴苣苗/根鲜重比作用不显著; 2,2,4,6,6-五甲基庚烷对萝卜和绿豆的苗/根鲜重比呈现高浓度时促进, 而对莴苣苗/根鲜重比影响不显著。这可能是由于相对于地上部分, 根部对化感物质反应更为敏感, 当根部受害使得水分和养分不能正常供给时导致地上部分生长受到抑制, 幼苗和胚根对化感物质的不同步反应可能是苗/根鲜重比反应不敏感的主要原因。
为了探究上述现象的原因, 进一步测定了受体植物幼苗体内超氧化物歧化酶(SOD)及过氧化氢酶(CAT)活性、丙二醛(MDA)含量、根系活力(TTC)的变化。植株在正常情况下, 体内活性氧处于动态平衡状态, 当植物受到伤害的时候, 植物细胞内活性氧自由基代谢失衡进而引起自由基积累和膜脂过氧化, 使膜系统结构和功能受到伤害[44]。SOD、CAT是植物细胞中清除活性氧, 保护细胞的重要酶系统。本实验中, 正癸烷和2,2,4,6,6-五甲基庚烷对莴苣、2,2,4,6,6-五甲基庚烷对萝卜的SOD含量无显著作用, 这两种物质对其他受体的SOD、CAT活性均呈现低浓度影响不显著或促进, 高浓度显著抑制。两物质对受体植物MDA呈现低浓度抑制或无显著变化, 高浓度促进。这可能是低浓度的化感物质刺激了植物体内的抗氧化系统, 从而使植物体内的SOD、CAT酶活性升高, 从而清除幼苗体内的O2-, 降低膜脂过氧化的伤害, 以至于MDA的含量在低浓度时出现下降趋势。MDA作为膜脂过氧化的最终分解产物之一, 其含量高低指示脂质过氧化强度和膜系统的伤害程度[45]。但当浓度增大时, O2-含量增加使幼苗受害严重, 体内MDA含量也因此增加。幼苗体内的保护性酶不足以清除幼苗体内的O2-, 造成膜脂过氧化伤害加剧, 膜透性增强, MDA合成量急剧增加, 进而导致幼苗生长代谢及生理功能出现紊乱, 诱使幼苗的萌发率以及根长, 苗高较对照受到显著的抑制作用。根系活力(TTC)是根系生长和代谢强度的综合反映, 与养分吸收能力密切相关[46]。本研究表明两种化感物质对受体植物幼苗根系活力呈现低浓度促进或影响不显著高浓度抑制的现象, 在高浓度时导致受体植物幼苗根系活力降低, 这可能是化感物质干扰了根系的物质能量代谢, 从而不利于植株对养分的吸收, 实验中也观察到高浓度胁迫下植物根部呈现浅褐色中毒症状, 侧根和须根数量和长度急剧减少的现象。
5 结论
巨桉产生并在土壤中积累的两种挥发性化合物即正癸烷、2,2,4,6,6-五甲基庚烷对三种受体植物的萌发率均呈随浓度增加而增强的抑制作用; 正癸烷对三种受体植物苗高呈低促高抑作用, 2,2,4,6,6-五甲基庚烷对三种受体植物苗高呈现低浓度影响不显著或促进高浓度抑制作用; 两物质对三种受体植物根长均呈现低促高抑现象; 两物质对萝卜、绿豆苗/根鲜重比呈现不显著或促进作用, 而对莴苣苗/根鲜重比影响不显著。正癸烷和2,2,4,6,6-五甲基庚烷对莴苣, 2,2,4,6,6-五甲基庚烷对萝卜的SOD活性无显著影响, 而这两种物质对其它受体植物的SOD、CAT活性均呈现低浓度影响不显著或促进而高浓度显著抑制现象; 两物质对三种受体植物MDA含量呈现低浓度抑制或无显著变化高浓度时促进作用; 对受体植物根系活力均呈现低浓度促进或影响不显著高浓度抑制作用。前期研究发现, 一个年龄序列(1-10年))巨桉人工林植物多样性在4年左右降低此后随林龄升高, 本研究说明巨桉产生的挥发性化感物质可能是植物多样性降低的原因之一。但在自然条件下, 化感物质的活性浓度会受到多种环境因素的影响, 本研究巨桉人工林所处样地降雨较为丰沛, 可能会对这些物质化感活性的发挥有所缓解。
[1] 张丹桔, 张健, 杨万勤, 等. 一个年龄序列巨桉人工林植物和土壤生物多样性[J]. 生态学报, 2013, 33(13): 3947–62.
[2] FAO. The State of the Worlds Forests(R). Rome: Food and agricultural organization of the United Nations, 2014.
[3] 刘小香, 谢龙莲, 陈秋波, 等. 桉树化感作用研究进展[J].热带农业科学, 2004, 24(2): 54–61.
[4] 唐凤鸾, 陈月圆, 李典鹏, 等. 巨尾桉叶片挥发物对三种植物种子萌发及幼苗生长的化感效应[J]. 广西植物, 2014, (4): 450–454.
[5] 陈秋波. 桉树人工林生物多样性研究进展[J]. 热带作物学报, 2001, 22(4): 82–90.
[6] ZHANG Danju, ZHANG Jian, YANG Wanqin, et al. Effects of afforestation withon soil physico-chemical and microbiological properties[J]. Soil Research, 2012, 50(2): 167–176.
[7] WALL A, HEISKANEN J. Water-retention characteristics and related physical properties of soil on afforested agricultural land in Finland[J]. Forest Ecology and Management, 2003, 186(1/3): 21–32.
[8] SICARDI M, GARCIA-PRECHAC F, FRIONI L. Soil microbial indicators sensitive to land use conversion from pastures to commercial(Hill ex Maiden) plantations in Uruguay[J]. Applied Soil Ecology, 2004, 27(2): 125–133.
[9] ANDREW R L, KESZE L A, FOLEY W J. Intensive sampling identifies previously unknown chemotypes, population divergence and biosynthetic connections among terpenoids in Eucalyptus tricarpa[J]. Phytochemistry, 2013, 94(10): 148.
[10] TANG Zhiqun, ZHANG Jian, YU Junli, et al. Allelopathy effects of volatile organic compounds from Eucalyptus grandis rhizosphere soil on Eisenia fetida assessed using avoidance bioassays, enzyme activity, and comet assays[J]. Chemosphere, 2017, 173: 307–317.
[11] ZHANG Chenlu, LI Xiaowei, CHEN Yuanqi, et al. Effects oflitter and roots on the establishment of native tree species inplantations in South China[J]. Forest Ecology and Management, 2016, 375: 76–83.
[12] INDERJIT, CALLAWAY R M. Experimental designs for the study of allelopathy[J]. Plant and Soil, 2003, 256(1): 1–11.
[13] CHU Chaojun, Mortimer P E, WANG Hecong, et al. Allelopathic effects of Eucalyptus on native and introduced tree species[J]. Forest Ecology and Management, 2014, 323(7): 79–84.
[14] BEHERA N, SAHANI U. Soil microbial biomass and antivity in response to Eucalyptus plantation and natural regeneration on tropical soil[J]. Forest Ecology and Management, 2003, 174(1): 1–11.
[15] 杨晓波, 李东海, 李跃烈, 等. 桉树人工林土壤环境对植物种子发芽和生长的影响[J]. 林业科学, 2006, 42(12): 148– 153.
[16] RICE E L. Allelopathy[M]. USA, Academic press, 1984.
[17] 孔垂华, 胡飞. 植物化感相生相克作用及其应用[M]. 北京: 中国农业出版社, 2001.
[18] 孔垂华. 植物化感作用研究中应注意的问题[J]. 应用生态学报, 1998, 9(3): 332-336.
[19] INDERJIT, WARDLE D A, KARBAN R, et al. The ecosystem and evolutionary contexts of allelopathy[J]. Trends in Ecology and Evolution, 2011, 26(12): 655–662.
[20] CHEN Falin, ZHENG Hua, ZHANG Kai, et al. Soil microbial community structure and function responses to successive planting of[J]. Journal of Environmental Sciences, 2013, (10): 2102–2111.
[21] 方碧真, 余世孝, 王永繁, 等. 尾叶桉对8种乡土树种的化感作用[J]. 中山大学学报(自然科学版), 2010, 49(5): 113–117.
[22] 谷文祥, 段舜山, 骆世明. 萜类化合物的生态特性及其对植物的化感作用[J]. 华南农业大学学报, 1998, 19(4): 108–112.
[23] 王朋, 王莹, 孔垂华. 植物挥发性单萜经土壤载体的化感作用: 以三裂叶豚草()为例[J]. 生态学报, 2008, 28(1): 62–68.
[24] 张红, 贾贵芳, 王亚男, 等. 加拿大蓬挥发油经不同载体对蚕豆根尖的细胞毒性[J]. 生态环境学报, 2010, 19(8): 1872–1875.
[25] 张秋菊, 张爱华, 孙晶波, 等. 植物体中萜类物质化感作用的研究进展[J]. 生态环境学报, 2012, 21(1): 187–193.
[26] ELROKIEK K G, EID R A. Allelopathic effects of Eucalyptus citriodora on amaryllis and associated grassy weed[J]. 2009, 27: 887–899.
[27] AHMED R, HOQUE ATMR, HOSSAIN MK. Allelopathic effects of leaf litters of Eucalyptus camaldulensis on some forest and agricultural crops[J]. Journal of Forestry Research, 2008, 19(1): 19–24.
[28] ZHANG Danju, ZHANG Jian, YANG Wanqin, et al. Potential allelopathic effects ofacross a range of plantation age[J]. Ecological Research, 2010, 1(25):13–23.
[29] QYANAGUI Y. Reevaluation of assay methods and establishment of kit for superoxid dismutase activity[J]. Analytical Biochemistry, 1984, 142(2): 290–296.
[30] KOSUGI H, KIKUGAWA K. Thiobarbituric acid reaction of aldehydes and oxidized lipids in glacial acetic acid[J]. Lipids, 1985, 20(12): 915–921.
[31] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[32] ZHANG Jinbiao, AN Min, WU Hanwen, et al. Chemistry and bioactivity of Eucalyptus essential oils[J]. Allelopathy Journal, 2010, 2(25): 313–330.
[33] WILLAMSON G B, RICHARDSON D. Bioassy for allelopathy: Measuring treatment responses with independent controls[J]. Journal of Chemistry Ecology, 1988, 14(1): 181–187.
[34] 彭少麟, 南蓬, 钟扬. 高等植物中的萜类化合物及其在生态系统中的作用[J]. 生态学杂志, 2002, 21(3): 33–38.
[35] 王晗光. 巨桉化感物质的成分分析及其化感作用的初步研究[D]. 成都: 四川农业大学, 2006.
[36] KONG Chuihua, HUANG Shoushan, HU Fei. Allelopathy of Ageratum conyzoides.V . Biological activities of the volatile oil from ageratum on fungi, insects and plants and its chemical constituents[J]. Acta Ecologica Sinica, 2001, 21(4): 574–587.
[37] KONG Chuihua, HU Fei, Xu Xiaohua. Allelopathic potential and chemical constituents of volatiles from Ageratum conyzoides under stress[J]. Journal of Chemical Ecology, 2002, 28(6): 1173–1182.
[38] BARRERO J M, DOWNIE A B, XU Qian, et al. A role for barley CRYPTOCHROME1 in light regulation of grain dormancy and germination[J]. Plant Cell, 2014, 26(3): 1094–1104.
[39] ISHIBASHI Y, KODA Y, ZHENG Shaohui, et al. Regulation of soybean seed germination through ethylene production in response to reactive oxygen species[J]. Annals of Botany, 2013, 111(1): 95–102.
[40] 马亚飞, 杨平, 吴凤芝. 不同品系小麦根系分泌物对黄瓜化感作用的初步研究[J]. 中国蔬菜, 2011, 1(10): 23– 27.
[41] 杨期和, 叶万辉, 廖富林, 等. 植物化感物质对种子萌发的影响[J]. 生态学杂志, 2005, 24(12): 1459–1465.
[42] 曹子林, 王晓丽, 杨桂英. 紫茎泽兰气态挥发物对云南松种子萌发及幼苗生长的化感作用[J]. 江西农业大学学报, 2012, 34(1): 77–81.
[43] 杨廷杰, 王晓伟, 赵康, 等. 邻苯二甲酸对萝卜种子萌发、幼苗叶片膜脂过氧化及渗透调节物质的影响[J]. 生态学报, 2013, 19(33): 6074–6080.
[44] ZHANG Eenping, ZHANG Wenbo, ZHANG Shuhong, et al. Effects of exogenic benzoic acid and cinnamic acid on the root oxidative damage of tomato seedlings[J]. Journal of Horticulture and Forestry, 2010, 19(1): 186–190.
[45] TAN Zhoujin, LI Qian, CHEN Donglin, et al. On the effect of rice-straw returned to the field on microbes and enzyme activity in paddysoil[J]. Acta Ecologica Sinica, 2006, 26(10): 3385–3392.
[46] 白祯, 黄胡, 黄建国. 青蒿素对蔬菜种子发芽和幼苗生长的化感效应[J]. 生态学报, 2013, 33(23): 7576–7582.
Effects of two exogenously added volatile compounds fromplantations on seed germination, seedling growth and four physiological indexes of target plants
LI Jinjin, ZHANG Jian, YU Junli, TANG Zhiqun, WANG Chunzi, ZHANG Danju*
Institute of Ecology and Forestry, Key Laboratory of Ecological Forestry Engineering in Sichuan Province, Sichuan Agricultural University, Chengdu 611130, China
On the basis of identification of volatile compounds across a range ofplantation ages and through preliminary experiments, two volatile compounds (Decane and 2,2,4,6,6-Pentamethyl-heptane) were selected to evaluate their effects on the seed germination, seedling growth and four physiological indexes of three target plants (,,). The results showed that the two volatile compounds exerted inhibitory effects on the seed germination of three target plants, and the inhibitory effects were strengthened with the increasing concentrations. The roots length was stimulated at lower dose but was inhibited at higher concentrations, and the effects were strengthened with the increasing concentrations. The shoot heightof three target plants under the treatment of decane was stimulated at lower concentrations, and was inhibited at higher dose. Under 2,2,4,6,6-pentamethyl-heptane treatment, the shoot height ofandwas stimulated at lower concentrations and was inhibited at the higher concentrations, but that ofwas inhibited significantly at the higher concentrations. There were no obvious effects of 2,2,4,6,6-pentamethyl-heptane on the seedling/root fresh weight ratio ofandat lower concentration but represented significantly stimulative effects at higher concentrations, but the effect on seedling/root fresh weight ratio ofwas not obvious with the increasing concentrations. 2) The SOD activities ofunder the treatments of decane and 2,2,4,6,6-Pentamethyl-heptane, and those ofunder the treatment of 2,2,4,6,6-Pentamethyl-heptane were not significantly changed with the increasing concentrations. All the other treatments stimulated or represented no significant effects on the SOD and CAT activities of target plants at lower concentrations, but the two enzyme activities were inhibited at higher concentrations. The two chemicals were apparently reduced or showed no significant effects on the MDA content of target plants at lower concentrations, but stimulated at higher concentrations. The TTC contents of the three plants were promoted or not obviously affected at lower concentrations, but were inhibited at higher concentrations.
plantations; volatile organic compounds; seed germination; seedling growth; physiological index.
10.14108/j.cnki.1008-8873.2018.06.002
Q143
A
1008-8873(2018)06-09-11
2017-11-03;
2017-12-12
国家自然科学基金项目(31300528)
李金金(1993—), 女, 河南人, 在读硕士, 主要从事森林生态学研究, E-mail: jjl_0907@126.com
张丹桔, 女, 博士, 副研究员, 主要从事森林生态学研究, E-mail: zdj_8080573@sohu.com
李金金, 张健, 余俊里, 等. 外源添加巨桉两种挥发性化合物对受体植物萌发、生长及四种生理指标的影响[J]. 生态科学, 2018, 37(6): 9-19.
LI Jinjin, ZHANG Jian, YU Junli, et al. Effects of two exogenously added volatile compounds fromplantations on seed germination, seedling growth and four physiological indexes of target plants[J]. Ecological Science, 2018, 37(6): 9-19.

