射干真叶、花蕾诱导愈伤组织的研究
燕晨宇,张 翔,秦民坚*
(1.南京市宁海中学,江苏 南京 210024;2.中国药科大学 中药学院,江苏 南京 211198)
射干[Belamcandachinensis(L.) DC.]是鸢尾科(Iridaceae)多年生草本植物,常以干燥根茎入药,具有清热解毒,消痰,利咽的功效[1]。现代研究表明射干主要活性成分是异黄酮类化合物如鸢尾苷,鸢尾甲苷,野鸢尾苷等[2-3],具有抗炎[4]、抗氧化[5]、抗病毒[6]、清除自由基[7]、雌激素样作用[8],在治疗心血管系统疾病、骨质疏松等疾病[9]方面具有很好的前景。以射干叶片、茎尖、假茎、腋芽、幼茎诱导愈伤组织已有报道[10-13],尚未见以射干无菌苗真叶、花蕾诱导愈伤组织的报道。本文以射干真叶、花蕾为外植体,探索不同浓度激素配比及AgNO3浓度对射干愈伤组织诱导的影响,高效愈伤组织诱导条件的获得将为后续射干细胞悬浮体系的成功构建奠定基础。
1 材料与方法
1.1 材料
射干种子和花蕾采自中国药科大学药用植物园鸢尾科种质资源圃。实验材料经中国药科大学秦民坚教授鉴定为射干[Belamcandachinensis(L.) DC.],凭证标本存放于中国药科大学中药资源系。
1.2 方法
1.2.1 射干无菌苗真叶的获取
挑选饱满、无病变的射干种子,搓去射干外种皮,流水冲洗干净,75%乙醇处理30 s,无菌水冲洗1次,然后用2% NaClO溶液浸泡15 min,期间振荡数次,无菌水冲洗5次,播种于MS(含3%蔗糖、0.55%琼脂粉,pH值为5.8)基本培养基上,置于光照培养箱1 500 lx,(25±1)℃,两周左右射干种子开始陆续萌发,20天后,取射干真叶作为外植体备用。
1.2.2 射干花蕾的灭菌
取射干的花蕾,用软刷清洗材料表面,流水冲洗30 min后移至超净工作台。75%乙醇溶液浸泡30 s,无菌水冲洗,然后用2% NaClO溶液浸泡10 min,期间不断摇动,无菌水冲洗5次,作为外植体备用。
1.2.3 射干愈伤组织的诱导
以MS 为基本培养基,添加不同浓度的2,4-D、6-BA、NAA、AgNO3配置为射干真叶的愈伤组织诱导培养基;添加不同浓度的2,4-D、6-BA、NAA、KT配置为射干花蕾的愈伤组织诱导培养基(均含3%蔗糖,0.55%琼脂粉,pH值为5.8)。 将真叶、花蕾剪切成为0.5~1.0 cm的切块分别接入各自诱导培养基,其中每个培养皿接种7~8个外植体,每个处理10个重复,(25±1) ℃黑暗培养,接种7天后每天观察并记录射干愈伤组织的形成情况,包括最早形成时间、颜色和质地等,60天后统计愈伤组织诱导率。
1.2.4 射干愈伤组织类型的鉴定
挑取一小块射干愈伤组织于载玻片上,捣碎,加1~2滴1 mol·L-1盐酸水解5 min, 吸水纸吸干盐酸,水洗3次,每次用吸水纸吸干,加1滴卡宝品红染色剂染色5 min,加盖玻片压片,Olympus IX71光学显微镜下观察愈伤组织的细胞形态特征。
2 结果与分析
2.1 射干愈伤组织的形成
射干真叶愈伤组织总体启动较慢,接种2周后,观察到部分射干真叶卷曲,接着在切口处渐渐有凸起物,并逐渐向外植体中部不断扩展,30 d后陆续观察到愈伤组织的出现(图1 A),其中附加2,4-D 1.0 mg·L-1、6-BA 1.5 mg·L-1、NAA 1.0 mg·L-1、AgNO315 mg·L-1的组合为真叶愈伤组织诱导率最高的组合(处理1-6),为62.5%,见图1B。以花蕾为外植体诱导的愈伤组织,其中附加的2, 4-D、6-BA、NAA浓度都是1.0 mg·L-1的培养基,其愈伤组织诱导率最高(处理2-6),为64.5%,见表2,总体上,花蕾为外植体的愈伤组织启动时间早于真叶,20 d可以明显观察到愈伤组织的出现(图1 C、D)。
诱导射干愈伤组织的时候,不同激素的添加,不仅仅是为了获得较高的出愈率,也是为了控制愈伤组织的质量。射干愈伤组织以黄色、淡黄色、黄白色为主,淡黄色的愈伤组织含有粘液或水渍状,生长缓慢且不均匀,部分黄白色的愈伤组织培养时间长会发生褐变现象。通过对射干愈伤组织进行镜检(图2),发现其主要分为两类细胞:一类是细胞呈圆形或椭圆形,细胞形状规则,内含物丰富,但生长速度一般的胚性愈伤组织,另一类是细胞不规则,表面结构疏松,有较多覆盖物,其内几乎无细胞器,生长速度较快的非胚性愈伤组织。
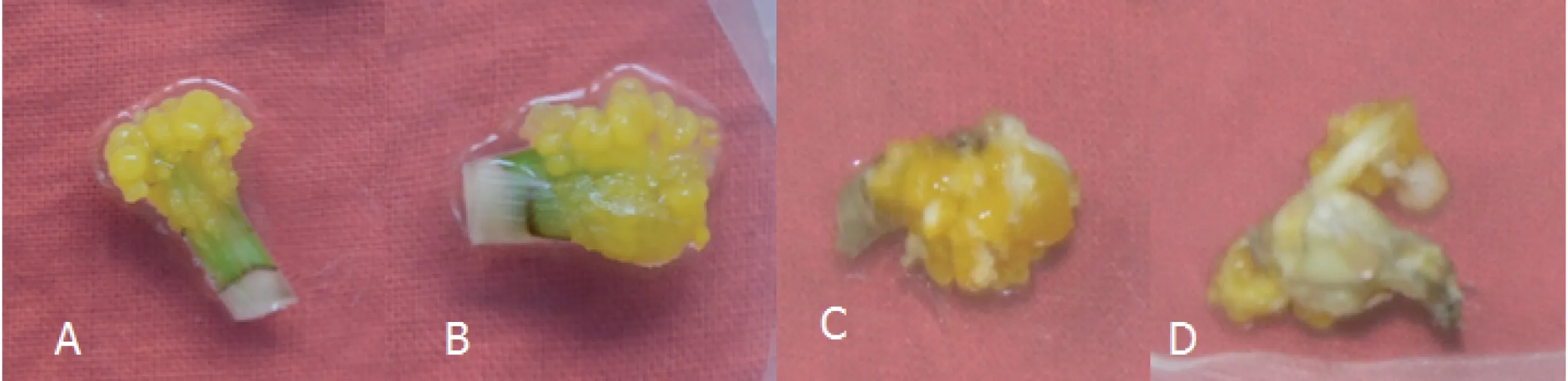
图1 射干愈伤组织特征(A、B:真叶形成的愈伤组织;C、D:花蕾形成的愈伤组织)

表1 不同激素及AgNO3浓度对射干真叶愈伤组织诱导的影响
注:“+”表示生长一般,“++”表示愈伤组织生长较好,“+++”表示生长良好;“-”表示无现象

图2 射干胚性与非胚性愈伤组织细胞(400×)
2.2 不同激素、硝酸银浓度对射干愈伤组织诱导的影响
由表1、2可以得出,当不加入2,4-D时,射干真叶与花蕾的愈伤组织诱导率都为0,可见 2,4-D对射干愈伤组织的诱导起着至关重要的作用;同时随着2,4-D浓度的增加,真叶与花蕾的愈伤组织诱导率逐渐下降,其中处理1-9中,愈伤组织的诱导率仅为4.0%,综合实验结果,射干真叶与花蕾都以2,4-D浓度为1.0 mg·L-1时愈伤组织的诱导率最高,这与路易斯鸢尾[14]诱导愈伤组织的研究结果基本一致。
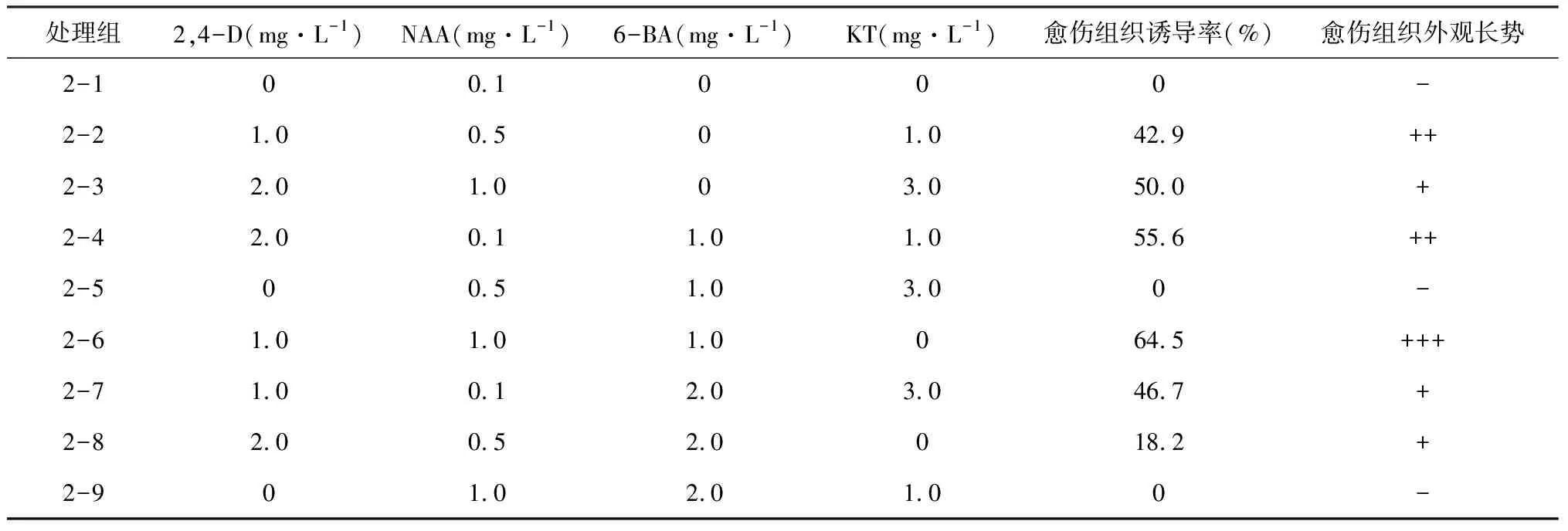
表2 不同激素组合对射干花蕾愈伤组织诱导的影响
注:“+”表示生长一般,“++”表示愈伤组织生长较好,“+++”表示生长良好;“-”表示无现象
由表1对比可以得出,当AgNO3浓度在0~20 mg·L-1内,随着加入量的增加,愈伤组织的诱导率逐渐提高。当AgNO3浓度为15 mg·L-1时,射干愈伤组织的诱导率达到最高,为62.5%。本实验结果表明AgNO3对射干真叶愈伤组织的诱导有一定的影响,结合愈伤组织的显微观察,认为AgNO3可能对射干胚性愈伤组织的诱导有一定的作用,这与张慧英等[12]的研究结果相一致。
综合表1、表2,得出射干真叶愈伤组织诱导的最佳培养基为:MS+2,4-D 1.0 mg·L-1+6-BA 1.5 mg·L-1+NAA 1.5 mg·L-1+ AgNO315 mg·L-1,花蕾愈伤组织诱导的最佳培养基为:MS+2,4-D 1.0 mg·L-1+6-BA 1.0 mg·L-1+NAA 1.0 mg·L-1,比较发现射干花蕾的愈伤组织诱导率略高于真叶,诱导的激素水平整体比真叶略低,不需要添加KT,可能由于射干花蕾孕育开花,内源激素水平比较高的缘故。
3 讨 论
(1)采用射干无菌苗真叶作为外植体可以直接进行愈伤组织的诱导,从而缓解了采用外界射干叶片、茎尖、假茎等作为外植体时污染率较高的问题。
(2)射干愈伤组织有胚性愈伤组织和非胚性愈伤组织两种,在条件合适的情况下,可以相互转化。在植物体细胞胚发生过程中,激素发挥了非常重要的作用,其中以生长素的作用尤为重要,细胞分裂素起到了协同作用,2,4-D是诱导胚性愈伤组织的重要激素[17],陈以峰等在针对水稻体细胞胚发生的研究显示,2,4-D 通过促进内源性的IAA含量提高,诱导了水稻胚性细胞的形成。
(3)AgNO3对诱导射干胚性愈伤组织有一定的作用。目前,AgNO3用于药用植物愈伤组织诱导的报道较少, AgNO3作为乙烯合成的抑制剂可有效防止植物细胞在离体培养中乙烯的积累对外植体生长和不定芽分化的影响,在植物离体培养时培养基中添加AgNO3可明显促进器官发生、体细胞胚形成和离体植株的再生[18-19]。
(4)胚性愈伤组织具有亲本的遗传特性,不论在离体快繁、种质保存、细胞工程、遗传转化,还是在细胞水平上的生理生化、原生质体、离体诱变等研究方面都具有独特的应用[20]。射干愈伤组织的诱导体系建立,为后续射干体细胞胚的诱导与细胞悬浮培养等的研究提供了良好的基础。

