乌头霜霉病传播机制初步研究
陈茂婷 书剑琴 李文敏 胡琪琪 王光志 欧洪


【摘 要】 目的:明確乌头霜霉病病原菌的繁殖方式及传播途径,为乌头霜霉病的生物防治技术提供理论基础。方法:调查不同种源地乌头霜霉病发病情况,并对患病乌头的根、茎、叶进行石蜡切片,在光学显微镜下观察病原菌的繁殖方式;采用扫描电子显微镜观察乌头病叶上病原菌的定殖、生长以及传播的方式。结果:不同种源地的乌头幼苗霜霉病发病情况不同;通过显微观察,在患病乌头的茎和叶中均发现了卵孢子,在种根中未观察到卵孢子;在电子显微镜下观察乌头霜霉病叶,发现孢子囊以萌发芽管的方式,通过叶片气孔或者伤口定殖于植株上,并通过在细胞间产生吸器从寄主吸取营养,萌发孢囊梗,再产生孢子囊。结论:乌头霜霉病发病与种苗是否带菌有关,其传播可能是乌头霜霉卵孢子在种苗内越冬,春天萌发侵染乌头。
【关键词】 乌头;霜霉病;种苗;繁殖方式;传播机制
【中图分类号】R282.2 【文献标志码】 A【文章编号】1007-8517(2019)21-0016-05
Preliminary Study on the Transmission Mechanism of Downy Mildew of Aconitum carmichaeli Debx.
CHEN Maoting1 SHU Jianqin1 LI Wenmin1 HU Qiqi1 WANG Guangzhi1 OU Hong2*
1.Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China;
2.Chengdu University of Traditional Chinese Medicine Clinical Medical College, Chengdu 611137, China
Abstract:Objective To clarify the propagation mode and transmission route of the pathogen of downy mildew of aconitum, and to provide theoretical basis for the prevention and treatment of downy mildew of aconitum. Methods The incidence of downy mildew was investigated in different provenances of aconitum, and paraffin sections were made on the roots, stems and leaves of the diseased aconitum, and the sexual reproduction of pathogenic bacteria was observed under optical microscope. Scanning electron microscopy was used to observe the colonization, growth and spread of pathogenic bacteria on aconitum leaf. Results The incidence of downy mildew was different in different provenances. Ospores were found in the stem and leaf of the diseased aconite, but not in the root. The leaf of downy mildew of aconite was observed under electron microscope, and the sporangium was found to be colonized on the plant by means of bud tube, leaf stomata or wound, and produced between the cells suckers to absorb nutrients from the host, germinated sporangium and then produced sporangium. Conclusion The incidence of aconitum downy mildew is related to whether or not the seedlings carry bacteria. The transmission of aconitum oospores may be that the oospores of Aconitum aconitum overwintering in the seedlings and germinating into aconitum in spring.
Keywords:Aconitum carmichaeli Debx; Downy Mildew.; Seedlings; Reproduction Mode; Ttransmission Mechanism
毛茛科烏头属植物乌头(Aconitum carmichaeli Debx.)为常用药用植物,其干燥子根附子具有回阳救逆、补火助阳、散寒止痛等功效,母根川乌具有祛风除湿、温经止痛等功效,均为著名川产道地药材[1]。主产区为四川江油、布拖。其中江油市作为乌头的道地产区,已有一千多年的栽培历史。随着川乌、附子的需求量日益增大,乌头的种植规模也逐渐增大,但在栽培过程中,发现多种植物病害。其中,对附子药材产量影响较大的有霜霉病、根腐病和白绢病,这几种病害常常相互交叉影响,严重时可引起50%以上的减产[2]。
霜霉病是一种发病率较高的叶类病害,具有发病时间早、传播速度快、防治困难等特点。在经济作物和农作物中有较深入的研究[3-4],并且研制出了防治效果较好的生防试剂[5-6],但在药用植物中的研究较少。乌头霜霉病病原菌是余永年在1979年发现的一种新的病原菌[7],病原物主要是鞭毛菌亚纲卵菌目霜霉科霜霉属乌头霜霉Peronospora aconite Yu. 。本课题组在前期的工作中,基于显微结构、超微结构和分子生物学技术,对乌头霜霉病的病原物进一步进行了准确鉴定,并建立了该病原物的快速检测技术[8-9]。但目前缺乏关于乌头霜霉病病原菌的繁殖方式及传播机制的研究,防治问题依然困难。
病害防治是植物栽培过程中很重要的环节,及时有效地防止病害发生能提高药材的产量和质量。为了找到适当的方法阻隔病原菌的繁殖,减少病原菌的传播,本实验通过调查不同种源地乌头幼苗的患病情况,采用光学显微观察乌头不同部位的石蜡切片,扫描电子显微观察乌头病叶,对乌头霜霉病病原菌的繁殖方式和传播机制进行了初步探究。
1 材料
1.1 植物来源 于2015年11月从北川县小坝乡(104°10′33.70″E,32°00′18.13″N,海拔1413m)、青川县房石镇(104°57′20.11″E,32°21′50.52″N,海拔1133 m)、青川县大坝乡(105°09′24.16″E,32°30′10.52″N,海拔906 m)安县茶坪乡(104°15′29.04″E,31°42′49.94″N,海拔1041 m)采集乌头种苗,随机选择各地部分种根浸泡于F.A.A固定液中,将其余种根种植于实验田里,每种源地幼苗各栽培40株。2016年2月底,待实验田里乌头出苗后,观察并采集乌头霜霉病病株。从四川省江油市普照村优质无公害附子GAP生产基地(104°41′27.24″E,31°43′47.00″N,海拔512 m),采用“随机采样法”[10],每个点采集3份不同发病程度的乌头霜霉病病株。置采样箱中保湿,并及时带回实验室备用。同时,在周围5 m范围内无霜霉病株地点采集健康乌头植株。
1.2 试剂 拿大树胶(BDH Chemicals Ltd.);番红(上海化学试剂有限公司);固绿(上海标本模型厂);石蜡(成都雅荣生化设备部);麝香草酚(成都化学试剂厂);无水乙醇、二甲苯、甲醛、冰醋酸和丙三醇均购自成都市科龙化工试剂厂。
1.3 仪器 DM2000型光学显微镜、DFC-495科研数码摄像头(德国LEICA公司);JSM-6390LV电子扫描电镜(日本电子株式会社);PCD-E3000恒温鼓风干燥箱(上海琅轩实验设备有限公司);HM335E型切片机;AP280-123型包埋机(德国MICROM公司)。
2 方法
2.1 不同种源地乌头霜霉病发病情况 在实验田里,采取高垄种植,划分4块样地,每块样地种植不同种源地乌头种苗。待幼苗出土后,观察并记录霜霉病发病情况。
2.2 乌头患病组织石蜡切片显微观察 将2015年浸泡的种根、感染霜霉病的叶、茎进行石蜡切片,置于光学显微镜下观察不同组织中病原菌的形态特征,并拍照。
① 固定:将患病组织修剪成合适大小块状(0.5 cm×0.5 cm),放入FAA固定液中固定 48 h。
② 脱水:将固定后的材料用蒸馏水冲洗,然后依次转移至浓度为50%、75%、85%、95%的乙醇溶液中分别脱水1 h,最后转移至无水乙醇脱水1 h。
③ 透明:将材料依次转移至25%二甲苯+75%无水乙醇溶液、50%二甲苯+50%无水乙醇溶液、75%二甲苯+25%无水乙醇溶液、纯二甲苯中各透明30 min。最后再转移至纯二甲苯透明15 min。
④ 浸蜡:将材料依次转移至提前加热熔融的75%二甲苯+25%石蜡、50%二甲苯+50%石蜡、25%二甲苯+75%石蜡中各2 h,最后转移至纯蜡在63 ℃烘箱中保温过夜,第二天转移至纯蜡中再浸蜡3 h。
⑤ 包埋:提前将包埋用的正方形塑料盒和夹取用的镊子放在恒温箱中预热。将材料从纯蜡中迅速取出并放在塑料盒中央,倒入纯蜡。提前打开冷却台开关,迅速将塑料盒平稳移至冷却台,30 min后关闭冷却台,将蜡块倒出,选取叶片所在部位将其切成正方形小蜡块,将小蜡块用加热的刀片热熔后粘贴在小木块上。
⑥ 切片:將粘贴着蜡块的小木块安装在切片机的夹物台上;调整好石蜡块与刀片之间的角度与位置(刀片与石蜡切片约15°左右);调整厚度调节器,使材料的切片厚度为10 μm;在适宜摇转速度(通常为40~60 r/min)下将蜡块切成连续的蜡带,当蜡带达到程鹏飞 20 cm时,用毛笔轻轻地将蜡带挑起,轻轻平放在干燥纸上,光滑的切面朝下,将蜡带切成小段。
⑦ 粘片:在洗净后干燥的载玻片(无水乙醇浸泡然后用蒸馏水冲洗将其擦干)上滴一小滴蛋白粘贴剂,涂匀后,再滴加两滴蒸馏水;将蜡带光滑平整的一面贴于载玻片的中央;然后将制作好的片子放在42 ℃恒温烘箱中烘干约 4 h。
⑧ 脱蜡:将装有纯二甲苯的玻璃瓶放在约40°热水中加热,然后将载玻片放入纯二甲苯中脱蜡两次,每次15 min。
⑨ 复水染色:将脱蜡后的载玻片依次转移至75%二甲苯+25%无水乙醇溶液、50%二甲苯+50%无水乙醇溶液、25%二甲苯+75%无水乙醇溶液、无水乙醇、95%乙醇、85%乙醇、75%乙醇、50%乙醇中每级3 min,然后置于番红中染色30 min;依次转移至50%、75%、85%、95%乙醇中各2 min,然后置于固绿中染色15 s;转移至95%乙醇中 2 min;再次转移至100%乙醇中 2 min,两次;然后依次转移至75%无水乙醇+25%二甲苯溶液、50%无水乙醇+50%二甲苯溶液、25%无水乙醇+75%二甲苯溶液中各2 min,最后移至纯二甲苯中2min,两次。
⑩ 封片:在平台上放一张干净的吸水滤纸,从二甲苯中取出染色完成的载玻片放在纸上;迅速在切片的中央偏左的位置滴加2~3滴树胶,封片过程中注意盖玻片的放置,避免产生气泡。待整张片子做好后,转移至42 ℃恒温烘箱中烘干。
2.3 患病组织超微形态观察 取患不同等级霜霉病的叶片,用无菌剪刀将各组叶片剪成小块(约5 mm×5 mm),将样品用导电双面胶粘在样品台上,用扫描电子显微镜观察(倍数为×85~×1500,加速电压为30 kV)病原菌在叶片上的生长状态、萌发方式以及不同患病等级叶片的差异。
3 结果与分析
3.1 不同种源乌头霜霉病发病情况 对实验田中种植的乌头进行霜霉病病害调查,发现不同种源地乌头幼苗霜霉病发病情况不同。4块实验田中,青川县房石镇和大坝乡乌头种苗试验地中观察到发病植株(图1,A、B),房石镇种源地乌头幼苗霜霉病发病率较高,达到40%。其他实验田中均未发现患病植株(图1,C)。采集病叶,用无菌解剖针挑取少许病叶背面上的菌丝,用水做浮载剂进行常规装片,对病叶上菌丝进行镜检,发现病原菌孢囊梗(图1,D、F)、孢子囊形态大小(图1,E)与课题组前期研究结果一致。因种植过程中,管理条件均一致,而霜霉病发病情况不同,说明乌头霜霉病的发病可能与种源有联系。霜霉病原菌可能存在于乌头种苗或者根际土壤中,其卵孢子在组织或土壤中越冬后,到来年春天萌发,侵染乌头幼苗。不同种源地的乌头种苗或根际土壤所携带的病原菌数量不同,所以导致不同种源地幼苗的发病率不一致。
3.2 组织切片观察 通过对不同种源地种根、病叶、茎进行石蜡切片观察,在患病乌头茎(图2)、叶(图3)中均发现了卵孢子。其中在青川大坝乡的种根中发现了卵孢子(图4),其余种根中未能发现。卵孢子呈卵圆形、椭圆形、不定形等形状,直径平均为(26±2)μm。卵孢子外壁较厚,且内部含有丰富的内含物。卵孢子主要存在于组织细胞间隙(图2,B),未见卵孢子进入细胞内。余永年等[1]报道的乌头霜霉卵孢子直径为22.4~37.8 μm,平均值大小(28.76±2.96 )μm,较本文中观察到的稍大,但本文观察到的卵孢子直径在报道范围之内,结果基本一致。
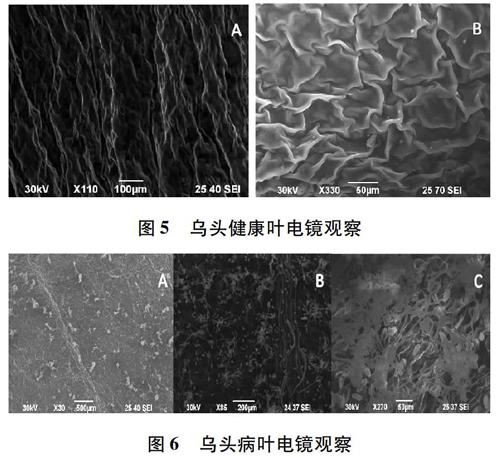
3.3 病原菌超微形态观察 取不同生长阶段的乌头叶片进行电子扫描显微镜观察,结果表明,不同生长期叶片上的气孔和病原菌孢囊梗、孢子囊等在数量和形态表现上不同。在健康的叶片上,叶背面(图5,A)和叶正面(图5,B)各结构均正常,保卫细胞正常发育,气孔和叶表皮细胞上未见病原菌孢囊梗、孢子囊或孢子等。霜霉病发病较轻的乌头叶上,在病叶背面能够观察到少量的孢子囊,部分气孔中萌发出了孢囊梗,成熟的孢囊梗分支末端上生有孢子囊(图6,A)。在发病严重的叶被上,能够观察到大量散落在叶背上的孢子囊以及从气孔中萌发的孢囊梗(图6,B),大量的孢子囊和孢囊梗交错在一起覆盖在叶背上(图6,C),即形成肉眼观察下的霜霉菌灰色霉层。
3.4 病原菌侵染过程 乌头霜霉病主要为叶类病害,在叶上的感染与定殖是一个复杂的过程。本文通过电子显微镜观察乌头病叶叶背上的病原菌形态特征,以及病原菌如何在寄主上生长。在乌头叶背面的气孔中观察到了卵孢子萌发出的孢囊梗(图7,A),病原菌会从寄主中吸取营养,使得孢囊梗不断的生长,有时一个气孔中会伸出多条孢囊梗(图7,B),当孢囊梗生长到一定的阶段,开始进行二叉分支(图7,C),发育成熟后在分支顶端产生孢子囊(图7,D),当孢子囊成熟后就会脱离孢囊梗,形成游动孢子囊(图7,E)。孢子囊成熟脱落后,受到风、雨水等的影响,在适宜的条件下,孢子囊开始萌发出芽管,芽管会从气孔或者叶片伤口等空隙中侵入叶内(图7,F)。
4 讨论
乌头霜霉病传播方式复杂,且在国内外研究较少,其病原菌是霜霉科霜霉属乌头霜霉(Peronospora aconiti Yu),它的繁殖速度较快,对寄主的影响较大。病原菌的繁殖主要包括有性和无性繁殖两种方式。有性阶段主要是通过产生雄器和藏卵器来完成。本实验文通过对病叶、病茎进行石蜡切片,观察到了病原菌的卵孢子。卵孢子主要存在于细胞间隙之中,多呈球形,外壁较厚,含有丰富的内含物和卵周质,丰富的卵周质可以为卵孢子的萌发提供营养。本实验中只观察到了受精后的卵孢子,还缺乏对雄器和藏卵器结合方式的研究。无性繁殖主要靠产生孢子囊来进行。本实验通过电子显微镜对乌头霜霉病叶进行观察,发现孢子囊以萌发芽管而不是产生游动孢子的形式进行繁殖,这不同于一些其他霜霉科病原菌[12-13]。孢囊梗从气孔中伸出,主干生长到一定阶段便开始进行二叉式多次分支,直到孢囊梗成熟便不再生长,这不同于腐霉科孢囊梗的无限生长[12]。孢子囊生长于成熟孢囊梗分支的顶端,成熟后从孢囊梗上脱落,借着风力、雨水等传播,在适宜的条件下萌发出芽管循环侵害寄主叶片。
在对乌头病叶正面和背面比对后发现,孢子囊和孢囊梗基本只产生于叶背,叶正面基本观察不到,其原因可能是叶背上气孔较多,而病原菌主要是以通过气孔等孔隙侵入寄主进行循环传播侵害。对采集的不同种源地乌头种苗石蜡切片显微观察发现,在乌头根中未发现卵孢子,且根组织结构正常,说明乌头种根中未携带病原菌。对于实验田中房石镇、大坝乡种源乌头幼苗发病率较高的情况,初步认为可能是由于采集种根时根际土中带有病原菌卵孢子,卵孢子在土壤中越冬后,春天温度适宜时开始萌发侵染乌头[14]。
据调查,乌头霜霉病病原菌在15~20 ℃时迅速生长繁殖,在此温度下霜霉病传播较快[15]。并且,孢子囊的产生与萌发都需要一定的湿度条件[16],因此,春天是烏头霜霉病发生与流行的最佳时期。在此阶段,田间管理应该注意及时排水,防止霜霉病的传播。在收集种根时及时检测根际土中的病原菌卵孢子也是有效降低乌头患病率的一个重要途径。
综上,本实验明确了乌头霜霉病发病与种苗是否带菌有关,其传播可能是乌头霜霉卵孢子在种苗内越冬,春天萌发侵染乌头,为乌头霜霉病的防治技术提供了理论基础。
参考文献
[1]国家药典委员会.中华人民共和国药典(2015年版一部)[S].北京:中国医药科技出版社,2015.
[2]唐莉,梁丽娟,叶华智,等.附子常见病害的调查研究[J].现代中药研究与实践,2004,18(6):29-32.
[3]余永年.霜霉一新种[J].植物病理学报,1979,9(2):127-130.
[4]熊艳,王鹤冰,向华丰, 等.黄瓜霜霉病研究进展[J].中国农学通报,2016,32(1):130-135.
[5]李晓红,宋润刚,杨义明, 等.山葡萄霜霉病的研究现状及防治对策[J].北方园艺,2010(13):189-192.
[6]毕秋艳,韩秀英,马志强,等.枯草芽胞杆菌HMB-20428与化学杀菌剂互作对葡萄霜霉病菌抑制作用和替代部分化学药剂减量用药应用[J].植物保护学报,2018,45(6):1396-1404.
[7]王贻莲,李纪顺,王英姿, 等.芽孢杆菌BCJB01和BMJBN02对葡萄霜霉病的田间防效[J].北方园艺,2017,(17):67-71.
[8]欧洪,李娜,王光志.乌头霜霉病病原菌形态学研究[J].甘肃中医药大学学报,2016(2):59-63.
[9]胡亮,王婷,李娜,等. 乌头霜霉病病原物分子检测方法的建立[J].中国实验方剂学杂志,2018(8):65-69.
[10]方中达.植病研究方法[M].北京:中国农业出版社,2007.
[11]余永年,王燕林.乌头霜霉卵孢子的发现[J].真菌学报,1984,3(4):189-191.
[12]Voglmayr,H. Phylogenetic relationships of Peronospora and related genera based on nuclear ribosomal ITS sequences [J]. Mycological Research, 2003, 107(10): 1132-1142.
[13]张相文,何丽丽,李娟,等.陕西眉县葡萄霜霉病发生规律与防治措施[J].山西果树,2016,(3):32-34.
[14]欧洪.乌头霜霉病病原物鉴定及传播机制初步研究[D]. 成都:成都中医药大学,2016.
[15]李娜,胡亮,王婷,等.乌头叶面微生物菌群变化特征及其与乌头霜霉病相关性[J]. 中国实验方剂学杂志,2017(5):42-46.
[16]张琳琳.浅谈黄瓜霜霉病发生及防治方法[C].//科技研究—2015科技产业发展与建设成就研讨会论文集,2015:84.
(收稿日期:2019-08-25 编辑:程鹏飞)

