蔗糖异构酶PalI包埋和交联固定化方法比较
王兵兵, 张永吉, 李宪臻, 李 蓉
(大连工业大学 生物工程学院,辽宁 大连 116034)
异麦芽酮糖是蔗糖的一种同分异构体,其甜度为蔗糖的52%[1],理化性质类似蔗糖[2]。异麦芽酮糖大量食用后在血液中释放单糖缓慢,有助于糖尿病的防治以及阻止脂肪的过渡积累[3-4],因此在食品工业上可以广泛替代蔗糖作为甜味剂。来自Klebsiellasp. LX3的蔗糖异构酶PalI,能够催化蔗糖生成83%的异麦芽酮糖(α-D-glucosylpyranosyl-1,6-D-fructofranose)和21%海藻酮糖(α-D-glucosylpyranosyl-1,1-D-fructofranose)[5],故可以作为一种良好的异麦芽酮糖产生酶。在异麦芽酮糖生产中,核心问题为产物的纯化分离,使用游离酶进行生产发酵会增加产物分离难度,蔗糖异构酶的固定化成为解决问题的途径之一,但是近年来却少有相关成果的报道。酶的固定化是指用理化方法将游离酶固定在相应空间区域,但仍保留其催化特性,并可回收和重复使用的一类技术[6-7]。固定化技术可提高酶的稳定性,且易于从体系中分离回收固定化酶,并可重复实验降低应用成本[8-9]。本研究拟分别采用较低成本的海藻酸钠包埋法和戊二醛交联法对蔗糖异构酶PalI进行固定化,希望通过对这两种结果的比较,探索蔗糖异构酶固定化酶的实用性和可行性。
1 实验部分
1.1 实验材料
蔗糖异构酶PalI(NCBI accession number AAK82938)来源于Klebsiellasp. LX3;大肠杆菌BL21(DE3)和pET28a,中科院大连物理化学研究所赵宗保研究员课题组;IPTG、卡那霉素、胰蛋白胨、酵母浸粉,生工生物工程(上海)有限公司;无水CaCl2、NaCl、(NH4)2SO4、 3,5-二硝基水杨酸,国药集团化学试剂公司;蔗糖、戊二醛、柠檬酸,科密欧化学试剂厂;海藻酸钠,光复精细化工研究所。以上所有试剂均为分析纯。
1.2 实验仪器
SpectraMax Paradigm型酶标仪 ,美谷分子仪器公司;JY98-IIIN型细胞破碎仪,宁波新芝生物科技公司;5804R型离心机,美国Eppendorf公司。
1.3 实验方法
1.3.1蔗糖异构酶PalI的表达
将重组菌pET28a-palI/E.coliBL21在LB卡那霉素抗性平板上复苏培养,挑取单菌落制备种子液,按照1∶100体积比接种于200 mL培养基中,37 ℃,200 r/min培养。培养至OD600为0.6~0.8时,加入终浓度为0.5 mmol/L IPTG进行诱导表达,16 ℃、200 r/min 培养18 h后离心富集菌体。通过超声破碎,提取得到重组PalI酶液。
1.3.2PalI酶活测定
游离酶50 μL或者固定化酶1 g,与2 mL、质量分数为2%的蔗糖在30 ℃、160 r/min的摇床上反应2 h,使用DNS方法测产生的还原糖,并根据还原糖量计算酶活。
蔗糖异构酶酶活定义:使用蔗糖做底物,1 min内转化生成1 μmol还原糖所需的酶量。
相对酶活定义:设定同组酶活最高的相对酶活为100%,以同组最高酶活为参照,计算出的比值为相对酶活。
1.3.3海藻酸钠、CaCl2、戊二醛浓度的确定
配置质量分数为1%~4%的海藻酸钠溶液和CaCl2溶液。将1 mL蔗糖异构酶与海藻酸钠溶液混合均匀,用注射器逐滴加入到CaCl2溶液中,固定20 min得到直径2 mm左右的微球。将固定化酶过滤,并用纯水洗3遍,装入离心管中,在所得固定化酶中加入2%的蔗糖溶液2 mL,于30 ℃,160 r/min反应2 h。使用DNS检测还原糖的浓度。
在5 mL蔗糖异构酶中,加入4.5 g (NH4)2SO4进行沉淀,然后分别与1%~4%的戊二醛在合适条件交联2 h;4 ℃离心取沉淀并清洗、干燥保存。将干燥的固定化酶与6 mL 2%蔗糖溶液混合,在30 ℃,60 r/min条件反应2 h,确定还原糖浓度。
1.3.4固定化酶的最适pH值、最适温度和操作稳定性的确定
将固定化酶分别与6 mL、pH值3~8、2%的蔗糖溶液混合,在适宜条件反应,使用DNS法测还原糖浓度;将处于最适pH值的固定化酶分别放置于30~80 ℃条件反应,确定最适温度;将固定化酶从最适反应体系中过滤出并用纯水清洗,反复进行11次操作;4 ℃保存20 d,每天测定剩余酶活。
2 结果与讨论
2.1 PalI的表达与活性检测结果
分别对pET28a-palI/E.coliBL21重组菌株及对照组pET28a/E.coliBL21菌株进行表达,结果见图1。图1(a)中,在60 kDa附近有一条明显差异蛋白条带,与理论PalI蛋白大小值相同。图1(b)中,通过TLC分析,表达的酶液具有水解转化蔗糖成为异麦芽酮糖的蔗糖异构酶活性。

①蔗糖标准品 ②异麦芽酮糖标准品 ③蔗糖反应混合物图1 蔗糖异构酶的表达与活性分析Fig.1 Expression and activity analysis of sucrose isomerase
2.2 固定化条件的优化
2.2.1海藻酸钠浓度对固定化酶活性的影响
海藻酸钠浓度对固定化酶活性影响实验结果见图2。海藻酸钠质量分数小于1.5%,蔗糖异构酶酶活随海藻酸钠浓度的升高而升高;大于1.5%,酶活随海藻酸钠浓度增大反而呈下降趋势。原因可能是海藻酸钠质量分数小于1.5%,随其浓度升高,包埋体网孔逐渐变密,能缚住更多的酶蛋白;另外,网孔大有利于酶蛋白与底物结合。随着海藻酸钠质量分数超过1.5%,可能使得网孔致密,阻碍酶蛋白与底物结合,使底物转化能力下降[10]。
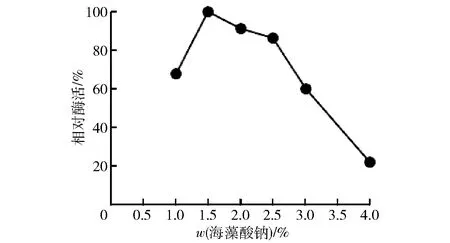
图2 海藻酸钠质量分数对固定化酶活性影响Fig.2 Effect of sodium alginate concentrations on activity of immobilized enzyme
2.2.2CaCl2浓度对固定化酶活性的影响
CaCl2浓度对固定化酶活性影响实验结果见图3。由图3可知,在CaCl2质量分数为0.5%~2.0%,随其浓度上升,酶活逐渐升高;而当CaCl2质量分数超过2.0%时,随其浓度升高,酶活逐渐降低。原因可能为CaCl2主要影响的是交联程度,Ca2+浓度低时,使得网孔大易与底物接触;而当Ca2+浓度高时,其网格结构致密,使得底物与酶接触难度增大[11-12]。

图3 CaCl2质量分数对固定化酶活性影响Fig.3 Effect of CaCl2 concentrations on activity of immobilized enzyme
2.2.3戊二醛浓度对固定化酶活性的影响
戊二醛为双功能基团交联剂,可通过与蛋白质中氨基的作用发生交联反应,实验结果见图4。图4中,戊二醛最适体积分数为2.5%,原因可能是在低戊二醛浓度时,随着戊二醛浓度的增加,交联体中蛋白酶的数量也会增加,从而使得固定化酶的活性增高;当戊二醛浓度过大时,戊二醛易发生自联反应,或者与酶蛋白上的氨基交联过多,从而令酶活下降,且聚集体过密阻碍了酶与底物的接触[13-14]。
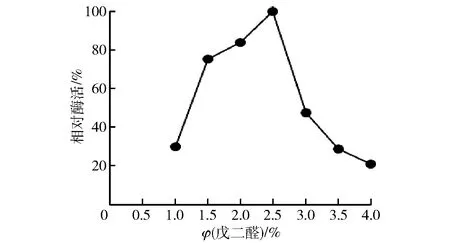
图4 戊二醛体积分数对固定化酶活性的影响Fig.4 Effect of flutaraldehyde concentrations on activity of immobilized enzyme
2.3 固定化酶学性质及稳定性分析
2.3.1pH值对固定化酶活性的影响
将固定化酶和游离酶分别置于pH值3~8柠檬酸- 磷酸氢二钠缓冲溶液中反应2 h。通过测定还原糖的产生量来确定酶活的变化,实验结果见图5。由图5可知,海藻酸钠包埋法获得固定化酶最适pH值为6.0,戊二醛交联法获得的固定化酶最适pH值为5.0,游离酶的最适pH值为5.0~6.0。由此可以看出,海藻酸钠固定化酶的最适pH值高于游离酶,而戊二醛固定化酶的最适pH值低于游离酶。这种现象可能是由于海藻酸钠和戊二醛两种材料各自的性质决定的。如果采用戊二醛和海藻酸钠双固定的方法对蔗糖异构酶进行固定化,则可能得到具有更宽pH值范围的海藻酸钠/戊二醛固定化酶。
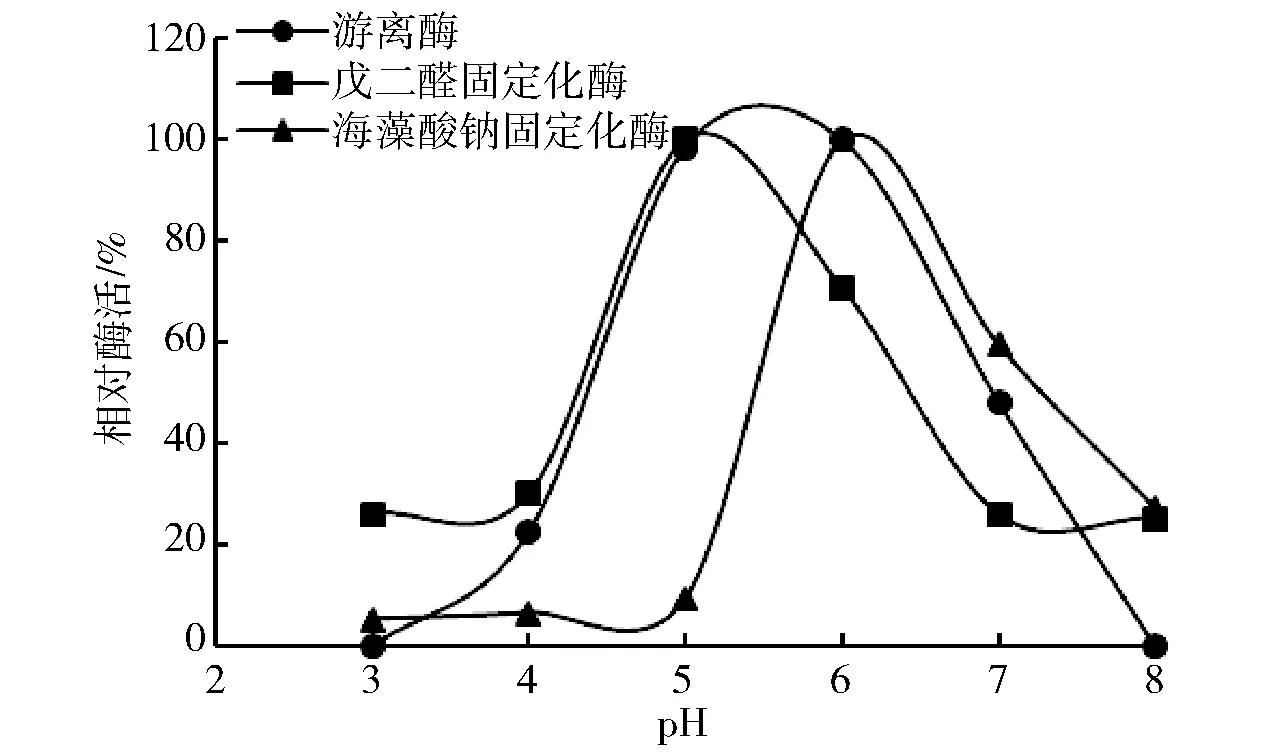
图5 pH值对酶活性的影响Fig.5 Effect of pH on activity of free enzyme and immobilized enzyme
2.3.2温度对固定化酶活性的影响
在固定化酶和游离酶最适反应条件下,将其分别置于20~80 ℃,反应2 h后测定还原糖产量,实验结果见图6。由图6可知,海藻酸钠固定化酶的最适温度在30 ℃,戊二醛交联酶的最适温度在50 ℃,但都与游离酶的最适反应温度70 ℃相比存在差距。主要原因可能是固定化酶所固定的酶量不及同体积条件下的游离酶多,故在高温条件下,由于半衰期问题使得固定化酶的反应性大大降低[15]。
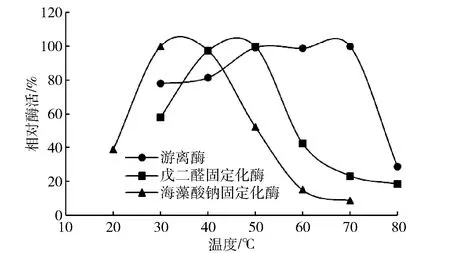
图6 温度与固定化酶活性的关系Fig.6 Effect of temperature on activity of immobilized enzyme
2.3.3固定化酶的稳定性分析
与游离酶相比,固定化酶可以重复多次使用,因此循环使用次数和储存稳定性也作为固定化酶实用性强弱的指标,实验结果见图7。由图7可知,海藻酸钠包埋酶使用4次,酶活性降到20%左右,戊二醛交联酶的使用次数高达12次,其残余酶活仍为80%。随着使用次数的增加,固定化酶的相对酶活均逐渐下降,这主要是固定化酶在机械损伤下导致酶分子泄漏所致[16],实验结果见图8。图8中,在20 d内固定化酶的剩余酶活接近80%,而游离酶的酶活已经低于30%。由此可见,固定化酶能显著提高蔗糖异构酶的利用率,降低酶的生产成本。
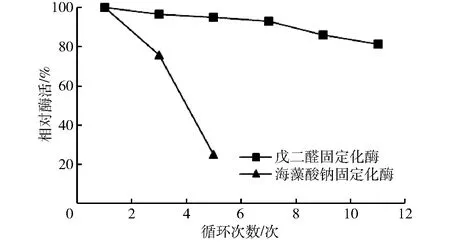
图7 固定化酶循环使用次数与酶活性的关系Fig.7 Relationship between recycle numbers and enzyme activity of immobilized enzyme

图8 固定化酶储存时间与酶活性的关系Fig.8 Relationship between storage stability and enzyme activity of immobilized enzyme
3 结 论
分别以海藻酸钠和戊二醛两种化合物作为单一载体,对蔗糖异构酶进行固定化。实验分析得出:海藻酸钠包埋蔗糖异构酶PalI时,最适质量分数为1.5%,CaCl2最适质量分数为2%;戊二醛交联固定蔗糖异构酶PalI时,戊二醛最适体积分数为2.5%。海藻酸钠固定化酶4 ℃保存20 d,酶活力保持在60%左右,戊二醛交联酶活性在95%以上,而游离酶活性仅为30%左右。实验结果表明,戊二醛交联酶的循环利用次数和储存稳定性明显优于海藻酸钠包埋酶,且与游离酶相比更稳定,固定化的蔗糖异构酶在生产实际中实用性更强。

