转hpalXoo基因棉花在棉花炭疽病侵染下的过敏性反应检测及相关抗性基因表达研究
刘文波,何其光,蔡加挺,靳鹏飞,林春花,邬国良,缪卫国
(海南省热带生物资源可持续利用重点实验室/海南大学热带农林学院,海南 海口 570228)
【研究意义】棉花炭疽病是由棉刺盘孢菌(ColletotrichumgossypiiSoutllw.)引起的一种世界性的真菌病害。在低温,多雨潮湿的环境下,幼苗的发病率可以高达47.08 %[1]。在棉花中后期可引起叶片脱落,导致产量及品质下降。选育和推广抗病品种是防治棉花炭疽病的最有效,最经济的途径。【前人研究进展】Hapin蛋白是由hrp基因编码并通过Ⅲ型分泌通道泌出的,在非寄主植物上激发过敏性反应,并能够诱导植物获得系统抗性的一类蛋白激发子[2]。Harpin蛋白首次从梨火疫病菌(Erwiniaamylovora) 中分离。Hapin蛋白具有丰富的有益生物活性,可以通过不同的信号通路诱导多种植物抗病、抗虫和抗旱,还能促进植物生长[2-3]。国内外已有用编码Harpin的hrp基因转入到烟草[4-7]、马铃薯[8]、苹果[9]、梨[10]、甜菜[4]、小麦[11]、水稻[12-13]和棉花[14]等植物进行转基因研究,获得的转基因植株对Ralstoniasolanacearum、Alternariaalternata、E.amylovora、Phytophthorainfestans、Botrytiscinerea、Fusariumoxysporum、F.graminearum、Xanthomonasoryzaepv.oryzae、Magnaporthegrisea、Verticilliumdahliae和烟草花叶病毒TMV等多种病原菌产生了较好的抗性,并促进了植物相关防卫基因的表达,但他们的防卫基因表达不尽相同[7,15-16]。研究表明,Harpin蛋白能激活植物中水杨酸(salicylic acid,SA)介导的途径,使植物获得系统抗性,从而增强植物对病原菌的抗性[17]。此外,Harpin蛋白还能诱导植物信号传导链中的信号分子,引起植物的防卫反应[18];在转hpa1Xoo基因的棉花中,接种黄萎病菌24 h后叶片组织中有活性氧显著积累,PAL(苯丙氨酸解氨酶)和POD(过氧化物酶)活性显著增强[19];Harpin蛋白喷施烟草叶片后,PAL、POD和PPO(多酚氧化酶)活性都有不同程度的增强[20],可以激发烟草过敏性细胞坏死(hypersensitive cell death, HCD)[21],还能增强植物的基本防卫功能[22]。转hpalXoo基因棉花能够增强棉花对多种病害的抗性[19,23],但没有抗棉花炭疽病的相关报道。近年来由于转基因技术的发展,已经赋予不同种类植物新的农艺性状,使植物在抗病性和品质等方面得到了改善。直到2009年大约有100种外源基因转入棉花中[16],但至今仍未见有转hrp基因棉花抗棉花炭疽病的报道。【本研究切入点】本文通过比较转hpalxoo基因棉花与普通棉花对棉花炭疽病的抗性进行评价,探索转hpalxoo基因棉花的应用潜力。【拟解决的关键问题】为培育抗炭疽病棉花材料提供可能。
1 材料与方法
1.1 供试材料
陆地棉品系854,转hpalXoo基因棉花的遗传稳定后代株系(出发品种是陆地棉品系854),棉花炭疽病菌(HNNC8),均由海南大学环境与植物保护学院分子植病实验室提供。
试剂: 过氧化氢测试盒(南京建成生物工程研究所)、DAB显色试剂盒(南京建成生物工程研究所)、0.01 mol/LPBS缓冲液pH 7.2~7.4 (Solarbio)、96 % 乙醇、愈创木芬、30 % H2O2、0.2 mol/L磷酸二氢钾溶液、β-巯基乙醇、聚乙烯吡咯烷酮(PVP)、0.02 mol/L苯丙氨酸溶液(3.3 g·L-Phe溶于1000 mL 0.1 mol/L硼酸缓冲液中)、0.1 mol/L pH 6.0硼酸缓冲液(pH 8.8,含0.39 g/L巯基乙醇)、RNAprep Pure Plant Kit(TIANGN)、SYBR®Premix ExTaqTM ‖(TliRNaseH Plus)(TaKaRa)、反转录试剂盒(Themo)、DL2000 DNA Marker(TaKaRa)、2×EcoTaqPCR SuperMix(TRANS)、H2O3Dry Bath(Coyote Bioscience Company)。
1.2 试验方法
1.2.1 孢子悬浮液的制备 将棉花炭疽病菌接种于装有150 mL PBD液体培养基的250 mL三角瓶中,以28 ℃、200 r/min培养5 d,然后双层无菌纱布过滤,接种时孢子悬浮浓度为1.0×107个/mL。
1.2.2 接种方法 为防止自然病原的侵染,实验在隔离的恒温恒湿的培养室内进行,并对将要接种植株的新梢,在抽芽时进行套袋隔离。用注射器针头轻刺棉花叶片(分别在正面主叶脉两侧,圆形面积约0.5 cm2的地方针刺15~20个点,尽量不要将叶片刺穿)[24],将分生孢子悬浮液均匀喷洒在叶片的正反两侧,0、12、24、48、72 h,5个时间点各取2片转基因棉花叶片,一株共取10片,以陆地棉品系854为对照,实验重复3次。
1.2.3 棉花体内H2O2含量测定 分别选择接种棉花炭疽菌后0、12、24、48、72 h转hpalXoo基因棉花和对照棉花的叶片,用直径为1.0 cm的打孔器把每个处理分别打3张叶片,每个叶片分别打取1.0 cm3个小圆片。使用H2O2测定试剂盒(南京建成)定量测定H2O2的含量。将上述处理过的转hpalXoo基因棉花叶片和对照棉花叶片,分别加入1 mL PBS缓冲液(pH 7.3),研碎成汁,5000 r/min离心5 min,取上清液,测定H2O2与钼酸络合物在405 nm处的OD值。主要参数如表1所示。
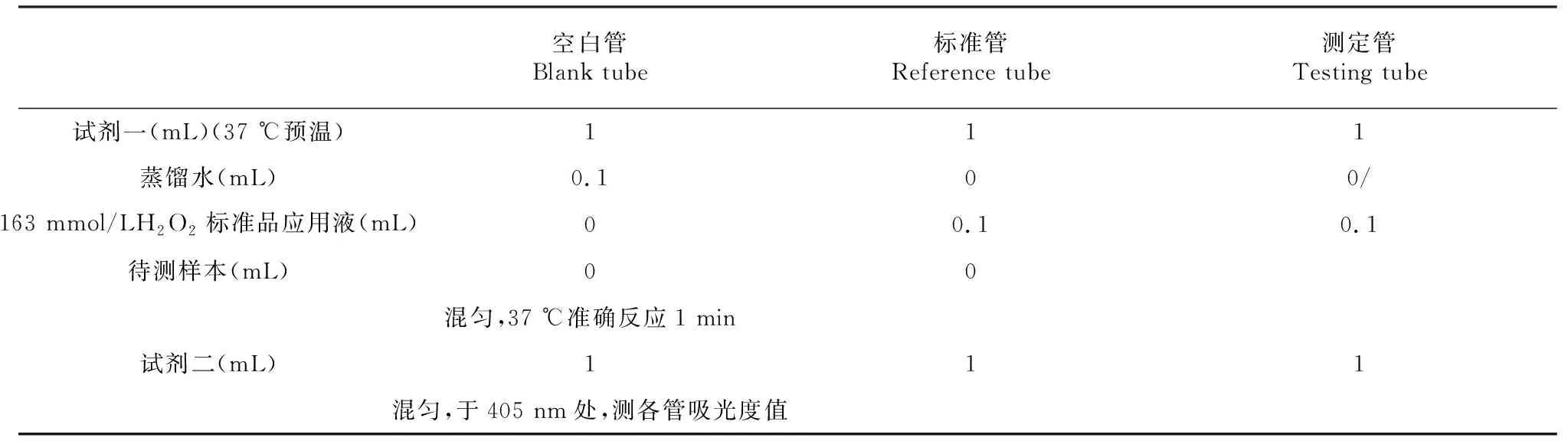
表1 棉花叶片组织内H2O2含量测定主要实验参数

1.2.4 叶片H2O2的定位检测 小心用直径为1.0 cm的打孔器分别在每个处理时段打取3张棉花叶片,每个叶片打取3个1.0 cm的小圆片,放入3,3-二氨基联苯胺(diaminobenzine,DAB)染液中(试剂A︰试剂B=1︰19),25 ℃光下染色8 h;除去染色液后,加入96 %乙醇脱色至叶片由绿变半透明;水悬浮,镜检,拍照。
1.2.5 POD(过氧化物酶)活性测定 供试植株接种后第0、12、24、48、72小时分别提取喷菌的棉花叶片0.2 g,放入研钵中,加入适当液氮粉碎后加入1 mL pH 5.5的0.05 mol/L的PBS缓冲液混匀,转至离心管中,3000 r/min离心10 min,上清液即为酶粗提液;在50 mL 100 mmol/L 的PBS缓冲液中加入28 μl愈创木芬,溶解冷却后加入19 mL 30 % H2O2作为POD反应液;取0.5 mL酶粗提液,2 mL POD反应液与1 mL 0.2 mol/L 磷酸二氢钾反应,每隔1 min测其A470,以ΔA470/Δt=0.01 min-1表示一个酶活力单位(U)[19]。
1.2.6 PAL(苯丙氨酸解氨酶)活性测定 供试植株接种后第0、12、24、48、72小时分别提取涂菌的棉花叶片0.2 g,加含5 mmol/L的巯基乙醇硼酸缓冲液,0.05 g聚乙烯吡咯烷酮(PVP),冰浴研磨,4℃,10 000 r/min离心15 min,上清液即为酶粗提液;加1 mL 0.02 mol/L苯丙氨酸,2 mL蒸馏水,总体积为4 mL,对照加1 mL蒸馏水,置30 ℃恒温水浴锅30 min,290 nm处测OD值,以每小时在290 nm处吸光度变化的0.01所需酶量为1单位[25]。
1.2.7 RNA的提取、反转录以及qRT-PCR检测 ①RNA的提取。选用RNAprep Pure植物总RNA提取试剂盒(TIANGEN)试验操作方法,提取供试的2种棉花样品的总RNA。②反转录。以提取到的RNA为模板,采用TaKaRaPrimeScriptTMRT reagent Kit with g DNA Eraser (Perfect Real Time)试剂盒提供的方法合成cDNA。③防卫相关基因的检测。用不同处理的棉花叶片cDNA为模板,进行实时定量PCR。以陆地棉品系854叶片cDNA作为阳性对照,选取在真核生物中高度保守且为组成性表达的基因EF-1α为内参基因,检测基因分别有PR-1b、hsr203J、NPR-1。所用引物及其检测参数见表2。

表2 检测引物序列及参数
注:按照Applied Biosystems 7500 Real Time PCR System的操作方法进行试验。
Notes: Test according to the operating method of Applied Biosystems 7500 Real Time PCR System.
1.3 数据处理
数据分析均采用 SAS (9.1)软件和 Excel(2010)软件进行处理。
2 结果与分析
2.1 接种棉花炭疽病菌后转基因棉花产生H2O2的变化
为了更好探讨活性氧在细胞内引起的非特异性反应,观察接菌后0~72 h内5个时间点转hpalXoo基因棉花及出发品种棉花叶组织中H2O2含量变化。由图1可见,出发品种棉花只有在24 h时略微有上升,且整体涨幅较小,随后H2O2的含量又下降到初始水平;转hpalXoo基因棉花在12 h内H2O2的含量略微下降,但在48 h时H2O2显著增加,达到5个测定时间点的峰值,随后在72 h时H2O2的含量下降到初始水平。但出发品种棉花叶片在24 h达到峰值,总体的H2O2积累低于转基因品种,表明转hpalXoo基因棉花叶组织的H2O2积累水平超过了出发品种。
2.2 H2O2显微定位检测
氧化二氨基联苯胺(DAB)能与H2O2结合形成红褐色沉淀,可定位H2O2酶活性的位置。植物体内的氧爆发是植物受外源物质刺激引起的最早事件之一,其特点就是植物体内H2O2的积累。为检测转hpalXoo基因棉花受棉花炭疽的侵染是否伴有H2O2信号分子的积累,选择DAB染色法进行H2O2显微定位检测。分别在接菌后0、12、 24、48、72 h 5个时段用显微观察转基因棉花和非转基因棉花品种陆地棉品系854,发现经DAB染液染色后的棉花叶片组织均有不同程度的褐色沉淀存在(图2)。同时,发现在转hpalXoo棉花叶片上H2O2在0、12、24、48 h有逐渐增长的趋势;24、48、72 h这3个时间点的红褐色沉淀比之前两个时间点明显增多;但在48 h达到峰值,在72 h又有下降的趋势。普通棉花品种陆地棉品系854则没有这种明显的变化趋势。此外,接菌到72 h时转hpalXoo基因棉花和出发品种棉花叶片里DAB染色程度相当,但其它时间点均多于普通棉花。这说明转hpalXoo基因棉花在接菌后逐渐积累更多的H2O2,在48 h左右产生量达到峰值,从而对棉花炭疽菌的抗性最强。与显微观察到的结果相吻合。
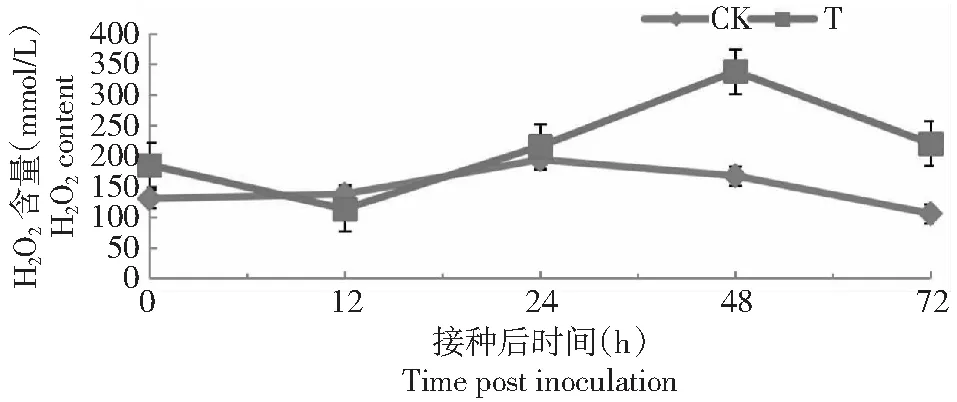
图1 接种棉花炭疽病菌后转hpalXoo基因棉花和陆地棉品系854叶组织中H2O2含量的变化(n=4, x±SD)Fig.1 H2O2 content of transgenic hpalXoo cotton and Simian 3 leaves inoculated via pin-puncturing method with C.gossypii Soutthw.
2.3 相关酶活性检测
本实验在测定0、12、 24、48、72 h内5个时间点棉花叶片中过氧化氢的含量及其位置的同时,也测定了转hpalXoo基因棉花和出发品种棉花叶片中POD和PAL 2种酶的活性。

A、B、C、D、E分别是CK:0、12、24、48、72 h; F、G、H、I、J分别是T: 0、12、24、48、72 h图2 接种棉花炭疽菌后转hpalXoo基因棉花(T)和陆地棉品系854(CK)叶组织中H2O2检测Fig.2 Detection of H2O2 in transgenic hpalXoo cotton and Gossypium hirsutum leaves inoculated with C. gossypii Soutthw

图3 接种棉花炭疽病菌后转基因棉花和陆地棉品系854叶组织中POD(A)和PAL(B)活性的动态变化Fig.3 POD(A) and PAL(B) activities of the transgenic hpalXoo cotton and Simian 3 leaf tissues inoculated by C.gossypii Soutthw
植物细胞内存在的POD可以催化分解H2O2生成H2O和O2,并可使脂肪酸、芳香胺和酚类等化合物氧化。之前有外文文献报道POD酶活性升高是植物抗病性的一种表现形式[26]。转基因棉花品系在棉花炭疽菌侵染后叶片内的POD酶活性在12 h出现一个峰,随后又下降,但在72 h又有一个峰值,而且这个峰比前面12 h的峰更高;普通棉花叶片的POD活性升高非常缓慢[图3(A)]。这就说明了转基因棉花比出发品系的棉花对棉花炭疽菌有更快的应答反应。
POD和PAL活性增加是局部和系统抗病性的重要组成部分,而PAL是植物中苯丙烷代谢途径的关键性限速酶,在植物的抗病反应中起着非常重要的作用[27]。苯丙氨酸类代谢是形成多种具有抗菌作用的产物之一,比如酚类、木质素等化合物,它们催化苯丙氨酸类的脱氨反应,释放出NH3,形成反式肉桂酸[25]。转基因品系在接种炭疽菌后PAL活性有较大的升高。在病原菌侵染后,转基因棉花中在12 h虽低于出发品种,但差异不显著,到接菌后24 h,转基因棉花和普通棉花品系叶组织中PAL活性都上升,其中出发品种棉花达到5个测量时间点的最高点,但转基因品系在48 h才达到最高点,此时酶活性最高,而且转基因棉花叶组织中PAL活性高于出发品种[图3(B)]。
2.4 防卫相关hsr203J、NPR1和PR-1b基因的时序性表达
EF-1α作为内参基因,比较不同时间点过敏性反应(hypersensitive response,HR)的标志基因hsr203J,防卫反应标志基因NPR1、PR-1b的表达情况(图4)。
HR标志基因hsr203J的表达情况:在0 h,病原菌还没有侵入植物组织细胞,转hpalXoo基因棉花在0 h表达比普通棉花低,但在12 h表达量明显提高,和普通品种的表达量相当,并且在24 h表达高于普通棉,这说明在这一时间段,由于病原菌的侵染激发了植物细胞的过敏坏死反应。到48 h,植物细胞的防卫反应使病原菌数量下降,所需的HR程度降低,所以转基因棉的表达又与普通棉持平,直至到72 h转基因棉几乎没有表达(图4 A)。
防卫反应基因NPR1的表达:在0 h时,NPR1基因在转基因棉花的表达很微弱,远远低于该基因在出发品系的表达,在0~48 h时,该基因在转基因植株的表达一直低于在出发棉花的表达,在48 h的表达量虽仍低于普通植株,但相对于24 h,增加较快,直至72 h时,该基因在转基因品系的表达与在陆地棉品系854里的表达相同(图4 B)。
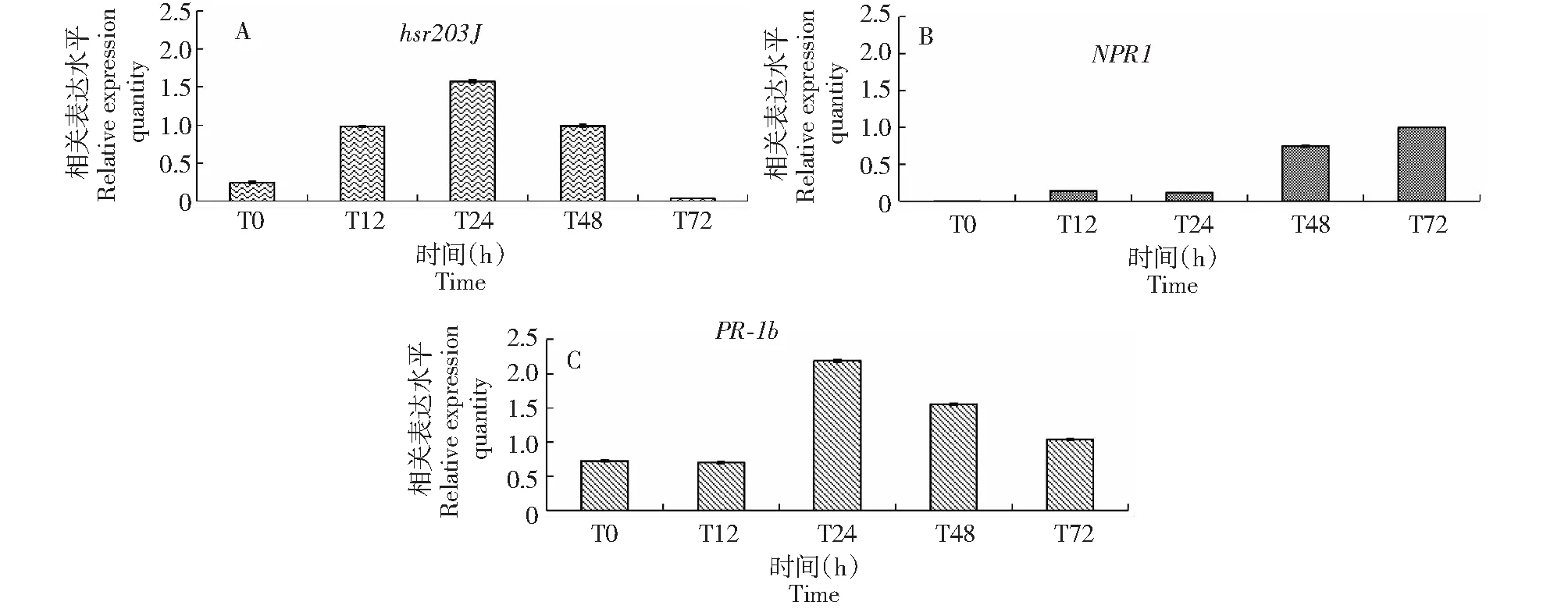
图4 防卫基因qPCR检测结果Fig.4 Quantitative real-time PCR of the relevant genes expression
防卫反应基因PR-1b的表达:病原菌前期刚侵染0~12 h时,转基因棉花就有表达,但相对较弱,而在24~48 h时,侵染量较多强度较强所以PR-1b基因表达量处于较高水平,48~72 h开始减弱,72 h时转基因棉花的表达类似于普通棉花的表达,表达水平较低(图4 C)。
3 讨 论
氧爆发是植物抗病的重要表现,而氧爆发主要表现是H2O2等ROS(reactive oxygen species)的突增[28]。转hpalXoo基因棉花在对棉花黄萎病和棉花枯萎病的抗性研究中发现H2O2的积累量在前面几个小时内先出现一个较小的峰,下降后又会出现一个更高的峰,即出现所谓的“双峰现象”[19]。但是在本实验中笔者只观察到H2O2含量的变化趋势呈现“单峰”,这与之前的文献记载有所不同[29-30]。一方面可能是在设计实验时所选取的各时间点间隔太大,而导致无法及时捕捉到H2O2的变化,从而导致不能观察到H2O2含量的“双峰”变化趋势;另一方面可能是棉花植株对于炭疽菌的防卫反应方式不同于棉花对枯萎病和黄萎病。H2O2的定位检测中,抗病性较强的品种比普通植株的红褐色沉淀出现时间早,而且各个时间点的沉淀量多于普通对照组[31]。在本实验中转hpalXoo基因棉花在48 h的红褐色沉淀最多且明显,对比各个时间点的转hpalXoo基因棉花和陆地棉品系854 2个材料,结果可以发现转基因棉花的红褐色沉淀多于陆地棉品系854的沉淀。但是在普通棉花陆地棉品系854却发现在12 h可以比较发现红褐色沉淀增加,而且在24 和48 h 2个时间点染色情况几乎相同。但是,测量H2O2含量及其定位检测两个实验中,捕捉到了在接种炭疽菌后H2O2在棉花植株体内的表达存在时序性变化。可以说明由于棉花炭疽菌的侵染,转hpalXoo基因棉花的HR反应比陆地棉品系854的HR产生的时间早且强度大。
面对病原菌的侵入,抗病植物会通过一系列的信号转导,诱导植物产生氧迸发(过氧化氢、氧自由基等),但是,这些活性氧的量过多,会对植物细胞造成损伤,因此要及时清除这些多余的ROS[32-33]。王金华等人在研究转GO基因番茄的抗病机制中,发现转基因番茄株系的POD活性比非转基因番茄明显增加,且转基因番茄的活性高峰出现时间早,另外,还发现转基因番茄接种后PAL活性出现2个活性高峰,但对照组的番茄只有一个出现较迟且较低的高峰[25],曹赐生等人在研究白叶枯病菌对杂交水稻苗的影响中也发现了PAL活性的类似现象[34]。本研究中,转hpalXoo基因棉花的POD也出现了2个活性高峰,并且比陆地棉品系854的POD活性高,但是在24 和48 h这2个时间点,转hpalXoo基因棉花和出发品种棉花的POD活性几乎没有差异。导致这2个时间点的特殊性,可能是由于前期病菌的侵染而引发了植物的第一轮防卫反应,病原菌被抑制,从而使得ROS含量下降继而不需要高活性的POD。另外,转hpalXoo基因棉花的PAL活性在病原菌侵入前期时反而低于陆地棉品系854叶片内的PAL活性,但是随后转hpalXoo基因棉花的PAL活性迅速增加,并且一直明显高于出发品种陆地棉品系854的PAL活性。而陆地棉品系854的PAL只有在24 h达到测量时间点的高峰,随后活性一直下降。转hpalXoo基因品系这两种酶的活性都存在着时序性变化差异,并且在病菌侵染的某一阶段酶的活性显著高于陆地棉品系854的酶的活性,这说明了在转基因棉花叶片内的ROS较多,需要更多的酶去清除而维持内环境平衡。
大丽轮枝菌(VerticilliumdahliaeKleb.)侵染转hpalXoo基因棉花,引发的氧爆发发生在HR之前[19];HR标志基因hsr203J的表达,与清除酶活性的变化是氧迸发和HR关联的进一步证据[35]。检测这些防卫基因涉及通过SA、JA(Jasmonic acid,茉莉酸),或乙烯介导的植物基础防卫途径[36]。荧光定量PCR检测了转hpalXoo烟草的植物过敏性反应标志基因hsr203J,Harpinxoo蛋白激发烟草叶片产生过敏性反应(HR),hsr203J基因上调表达[16, 37]。当棉花炭疽菌侵染转hpalXoo基因棉花时,harpinxoo在棉花体内的表达增强了棉花体内的H2O2积累水平,随即微过敏产生,hsr203J基因超表达。因此,当转hpalXoo基因棉花受到炭疽菌侵染时,赋予了转基因棉花对病原菌的抗性;我们同时检测了NPR1、PR-1b基因的表达情况,不同时段的表达量不同,但在处理24 h时,都保持了相对较高的表达量,这可能与harpinxoo激活了不同的防卫通路有关[16]。但是hsr203J、NPR1、PR-1b基因的表达在不同的侵染时段能检测出来,而且都存在着时序性表达差异,也能说明转hpalXoo基因棉花对棉花炭疽菌的抗性增强。通过对H2O2含量检测与定位,POD和PAL 2种酶活性变化检测,相关防卫基因的时序性表达等结果分析得出,转hpalXoo基因棉花对棉花炭疽菌的抗性明显增强。至此可以初步确定hpalXoo基因确实能够增强非寄主植物对炭疽病的抗性。
4 结 论
本研究通过荧光定量PCR方法,检测3个防卫相关基因hsr203J、NPR1和PR-1b在转hpalXoo基因棉花被棉花炭疽菌处理后的表达情况,结果显示hsr203J、NPR1和PR-1b基因均上调表达。表明病原菌侵染能够诱导转基因棉花不同信号通路(至少包括由SA介导的途径)的启动,产生相关抗性蛋白,从而使植株获得抗病性。因而,转hpalxoo基因棉花可能为某些防卫基因超水平表达提供了分子基础。

