草鱼干扰素3蛋白多克隆抗体制备及其应用
范成坚,苏博洋,苏建国
(1.华中农业大学水产学院,武汉 430070;2.武汉市洪山高级中学,武汉 430070)
草鱼(Ctenopharyngodonidella)是我国产量最高的大宗淡水鱼,2016年草鱼产量达589.88万吨,占我国淡水养殖产量的18.55%[1],对稳定我国水产品市场具有举足轻重的作用。草鱼养殖业长期受到病害问题的困扰。每年因草鱼呼肠孤病毒(Grass carp reovirus,GCRV)引起的草鱼出血病造成的直接经济损失高达十多亿元[2-3]。阐明草鱼抗病毒免疫机制,为新型疫苗研究提供支撑。
2015年草鱼基因组数据库在Nature genetics上发表并公布,为深入系统研究草鱼基因功能奠定了坚实的基础[4]。I型干扰素在抗病毒免疫应答中发挥着至关重要的作用[5]。系统筛查草鱼基因组发现草鱼Ⅰ型干扰素有4个成员组成(IFN1-4),II型干扰素有2个成员组成(IFNγ1-2)[6]。草鱼IFN3位于草鱼2号染色体上,基因体1 770 bp,包含4个内含子,编码序列564 bp,编码的前体蛋白由187个氨基酸组成。成熟肽由167个氨基酸组成,分子量19.23 kD,等电点4.77。草鱼IFN3含有4个半胱氨酸,属于I型II群IFNc亚群[4]。草鱼肾细胞系(C.idellakidney,CIK)在草鱼抗病毒免疫研究中广泛使用。在CIK细胞系中,IFN1和IFN3的表达量比IFN2和IFN4高出3个数量级[7]。在RIG-I(Retinoic acid-inducible gene I)和MDA5(Melanoma differentiation-associated gene 5)过表达的细胞系中,GCRV感染或poly(I∶C)(Polyinosinic∶polycytidylic acid)刺激早期,IFN3的表达量极显著上调[7]。这些现象表明草鱼IFN3在抗病毒免疫应答中发挥着重要作用。
本研究构建草鱼IFN3成熟肽原核表达载体,转化表达菌株,IPTG诱导蛋白表达,将纯化后的蛋白免疫BALB/c小鼠,制备多克隆抗体。间接ELISA方法测定抗体效价,western blot鉴定多克隆抗体特异性。在草鱼个体水平和CIK细胞水平上检测草鱼IFN3的蛋白表达。为进一步深入解析草鱼抗病毒免疫机制奠定蛋白水平上检测的基础。
1 材料与方法
1.1 实验材料
草鱼呼肠孤病毒(GCRV)097株由中国科学院水生生物研究所汪亚平研究员惠赠,属于GCRV-II型;草鱼肾细胞系(CIK)购自中国典型培养物保藏中心(CCTCC);DMEM培养基和胎牛血清购自美国Gibco公司;PCR Mix、BamH I酶、XhoI酶、T4连接酶和质粒提取试剂盒等购自武汉擎科创新生物科技有限公司;大肠杆菌BL21(DE3)pLysS菌株、pGEX-4T-1质粒由本实验室保存。
1.2 实验动物
6周龄体重16~18克的BALB/c小鼠5只,在华中农业大学实验动物中心饲养并制备抗体用;500 g左右草鱼购于湖北省武汉市团风百荣渔场,在华中农业大学水产学院循环水养殖系统暂养3周以上。
1.3 草鱼IFN3基因扩增
根据GenBank(KU182642)中草鱼IFN3的mRNA序列,分析得到编码成熟肽的序列,设计引物,上游引物:5′-GATGGATCCTTGCCAACAAACTGCATCCT-3′;下游引物:5′-ATACTCGAGCTAGGGTTGTGGAGATTCATACAT-3′(下划线序列分别为BamH I和XhoI酶切位点)。20 μL PCR反应体系:10 μL Primerstar,上、下游引物分别为0.5 μL,1 μL草鱼头肾巨噬细胞cDNA作为模版,ddH2O 8 μL。PCR反应程序:95 ℃预变性5 min,94 ℃ 30 s、57 ℃ 30 s、72 ℃ 40 s,30个循环,最后72 ℃延伸10 min。
1.4 pGEX-4T-1原核表达载体构建
用限制性内切酶BamH I和XhoI对PCR扩增、纯化的草鱼IFN3片段和表达载体pGEX-4T-1进行双酶切,37 ℃水浴酶切3.5 h,纯化后连接。反应体系:T4连接酶1 μL,Buffer 1 μL,pGEX-4T-1载体2 μL,IFN3片段6 μL。16 ℃水浴连接过夜。转化大肠杆菌BL21(DE3)pLysS菌株,提取质粒,经限制性内切酶BamH I和XhoI双酶切鉴定正确后,送样至武汉奥科鼎盛生物科技有限公司测序,经确认的重组载体命名为pGEX-4T-1-IFN3。
1.5 诱导表达IFN3蛋白及纯化
将上述阳性菌在LB/Amp液体培养基中扩大培养(分5管),测定光密度为(A600=1)时,加入IPTG(终浓度分别为:0、0.5、1、2、3 mmol/L)诱导10 h,收集菌体,超声波(工作5 s,间歇10 s,功率250 W)裂解菌体(注意保持低温环境),收集破碎后的上清和沉淀。SDS-PAGE分析目的蛋白的表达情况及表达形式。按Novagen GST 试剂盒中的操作手册进行纯化。
1.6 IFN3多克隆抗体的制备
用5只6周龄、体重16~18 g BALB/c小鼠制备多克隆抗体,其中1只每次注射等量生理盐水为阴性对照。抗原乳化,对小鼠进行皮下多点注射,免疫剂量50、100、150和200 μg。初次免疫使用弗氏完全佐剂,之后均使用弗氏不完全佐剂。第0周、第2周和第4周各免疫一次,第5周进行断尾取血,测定抗体效价。效价达到要求,可再加强一次免疫,一周后摘眼球取血,收集血清,-20 ℃保存备用。
1.7 间接ELISA检测血清抗体效价
用pH9.6浓度为0.05 mol/L的碳酸盐缓冲液将纯化的重组蛋白稀释为50 ng/mL,包被96孔酶标板,每孔100 μL,4 ℃冰箱包被过夜。次日每孔加1% BSA 200 μL在37 ℃封闭2 h后,用pH 7.4的PBST洗涤3次。加入等梯度稀释(1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200)的血清各100 μL,阴性对照为1∶50稀释的免疫前血清,空白对照为鼠血清稀释液(PBS),每份3个平行,37 ℃孵育1 h后,同上洗涤3次。每孔加入HRP标记的羊抗鼠IgG(1∶5 000稀释)100 μL,37 ℃孵育1 h后,同上洗涤3次。每孔加入100 μL的TMB显色液,37 ℃避光反应20 min后,每孔加入50 μL 2 mol/L的H2SO4终止液。酶标仪上读取A450值,(样品吸光值-空白吸光值)/(阴性吸光值-空白吸光值)>2.1为阳性。
1.8 Western blot分析IFN3抗体特异性
将纯化的IFN3重组蛋白、CIK细胞提取蛋白分别进行SDS-PAGE电泳,半干转膜法转移至NC膜上,于2%的BSA封闭液中室温封闭2 h;一抗为1∶1 000稀释的上述血清,4 ℃孵育过夜;二抗为1∶5 000稀释的HRP标记的羊抗鼠IgG,37 ℃作用1 h;每次反应后均用TBST洗3~5次,每次5 min。用TMB显色剂显色并观察结果。
1.9 细胞水平病毒感染后不同时间点IFN3蛋白表达
CIK细胞传代至6孔细胞培养板中,待细胞长至单层铺满80 %左右后,感染GCRV-097病毒,未感染病毒的正常细胞作为阴性对照。感染后6、12、24、48和72 h收集细胞,提取蛋白。Western blot检测IFN3在CIK细胞感染GCRV后不同时间点的蛋白表达。
1.10 个体水平不同组织IFN3蛋白表达
对暂养3周以上500 g左右的3尾草鱼解剖,取免疫相关组织(头肾、中肾、脾脏、肝胰腺、鳃、皮肤和肠),3尾鱼相应组织样品混合提取蛋白。
Western blot检测IFN3在草鱼不同组织中的蛋白表达情况。
2 结果
2.1 PCR扩增IFN3及鉴定
PCR扩增IFN3,1%琼脂糖凝胶电泳检测结果(图1)显示:在500 bp上方有一条特异性条带,与理论大小一致。限制性内切酶BamH I和XhoI对扩增片段及质粒pGEX-4T-1进行双酶切,连接、转化大肠杆菌BL21(DE3)pLysS菌株、双酶切鉴定、测序确认。

图1 草鱼IFN3基因扩增PCR产物电泳图Fig.1 Amplification result of grass carp IFN3 PCR product 1.IFN3基因PCR产物;M.DNA Marker 2000
2.2 IFN3蛋白原核表达和表达形式分析
阳性菌株用IPTG诱导表达,SDS-PAGE电泳结果(图2)显示:泳道1未出现明显目标蛋白条带,泳道2-5出现一条明显的重组蛋白条带(约45kD),与理论大小相符。泳道6、7未见明显的重组蛋白条带(上清),泳道8、9重组蛋白含量较多(沉淀)。表明目标蛋白主要以包涵体形式存在。
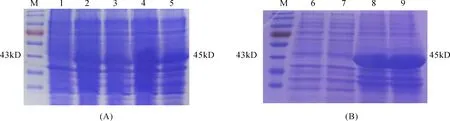
图2 SDS-PAGE分析重组质粒pGEX-4T-1-IFN3表达产物及其可溶性Fig.2 The expression protein of pGEX-4T-1-IFN3 and the dissolubility of the recombinant protein by SDS-PAGE analysisA:诱导表达结果;B:可溶性结果。M.蛋白质marker;1.未诱导;2.0.5 mmol/L的IPTG诱导表达;3.1 mmol/L的IPTG诱导表达;4.2 mmol/L的IPTG诱导表达;5.3 mmol/L的IPTG诱导表达;6~7.2 mmol/L的IPTG诱导表达产物上清;8~9.2 mmol/L的IPTG诱导表达产物沉淀
2.3 IFN3蛋白纯化
纯化后蛋白如图3所示,条带单一,无明显杂带,且大小与理论值(带GST标签后约45kD)一致,表明蛋白纯化效果好。

图3 IFN3重组蛋白纯化后SDS-PAGE分析结果Fig.3 SDS-PAGE of the purified protein productsM.蛋白质marker 1;1.纯化的IFN3重组蛋白
2.4 血清抗体效价
使用间接ELISA法测定血清多克隆抗体效价,结果表明草鱼IFN3重组蛋白制备的多克隆抗体效价约为1∶3 200。
2.5 Western blot检测抗体特异性
为了检测抗体的特异性,对IFN3重组蛋白及CIK细胞蛋白进行SDS-PAGE分析,结果如图4所示。重组蛋白有一条约45kD的条带(带GST标签),GCRV刺激CIK细胞24 h后的细胞蛋白有一条约19 kD的条带(内源蛋白)。结果与理论一致且无明显杂带,表明所制备抗体的特异性强。
2.6 CIK细胞水平上的时间依赖性表达
GCRV感染CIK细胞后,IFN3在感染后6、12、24、48和72 h的蛋白表达如图5所示。在感染早期,IFN3蛋白的表达检测不到,在感染12 h后开始出现条带,且随着时间推移,目标条带逐渐加深变宽,表明其表达量呈上升趋势。

图5 GCRV感染CIK细胞后不同时间点IFN3的表达Fig.5 IFN3 protein expressions in CIK cells post GCRV infection1.未感染;2.GCRV感染6 h;3.GCRV感染12 h;4.GCRV感染24 h;5.GCRV感染48 h;6.GCRV感染72 h
2.7 草鱼个体水平上不同组织表达
IFN3蛋白在草鱼免疫相关组织(头肾、中肾、脾脏、肝胰腺、鳃、皮肤和肠)中的蛋白表达如图6所示,仅在皮肤和肝胰腺中检测到表达,其他组织表达量很低或不表达。
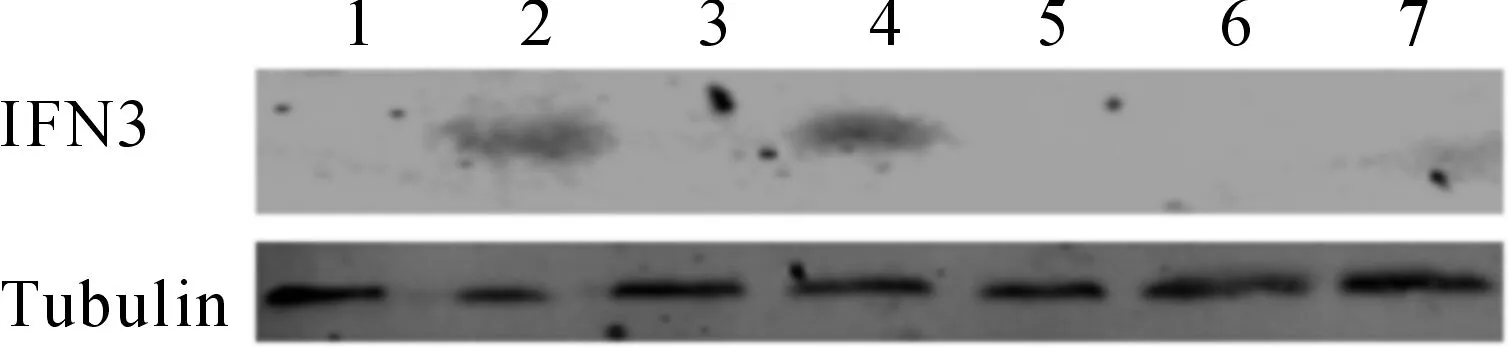
图6 草鱼主要免疫相关组织IFN3的表达Fig.6 IFN3 protein expressions in major immune-related tissues in grass carp1.肠;2.皮肤;3.鳃;4.肝胰脏;5.脾脏;6.中肾;7.头肾
3 讨论
干扰素属于II型细胞因子,最初是因其具有干扰病毒复制的能力而命名为干扰素。1957年,在研究流感病毒时发现在鸡胚中注射灭活病毒后,鸡胚膜中产生一种抗病毒蛋白,即为“干扰素”(Interferon,IFN)[8]。现已证明干扰素作为多效性的细胞因子在生物体中普遍存在[9],除了抗病毒作用外,它还参与其他重要的生理过程,如调节细胞的生长、分化、凋亡以及机体免疫反应等。所以,深入研究干扰素及其作用机制,对于鱼类病毒性疾病的防治具有重要的理论和实际意义[10]。
IFN3属于I型干扰素。目前I型干扰素是研究最多、最深入的干扰素[6]。鱼类I型干扰素具有广谱抗病毒活性。Altmann等[11]研究发现转染了斑马鱼IFN基因的细胞对杆状病毒的抵抗力显著提高。不仅内源性IFN具有抗病毒活性,体外重组表达的I型IFN对于机体或细胞也具有较好的保护作用[12]。Li等[13]研究斑马鱼重组IFN1(zfrIFN1)对传染性脾肾坏死病毒(ISKNV)感染斑马鱼引起急性病毒感染的抑制作用,发现zfrIFN1能够强烈抑制ISKNV对斑马鱼的急性感染并且启动先天性免疫反应。在哺乳类和鸟类中,干扰素和重组干扰素已应用于临床实践,例如重组IFNα/β已被广泛用于抑制肿瘤和治疗病毒性疾病[14-15],然而在鱼类生产实践中,应用干扰素提高鱼类自身免疫力,增强其抗病力的工作尚在初级阶段[16]。
尽管人们对草鱼病毒病的防治进行了一些卓有成效的探索,但这些方法或多或少存在一些不足之处。具有广谱抗病毒作用的干扰素可能是防治草鱼病毒性疾病的一种新途径[17]。邵健忠等[16]研究草鱼干扰素对巨噬细胞的免疫调节功能,结果表明:草鱼干扰素对草鱼巨噬细胞(Mφ)具有显著的激活作用,它能提高Mφ内O2-、H2O2和ACP的活性与含量,促进Mφ的吞噬和杀菌作用。将人IFNα基因序列转入到草鱼基因组内,成功获得表达人IFNα蛋白的转基因草鱼,通过一段时间的养殖发现,转基因草鱼的抗病能力较普通草鱼的抗病能力高[18-19]。吴初新等[20]纯化草鱼Ⅰ型干扰素重组蛋白,将重组蛋白添加到饲料中,投喂草鱼2 d后进行攻毒试验,结果显示攻毒21 d后,投喂重组蛋白组的成活率达63.33%,表明重组IFN蛋白可以作为一种新型鱼类免疫制剂。
通过本实验,我们获得了草鱼IFN3多克隆抗体,并检测了其在草鱼不同免疫组织中的表达差异,以及其在CIK细胞中应对GCRV感染的时间依赖性表达。结果显示在肝胰脏和皮肤中检测到特异性条带,在CIK感染GCRV 12 h后出现特异性条带,这与邵健忠等[21]研究的草鱼干扰素诱生结果一致。本研究为进一步深入解析草鱼抗病毒免疫机制奠定蛋白水平上检测的基础,同时为干扰素在草鱼病害防治上的开发和利用奠定了基础。

