锌掺杂碳量子点“关-开”型荧光探针检测果蔬中谷胱甘肽的研究
李 宏,华建豪,侯朝祥,王翰墨,田 浩,杨亚玲,李晚谊*
(1.云南省农业科学院 农产品加工研究所,云南 昆明 650033;2.昆明理工大学 生命科学与技术学院,云南 昆明 650500)
谷胱甘肽是一种特殊的氨基酸衍生物,由谷氨酸、半胱氨酸、甘氨酸3种氨基酸组成,在自然界中以还原型(GSH)和氧化型(GSSG)两种形式广泛存在于动植物和微生物体内,还原型为其主要存在形式[1]。GSH分子内含有活性巯基,具有保护肝脏、抗病毒、解毒、抗肿瘤作用,在细胞的多种基本代谢功能中起抗氧化作用[2]。目前,测定谷胱甘肽的常用方法有:高效液相色谱法[3]、毛细管电泳法[4]、分光光度法[5]、电化学法[6]、酶法[7]等。这些方法各有优点,但存在操作繁琐,耗时等不足。荧光分析方法因灵敏度高、快速、简便、经济,在诸多分析方法中占有优势,尤其是基于发光碳量子点的荧光分析方法,已发展成为一种新型有效的方法[8]。
荧光碳量子点(CQDs)是一种尺寸在10 nm 以内且单分散的准球形新型荧光纳米材料,是目前最热门的碳纳米材料之一。与传统的有机荧光染料相比,CQDs具有优异的生物相容性,绿色环保性,亲水性,化学及光稳定性等诸多优点,是一种理想的分析探针[9-10]。此外,研究发现,通过化学掺杂能完善CQDs的缺陷从而提高其各方面的性能[11-12]。目前,基于碳量子点的荧光响应分析已应用于无机金属离子[13]和有机物[14]的定量测定。
本研究从碳量子点(CQDs)荧光猝灭-恢复现象出发,以柠檬酸、乙二胺和乙酸锌为前体,采用一步水热法制备了一种稳定的、高荧光量子产率的蓝色发光锌掺杂碳量子点(Zn-CQDs)。在合成的碳量子点中加入Cu2+使其荧光猝灭,再在体系中加入GSH,由于Cu2+-GSH的螯合作用,体系的荧光恢复,进而可实现对GSH的选择性检测。本方法操作简单,灵敏度高,成本低,可用于果蔬样品中GSH的测定。
1 实验部分
1.1 仪器与试剂
G9800A荧光分光光度计(美国安捷伦公司),Tecnai G2 TF30场发射透射电子显微镜(荷兰FEI公司),X射线衍射仪(XRD,德国Bruker公司),TENSOR27型傅立叶红外光谱分析仪(德国Bruker公司),UV-2600紫外-可见分光光度计(日本岛津公司),XW-800快速混匀器(上海汗诺仪器有限公司),HC-3018R型高速离心机(安徽中科中佳科学仪器有限公司),120 mL聚四氟乙烯(PTFE)内衬水热反应釜(上海一凯实验仪器有限公司),电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
还原型谷胱甘肽、乙酸锌、三氯乙酸、维生素C、谷氨酸、天冬氨酸、谷氨酰胺、天冬酰胺均购自阿拉丁化学试剂有限公司,葡萄糖、蔗糖、柠檬酸、乙二胺、磷酸氢二钠购于国药集团化学试剂有限公司,CuCl2、NaCl、MgCl2、CaCl2、ZnCl2、KI、FeCl3·6H2O购自天津市化学试剂三厂。所用化学药品及试剂均为分析纯,实验用水为超纯水。
GSH提取液的配制:准确称取5.0 g三氯乙酸,溶解于纯水中并定容至50 mL,配制成质量浓度为0.1 g/mL的提取液备用。
1.2 实验方法
1.2.1锌掺杂碳量子点(Zn-CQDs)的制备分别准确称取1.0 g的柠檬酸,0.5 g的乙酸锌溶于100 mL超纯水中,超声10 min使其混合均匀,再加入5 mL乙二胺,室温下搅拌均匀后将溶液转移至聚四氟乙烯内衬水热反应釜中,于180 ℃恒温加热6 h,反应完成后自然冷却至室温,得棕色溶液。将所得溶液过0.22 μm滤膜以除去大颗粒杂质,再经10 000 r/min高速离心15 min,得到锌掺杂碳量子点(Zn-CQDs),并于4 ℃下储存备用。
1.2.2量子产率的测定将碳量子点配制成溶液后,测试其紫外可见吸收光谱及荧光光谱(λex=350 nm)。将荧光峰的积分面积F及相应的吸收值A(λem=440 nm)代入公式:
Φx=ΦS(nx/nS)2(AS/Ax)(Fx/FS)
(1)
式中,Φx为测试样品的荧光量子效率,ΦS表示标准物质的荧光量子效率,n表示溶剂的折光指数。实验中采用的标准物(S)为硫酸奎宁(荧光量子效率为54%)。计算得到荧光量子点产率为37.68%。
1.2.3样品处理本实验所用果蔬样品均购于当地超市(云南昆明)。分别准确称取洗净的黄瓜和西红柿样品各10 g,充分研磨,匀浆,分别加入10 mL GSH提取液,充分振荡10 min使提取完全,提取液经8 000 r/min 离心10 min后过0.22 μm滤膜,得到的上清液用纯水定容至50 mL,待测。
1.2.4测定方法向3 mL的Zn-CQDs(0.5 g/L)溶液中加入1 mL的Cu2+(5 mmol/L)溶液,用pH 6.0的磷酸氢二钠-柠檬酸缓冲液(50 mmol/L)定容至50 mL,静置10 min备用。
称取适量GSH,用超纯水溶解,配制成不同浓度系列的GSH溶液。取上述经Cu2+猝灭的Zn-CQDs溶液1.0 mL,加入不同浓度的GSH储备液100 μL,用pH 6.0的磷酸氢二钠-柠檬酸缓冲液(50 mmol/L)定容至3 mL,涡旋混匀。于激发波长λex=348 nm,发射波长λem=445 nm处测定荧光强度F和试剂空白溶液荧光强度F0。实验过程示意图如图1所示。

图1 锌掺杂碳量子点(Zn-CQDs)的制备及检测GSH的原理示意图Fig.1 Schematic illustration of the preparation of zinc-doped carbon quantum dots (Zn-CQDs) and their application for GSH detection
2 结果与讨论
2.1 碳量子点的合成与表征
本实验通过一步水热法制备了Zn-CQDs。以乙酸锌作为锌掺杂的反应前体可提高荧光量子产率,同时改变Zn-CQDs的电负性提高选择性[15]。如图2A所示,与不掺锌的CQDs相比,Zn-CQDs的发射光谱出现红移,且量子产率提高9.68%,证明了Zn-CQDs的合成以及锌掺杂的改性作用。
图2B为Zn-CQDs的透射电镜图(TEM),从图中可以看出,所制备的碳量子点呈类球形结构,分散性好,且尺寸均一,平均尺寸4~5 nm左右。从高倍透射电镜(插图)图可以看出,Zn-CQDs的晶格间距约为0.21 nm,对应于石墨的(102)晶面[16]。Zn-CQDs的X射线衍射谱图在2θ=23.2°处出现一个较宽的衍射峰(图2C),归为碳的特征衍射峰,说明Zn-CQDs具有一定的晶型结构。

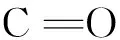
2.2 测定原理
由于Zn-CQDs表面含有大量的羧基和氨基基团,能与Cu2+通过静电作用结合并附着于Zn-CQDs表面,当Zn-CQDs处于激发态时,Cu2+直接从光激发碳量子点的导带吸收电子并转移至未占有电子能级的最低轨道上,从而导致激发态电子不能有效回到价带,即发生电荷转移而使Zn-CQDs荧光猝灭。向该猝灭体系中加入GSH时,由于GSH分子内的巯基和羰基只与Cu2+结合形成螯合物,且结合键的强度大于静电作用力的强度,因此Cu2+会逐渐从Zn-CQDs表面脱离[17],使得体系的荧光逐渐恢复(图1)。



图4 pH值对体系荧光强度的影响Fig.4 Effect of pH value on the fluorescence intensity of the system
2.3 反应条件的优化
2.3.1pH值本实验选用50 mmol/L磷酸氢二钠-柠檬酸溶液作为缓冲体系,考察了缓冲溶液pH值的影响。在pH 2.0~8.0范围内,不同缓冲溶液pH值对荧光猝灭及恢复体系荧光强度的影响见图4。在荧光猝灭及恢复体系中,当pH≤6.0时,荧光强度变化值随pH值的增加不断增加,当pH>6.0后,荧光强度变化值逐渐变小,故本实验选择磷酸氢二钠-柠檬酸缓冲溶液的最佳反应pH值为6.0。当反应体系定容至3.0 mL时,缓冲液用量为1.9 mL。
2.3.2反应时间研究了反应时间对荧光恢复体系的影响。在1~10 min范围内每隔1 min测定1次体系荧光强度变化值,发现体系荧光强度变化值在1~5 min内逐渐增加,随后趋于稳定,故选择5 min为最佳反应时间。
2.4 猝灭体系对GSH的选择性


2.5 猝灭体系对GSH的响应
在优化实验条件下,考察了猝灭后的Zn-CQDs荧光恢复程度与GSH浓度之间的关系。发现GSH浓度在0.05~80 μmol/L内与Zn-CQDs荧光恢复率呈线性关系,线性回归方程为y=0.053 6x+0.340 4,其中,y表示荧光恢复率(F-F0)/F0,x表示GSH的浓度,相关系数r2=0.996 4,检出限达63 nmol/L(S/N=3),且GSH浓度的变化对Zn-CQDs+Cu2+的荧光光谱几乎无影响。相比于GSH的其他检测方法(表1),本方法通过荧光探针的“关-开”模式对GSH进行选择性识别,具有线性范围宽、检出限低的优势,灵敏度和检测效率较高。
(续表1)

MethodSampleLinear rangeLODReferenceColorimetryA549 cells3.0~30 μmol/L-[7]FluorescenceTomatoes and cucumbers0.05~80 μmol/L63 nmol/LThis work
2.6 实际样品分析
取西红柿和黄瓜样品,按上述方法各平行测定5次,得到西红柿和黄瓜提取液中GSH的平均含量分别为5.3 μmol/L和6.1 μmol/L。对样品进行1.0、20.0 μmol/L两个水平的加标实验,每个水平平行测定5次,得到加标回收率为98.6%~101%,相对标准偏差为1.8%~3.1%(n=5),结果见表2。说明本方法具有良好的回收率和精密度。

表2 实际样品中谷胱甘肽含量的测定结果(n=5)Table 2 Determination results of GSH in practical samples(n=5)
3 结 论
本研究制备了一种高稳定性、高荧光量子产率的水溶性锌掺杂碳量子点(Zn-CQDs),利用Cu2+对碳量子点的光致电子转移猝灭及GSH-Cu2+之间的螯合作用,建立了碳量子点荧光猝灭-恢复效应测定谷胱甘肽的新方法,实现了对果蔬中谷胱甘肽的灵敏检测。在最优条件下,方法的线性范围为0.05~80 μmol/L(r2=0.996 4),检出限达63 nmol/L。该分析方法专属性强、灵敏度高、操作简便,检测时间短,在谷胱甘肽的检测方面具有较为广阔的应用前景。

