扫描电化学显微镜用于研究生物膜微环境的电子传递
田晓春 ,吴雪娥 ,詹东平 ,赵峰 ,姜艳霞 ,孙世刚
1厦门大学化学化工学院,福建 厦门 361005
2中国科学院城市环境研究所,中国科学院城市污染物转化重点实验室,福建 厦门 361021
1 引言
生物电化学系统利用微生物催化不同氧化还原反应实现电子转移,已应用于污染物强化转化和微生物产电等领域1,是一种发展前景广阔的能源物质转化新技术。目前,电化学活性微生物的胞外电子传递途径主要包括直接电子传递和间接电子传递2,其中,电子穿梭体介导的间接电子传递可提高生物电化学系统的能量转化率3,4,其相关研究能推动污染修复及生物能源的发展5。
伏安法、恒电位法是研究微生物在电极/溶液界面转移电子的重要手段6–8。Marsili等9利用循环伏安和恒电位,测得Shewanella生物膜分泌的flavins能介导电子传递并在微生物细胞和胞外固体间进行周期性氧化还原循环。但是,这种间接电子传递途径是基于生物膜层面的推测,由于生物膜内部组成复杂,其中包含的各种分泌物10、胞外聚合物等也具有电子传递以及氧化还原能力11,12,因此这种机制有待于进一步确认。
扫描电化学显微镜(SECM)13,14的微电极具有准确定位、灵敏度高的特点,已用于监测生物膜的形成及其微区环境的变化,如pH15,16、铜离子浓度分布17、H2O2浓度18,19等。SECM的微电极在三维空间的位置能够准确控制,当微电极没有直接接触到微生物细胞且二者距离超过10 nm,微电极不会收集到由直接电子传递途径所产生的电流。如果有电子中介体在微生物和探针电极之间介导电子转移,那么探针电极收集的电流仅来自间接电子传递的贡献;此外,利用SECM的穿透模式能够得到微电极穿过生物膜过程中的电流变化,从而反映微生物在电极/溶液界面的分布。因此,本论文构建SECM体系,利用穿透模式研究微生物在电极/溶液界面的电子传递方式和空间分布。另外,在构建SECM体系时,需要选择合适的电子穿梭体,考虑到自然界中广泛存在微生物与含铁矿物的相互作用以及地球化学铁循环的意义,选择电化学性质简单、明确的可溶性铁化合物二茂铁甲醇(FcMeOH)作为电子穿梭体介导Shewanella的间接电子传递过程。本研究基于SECM 的穿透模式,通过微电极收集来自间接电子传递产生的电流,测定电极/溶液界面生物膜的厚度等空间分布信息。
2 实验部分
2.1 试剂和材料
试剂:二茂铁甲醇(FcMeOH,购买于Sigma-Aldrich);蛋白胨和酵母提取物由英国Oxoid公司生产,为生物技术级。NaCl、KCl、NaH2PO4和Na2HPO4均为分析纯。
材料:氧化铟锡导电玻璃(ITO,厚1.1 mm,表面电阻< 17 Ω·□-1)购买于珠海凯为光电科技有限公司;铂丝(直径25 μm)购买于阿法埃莎(天津)化学有限公司;饱和甘汞电极和Ag/AgCl参比电极购买于上海辰华仪器有限公司。
2.2 微生物的培养
实验中使用的菌株 Shewanella oneidensis MR-1在pH为7.0的Luria-Bertani (LB)培养基中32 °C恒温培养18 h。其中,LB培养基的组成为蛋白胨10 g·L-1、酵母提取物5 g·L-1和氯化钠5 g·L-1。
本实验中将微生物富集在 ITO电极表面的步骤如下:首先,以5000 r·min-1的转速离心菌液,除去发酵上清液;用100 mmol·L-1的PBS (pH 7.0)溶液重新分散后离心清洗;重复两次后,用移液枪移取沉淀覆盖在电极表面,自然风干至微生物附着在电极表面不会脱落。
2.3 电化学实验
实验中使用上海辰华仪器有限公司生产的CHI660D电化学工作站研究微生物的电化学性质。扫描电化学显微镜使用CHI920C电化学工作站,构建三电极体系时,饱和甘汞电极(SCE)或饱和Ag/AgCl作参比电极,铂丝作对电极,工作电极为ITO或富集有S. oneidensis MR-1的ITO,探针电极使用自制的直径为25 μm的Pt微电极,制备方法及表征如图 S1–S3 (Supporting Information)。
微生物的基本电化学性质测定用磷酸盐缓冲溶液(PBS:100 mmol·L-1,pH 7.0)作为电解液;在研究微生物与电子穿梭体相互作用的电极过程以及穿透模式时,电解液中含 1 mmol·L-1FcMeOH。

图1 SECM的穿透模式测定S. oneidensis MR-1生物膜的示意图(a)和照片(b)Fig. 1 (a) Schematic diagram for penetration mode and (b) image of SECM cell.
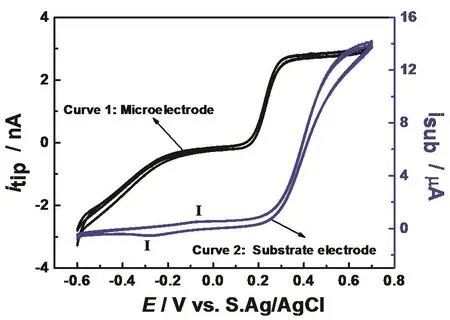
图2 Pt微电极和Shewanella/ITO基底电极的循环伏安图,扫描速率为50 mV·s–1Fig. 2 CVs of Pt microelectrode and S. oneidensis MR-1/ITO substrate, respectively.Scan rates are 10 mV·s-1.
3 结果与讨论
3.1 构建SECM体系测定电极/溶液界面的微生物
穿透模式是SECM的模式之一,利用探针电极穿透微结构获取电化学信息20。构建SECM体系利用微电极穿透电极/溶液界面的生物膜并获取电化学信息,原理如图1a所示。首先,确定可用于SECM实验体系的基底。排除生物膜组成复杂的影响,将培养好的S. oneidensis MR-1离心清洗后滴加至 ITO 电极表面形成 S. oneidensis MR-1/ITO基底,5 min后向电解池中加入电解液,此时 S. oneidensis MR-1不会立刻扩散至电解液中,因此能保持清晰的溶液/微生物界面,如图1b所示。其次,以25 μm的Pt微电极作为探针电极。
利用穿透模式测定电极/溶液界面的微生物时,首先要讨论电子穿梭体分别在探针电极和基底电极的氧化还原过程。微电极置于含有 1 mmol·L-1FcMeOH 的电解液中,同时记录微电极和基底电极的循环伏安曲线,结果如图2所示。其中,曲线 1为 Pt微电极在本体溶液中测得的循环伏安曲线,在-0.2 – +0.6 V范围内呈“S”形,检测到的FcMeOH的氧化电流在0.26 V达到稳态为3.2 nA,此值与微电极在1 mmol·L-1FcMeOH溶液中得到的稳态氧化电流值一致(图 S2),这说明微生物的存在对本体溶液的FcMeOH的浓度无影响。曲线2为S. oneidensis MR-1/ITO基底电极的氧化还原过程,其中氧化和还原峰 I分别为 S.oneidensis MR-1的氧化和还原(图S4),这是其表面与直接电子传递相关的细胞色素 c的氧化和还原21,22;在电位高于0.25 V时,氧化电流逐渐增加,此电流来自于FcMeOH的氧化。
另外,图2中微电极和Shewanella/ITO基底电极经过连续两周循环伏安扫描,得到的循环伏安曲线几乎重合,这说明 ITO与 S. oneidensis MR-1形成的界面稳定,该实验体系适用于Shewanella的电化学性质测定。
3.2 S. oneidensis MR-1与电子中介体相互作用的电极过程
为了进一步确定 FcMeOH与 S. oneidensis MR-1互相作用的界面过程,降低电解液中的FcMeOH浓度至0.01 mmol·L-1,结果如图3a。其中,曲线2为测定FcMeOH在ITO表面的氧化还原峰(II)电位分别为0.24和0.15 V;当S. oneidensis MR-1在电极/溶液界面时,只能观察到 FcMeOH的氧化过程(III),而没有随后 FcMeOH+被还原的过程,并且氧化电流达到最大值的电位约为 0.4 V,由此可以推测氧化过程产生的 FcMeOH+被电极表面的微生物还原。电极反应如图3b所示:开路时,FcMeOH在本体溶液和电极界面以还原态存在,不存在被电极和微生物还原的反应;当电极电势控制为氧化过程时,电极氧化FcMeOH为FcMeOH+,此时S. oneidensis MR-1能够将产生的FcMeOH+还原为 FcMeOH,这个过程促进FcMeOH在微生物和电极之间的氧化还原;当电极电势控制为还原过程时,电极和微生物同时竞争还原在氧化过程产生的 FcMeOH+,FcMeOH+还未及时扩散到电极表面已经被微生物还原,因此电极未检测到 FcMeOH+的还原峰。因此,FcMeOH能够作为外源性电子穿梭体介导Shewanella与电极之间的电子传递。
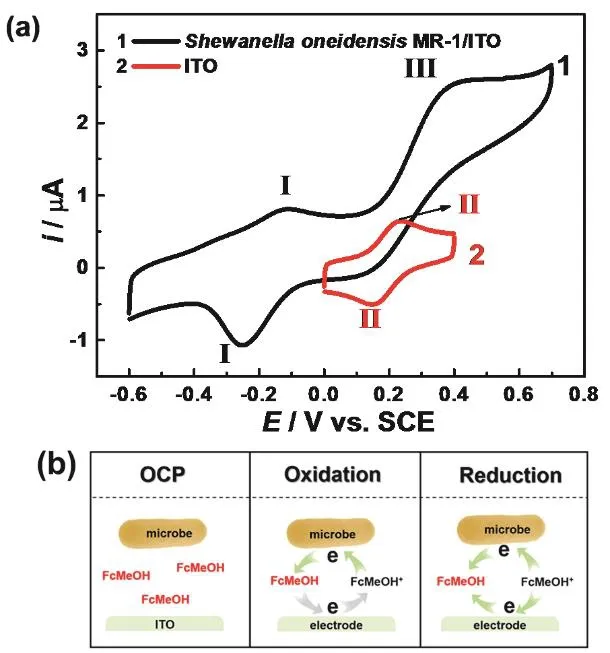
图3 (a) ITO和S. oneidensis MR-1/ITO在0.01 mmol·L-1 FcMeOH溶液中的循环伏安曲线,扫描速率50 mV·s-1;(b) S. oneidensis MR-1与FcMeOH在电极/溶液界面的相互作用Fig. 3 (a) CV curves of ITO and S. oneidensis MR-1 in PBS with 0.01 mmol·L-1 FcMeOH. Scan rate was 50 mV·s-1; (b) Reaction between S. oneidensis MR-1 and FcMeOH at ITO/solution interface during the oxidation and reduction process.
另外,图3a中的循环伏安曲线1的氧化峰(I)和还原峰(I)均更明显,这对氧化还原峰与图 2中曲线 2的氧化还原峰(I)是一致的。此结果也表明FcMeOH未破坏微生物表面的细胞色素 c的电化学活性,是本研究所需要的电子穿梭体。
3.3 穿透模式研究电极/溶液界面Shewanella生物膜的空间结构
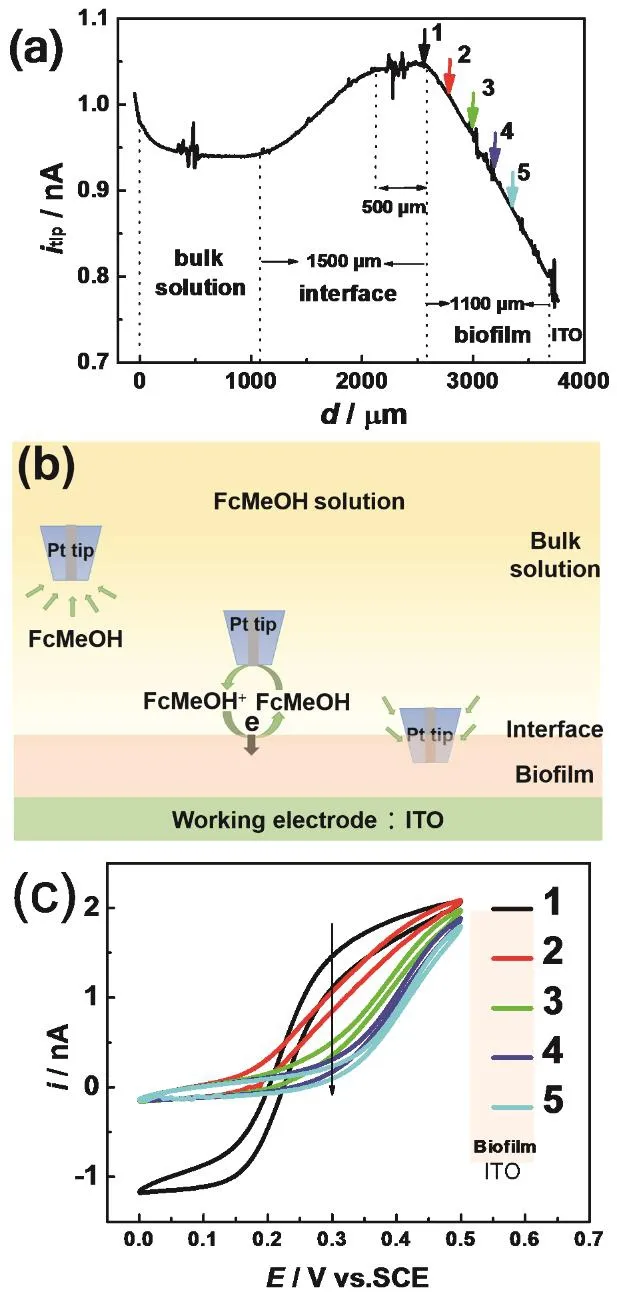
图4 Pt微电极从本体溶液到生物膜的渐进曲线(a)及其示意图(b),探针电势为0.3 V;(c)探针电极穿透生物膜不同距离时的循环伏安曲线,扫描速率为50 mV·s-1Fig. 4 (a) Approaching curve and (b) schematic diagram of Pt tip from bulk solution into biofilm. Probe E = 0.3 V;(c) Cyclic voltammograms of Pt microelectrode which penetrated different distance into biofilm.Scan rates are 50 mV·s-1.
以循环伏安实验结果为基础,在穿透模式下,控制微电极从本体溶液起逐渐靠近基底,穿透溶液/微生物/电极的界面,并收集变化的探针电极电流,结果如图4a,b所示。其中,图4a中横坐标d为探针电极从本体溶液向生物膜渐进过程中行进的距离。首先设置探针处于本体溶液,当它在本体溶液中沿 z轴方向渐进时,收集到的电流平稳,来自于本体溶液中的FcMeOH的氧化反应;在探针电极移1100 μm时,电流开始增加,此时微电极进入微生物/溶液界面,根据图3b中的氧化过程,可以推断此时电流的增加来源于微生物与电极之间的正反馈;当探针移动约2100 μm时,探针电流达到最大值并且稳定,表明生物膜/溶液界面内的此区域里 FcMeOH的浓度相对均匀区域,厚度约为500 μm;在2600 μm后电流开始呈线性减小,此时探针电极已进入生物膜内部,受微生物的阻碍能扩散到探针电极表面的 FcMeOH减少,同时,微生物能够将此时产生的FcMeOH+完全还原,因此探针电极电流持续减小。当探针渐进约3700 μm时电极微电极触碰ITO基底,因此得到实验中生物膜的厚度约为1100 μm。
为了确认生物膜内探针电极收集到的电流减小的原因,控制探针电极首先在生物膜/溶液的界面处(图4a中1位置)测量循环伏安曲线,随后依次渐进 200 μm在生物膜内测试循环伏安曲线(图4a中2–5位置),结果如图 4c中曲线1–5所示。当探针电极进入生物膜之前,得到的循环伏安曲线1已经不同于其在本体溶液中得到的“S”形,但此时氧化过程产生的FcMeOH+在还原过程中仍能被探针电极检测到,约为-1.2 nA。当微电极进入生物膜之后(循环伏安曲线2–5),随着深度增加,氧化电流的起始电位正移;相同氧化电位下的氧化电流逐渐减小,氧化电流在0.5 V之前均未达到稳态。另外,探针电极位于生物膜内时,还原电位对应的电流明显消失。这些实验现象反映的结果能够进一步确定如图 3b所示的 FcMeOH与Shewanella相互作用的电极反应机理。
4 结论
本文研究了S. oneidensis MR-1与电子穿梭体FcMeOH相互作用的电极反应过程,实现了溶液/微生物/电极界面结构的测定,得到了电子中介体在微生物/溶液进行氧化还原反应区域的厚度约为500 μm,生物膜的厚度为1100 μm;根据FcMeOH在微电极与微生物之间的正反馈作用,利用微电极收集到仅来自于微生物间接电子传递过程的电流。基于该研究体系,未来可开展其他电子穿梭体与不同微生物之间介导的电子传递机制研究;也可通过基底表面微生物的有序排列以及探针电极纳米化,实现单层生物膜甚至微生物个体的空间检测。该工作从物理化学基础层面增进了对溶液/微生物/电极界面的胞外电子传递机制的理解,也为利用电子穿梭体提高微生物电化学系统的效率奠定了基础。
Supporting Information:available free of charge via the internet at http://www.whxb.pku.edu.cn.

