虎杖多糖乙醇分级纯化及其抗氧化性
王 佳,李进霞,张慧芝,徐鹏洋,陈忠琴,闫燕艳,*
(1.山西大同大学脑科学研究所,山西大同037009;2.天津大学药物科学与技术学院,天津市现代药物传递及功能高效化重点实验室,天津300072)
虎杖(Polygonum cuspidatum Sieb.et Zucc.)为蓼科蓼属多年生草本植物,其干燥根茎和根为药用部位,具有清热解毒、止咳化痰、利湿退黄、散瘀止痛的功效[1],临床用于湿热黄疸、风湿痹痛、水火烫伤、跌扑损伤、痈肿疮毒等[2]。植物化学成分分析表明,虎杖中主要含有二苯乙烯类和蒽醌类化合物,此外还含有鞣质和多糖等[2]。
多糖的纯化常采用纤维素柱层析、透析和凝胶柱层析等方法,限于成本和得率,难以用于大规模生产[3]。多糖在溶剂中的溶解程度取决于其碳原子数、分子量及聚合度等多种因素[4],乙醇分级沉淀法可通过逐步提高乙醇的体积浓度分离纯化多糖。相比其它纯化方法,乙醇分级沉淀法的优势在于,分级纯化多糖的同时仍能维持较高得率,具有广阔的应用价值,如茶多糖[3]、黄芪多糖[5]、白芨多糖[6]等。然而有关乙醇分级纯化虎杖多糖的报道较少,乙醇分级纯化过程中虎杖多糖结构及药理活性变化未见报道。鉴于此,本研究采用乙醇分级沉淀法分离出不同的虎杖多糖,并对其理化性质及抗氧化活性进行研究,探讨乙醇分级纯化对虎杖多糖含量、光谱学性质及抗氧化活性的影响,为虎杖在药品及保健食品领域中的开发利用提供实验及理论依据。
1 材料与方法
1.1 材料与仪器
虎杖 山西浑源万生黄芪开发有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 美国 Sigma公司;D-葡萄糖、D-半乳糖醛酸 国药集团化学试剂有限公司;无水乙醇、浓硫酸、三氯化铁 天津市江天化工技术有限公司,其它试剂 均为国产分析纯。
Tensor 27红外光谱仪 德国Bruker公司;UV-2450紫外分光光度计 日本Shimadzu;BSA623S分析天平 北京赛多利斯仪器有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;R213B旋转蒸发仪 上海申生仪器有限公司;DK-98-ⅡA电热恒温水浴锅 天津泰斯特仪器有限公司;FD-1冷冻干燥机 上海豫康仪器有限公司。
1.2 实验方法
1.2.1 虎杖多糖提取及乙醇分级纯化 参照文献[5],将虎杖药材粉碎后称取200 g,按 1∶20(m/v)加入去离子水,于100℃水浴加热回流提取3次,每次2 h,提取液合并后,在50℃下真空旋转蒸发浓缩至40 mL,依次加入乙醇,使分级体系中乙醇浓度分别达到30%、50%、70%、90%,每调节一次浓度后,将醇沉液放置于4 ℃冰箱中静置8 h,3000 r·min-1离心15 min,取沉淀用5 mL去离子水充分溶解并冷冻,利用冷冻干燥机在-50℃真空条件下48 h干燥样品,得到对应浓度乙醇沉淀制得的4组多糖,分别标记为 PCP-30、PCP-50、PCP-70、PCP-90,称重并计算其得率。得率(%)=(粗多糖质量/原料质量)×100。
1.2.2 总糖含量测定 采用硫酸苯酚法测定总糖含量[7],取样品300 μL,加入5%苯酚300 μL,混匀后加入浓硫酸1.5 mL,静置后测其在490 nm处的吸光值。以D-葡萄糖为标准品并绘制标准曲线(y=5.9451x+0.0361 R2=0.9943),比较4组虎杖多糖的总糖含量。所有测定均三次重复。
1.2.3 糖醛酸含量测定 采用硫酸咔唑法测定糖醛酸含量[7],取样品 250 μL,加入四硼法酸钠溶液1.5 mL,混匀后于100℃水浴中加热10 min,迅速冷却,加入50μL咔唑溶液,混匀后于100℃水浴中加热15 min,迅速冷却,静置后测其在525 nm处的吸光值。以D-半乳糖醛酸为标准品,并绘制标准曲线(y=0.0088x+0.029,R2=0.9975),比较 4 组虎杖多糖的糖醛酸含量。所有测定均三次重复。
1.2.4 红外光谱分析 取待测虎杖多糖粉末,以干燥的KBr压片,采用红外光谱仪,测其在 4000~400 cm-1波长范围内的吸收光谱[8]。
1.2.5 紫外光谱 取待测虎杖多糖粉末,均配制为0.1 mg/mL的溶液,采用紫外-可见分光光度计,测其在200~400 nm波段范围内的吸收光谱[9]。
1.2.6 DPPH自由基清除活性测定 参照文献[7],分别配制不同浓度的虎杖多糖(0.5、1.0、2.0、4.0、8.0 mg/mL)并取 0.1 mL,加入 DPPH(120μmol/L)2.9 mL混匀,于37℃烘箱中避光30 min,在517 nm处测量吸光值。DPPH自由基清除率的计算公式为:I(%)= [(Ablank-Asample)/Ablank]×100。以只加入溶剂的反应体系设定为空白对照,Ablank为空白对照的吸光值,Asample为样品的吸光值。
1.2.7 还原力测定 参照文献[7],分别配制不同浓度的虎杖多糖(0.5、1.0、2.0、4.0、8.0 mg/mL)并取0.1 mL,依次加入0.2 mol/L磷酸盐缓冲液(p H=6.6)0.7 mL,1%铁氰化钾溶液2 mL充分混匀,于50℃水浴中反应20 min,加入10%三氯乙酸2 mL充分混匀,3000 r·min-1离心 10 min,取上清液 1 mL 加入1%三氯化铁3 mL,混匀后测其在700 nm处的吸光值。
1.3 数据处理
采用Microsoft Excel及SPSS软件进行数据统计及分析。
2 结果与分析
2.1 虎杖多糖得率及含量测定结果
乙醇可降低多糖水溶液的介电常数,同时减少多糖与水的作用,使多糖聚合沉淀,不同浓度的乙醇可沉淀出对应的多糖[10]。乙醇分级纯化制备的虎杖多糖的得率,总糖含量、糖醛酸含量见表1,4组多糖得率均表现出显著性差异(p<0.05),其中PCP-30得率最高,可达到1.065 mg/g,其次为PCP-70>PCP-50>PCP-90。总糖及糖醛酸含量结果显示,PCP-70和PCP-90差异不显著(p>0.05),其余多糖间均表现出显著性差异(p<0.05),4组虎杖多糖总糖含量由大到小依次为:PCP-70>PCP-90>PCP-50>PCP-30,糖醛酸含量排序为:PCP-70>PCP-90>PCP-50>PCP-30,与总糖含量排列趋势相同。PCP-70总糖含量及糖醛酸含量最高,且得率较高,与洪彤彤等[6]发表的研究结果相一致,其乙醇分级沉淀所得4组白芨多糖中,70%乙醇沉淀所得组分总糖含量最高。结果表明,相比其他组分,70%沉淀所得多糖组分纯度较高,杂质少,有利于多糖后期进一步的纯化及深入研究。
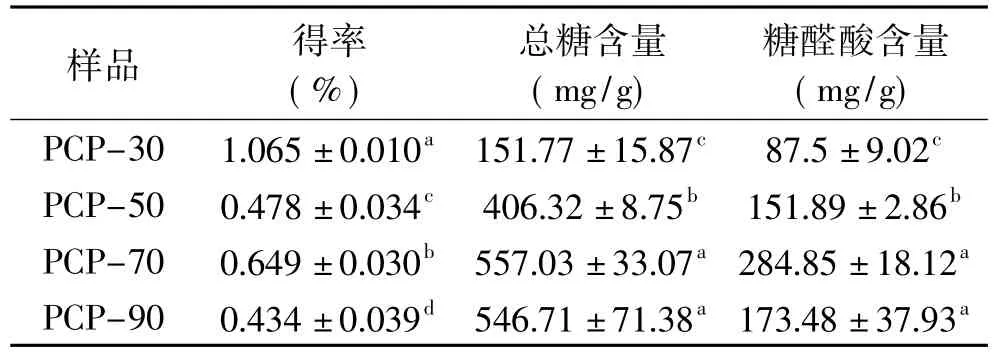
表1 虎杖多糖得率以及总糖、糖醛酸含量Table 1 The yields,total sugar contents and uronic acid contents of polysaccharides from Polygonum cuspidatum
2.2 虎杖多糖红外光谱分析
虎杖多糖 PCP-30、PCP-50、PCP-70 及 PCP-90的红外光谱如图1所示,3398 cm-1处有宽而强的吸收峰为多糖中O-H的伸缩振动,2924 cm-1处出现的小肩峰为 C-H 的伸缩振动,1448~1236 cm-1间的一组吸收峰为糖类化合物的C-H变角振动[9],可初步判定4组样品均为多糖,且1643 cm-1处的吸收峰为C=O的伸缩振动,可推测其为糖醛酸结构[10],与表1中酸性糖测定结果一致。1018~1091 cm-1间的一组吸收峰为吡喃糖环的特征峰[5],854 cm-1处的吸收峰为 β-端基差向异构体的 C-H 变角振动[11],762 cm-1处吸收峰为α-端基差向异构体的C-H变角振动[12],575 cm-1附近的弱吸收峰可能为-NH2扭曲振动导致的[9]。图1结果表明,不同浓度乙醇沉淀所得4组虎杖多糖都具有多糖的典型基团,且所含基团无明显差异,可推测其化合物组成及分子结构基本相同。这与杜香多糖[13]、桑黄胞内多糖[14]分级醇沉的结果相似,分级醇沉对多糖红外光谱影响较小。
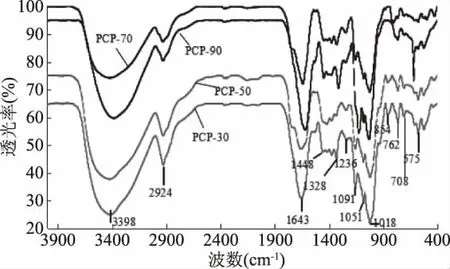
图1 虎杖多糖的红外光谱图Fig.1 FTIR spectra of polysaccharides from Polygonum cuspidatum
2.3 虎杖多糖紫外光谱分析
图2 为虎杖多糖 4个组分(PCP-30、PCP-50、PCP-70、PCP-90)的紫外扫描图谱,由图 2可知,4组多糖在260 nm处均无明显吸收,推测所得多糖中不含核酸成分,在280 nm处,4组多糖的吸收峰有明显差异,其中PCP-90吸收最明显,其次为PCP-70有较小吸收,表明PCP-90及PCP-70中均含有蛋白质,其中 PCP-90蛋白质含量最高,而 PCP-30及PCP-50吸收峰不明显,表明蛋白质含量较低。可见乙醇分级沉淀并不能完全除去多糖中的蛋白质,与李璐[15]、赵书凡[16]等得出的结果相似。

图2 虎杖多糖的紫外扫描图谱Fig.2 UV scanning spectra of polysaccharides from Polygonum cuspidatum
2.4 虎杖多糖DPPH自由基清除活性的测定结果
图3 为虎杖多糖 4个组分(PCP-30、PCP-50、PCP-70、PCP-90)的DPPH自由基清除率。结果显示,在浓度0.5~8 mg/mL范围内,4组虎杖多糖DPPH自由基清除活性均呈现浓度依赖性,浓度越大,清除率越强。比较4组虎杖多糖,PCP-70清除DPPH自由基活性最强[IC50=(4.46±0.32)mg/mL],其次为PCP-90[IC50=(5.09 ±0.08)mg/mL],DPPH 自由基清除率由大到小依次为:PCP-70>PCP-90>PCP-50 >PCP-30。

图3 虎杖多糖DPPH自由基清除活性Fig.3 Scavenging activity against DPPH radical of polysaccharides from Polygonum cuspidatum
2.5 虎杖多糖还原力的测定结果
图4 为虎杖多糖 4个组分(PCP-30、PCP-50、PCP-70、PCP-90)的还原力试验测定吸光度值。结果显示,在浓度0.5~8 mg/mL范围内,比较4组虎杖多糖,还原力由大到小依次为:PCP-70>PCP-90>PCP-50>PCP-30,PCP-70 还原力最强,PCP-30 最弱,且4组虎杖多糖的还原力均有较好的浓度依赖性,浓度越大,还原力越强,与DPPH自由基清除实验所得结果相一致。在之前的报道中,杨军国等[17]利用70%和80%乙醇沉淀制备的茶多糖中,TPs-70对DPPH清除活性及还原力均强于TPs-80,表明70%制备的多糖样品抗氧化活性更高,与本研究结果相似。
2.6 虎杖多糖活性成分与抗氧化性的线性关系

图4 虎杖多糖还原力Fig.4 Reducing power of polysaccharides from Polygonum cuspidatum
考察虎杖多糖有效成分对抗氧化性的影响,可通过SPSS软件计算Pearson相关系数进行比较,Pearson相关系数越接近1,说明该成分与对应的抗氧化活性相关性越高[7]。从表2可以看出,总糖及糖醛酸含量与DPPH自由基清除活性均有正相关性(y=0.132x-4.8417,r=0.880;y=0.2775x+1.6048,r=0.805),总糖含量与还原力表现出正相关性(y=0.0012x-0.1863,r=0.740),糖醛酸含量与还原力有显著的正相关性(y=0.0035x-0.3002,r=0.945,p <0.05)。

表2 虎杖多糖总糖含量及糖醛酸含量与DPPH自由基清除活性及还原力的Pearson相关系数Table 2 Pearson’s correlation coefficient of the contents of sugar and uronic acid in polysaccharides from Polygonum cuspidatum with the DPPH radical scavenging activity and reducing power
3 结论
本研究以虎杖为原料,采用乙醇分级沉淀法,制得4组虎杖多糖,分别为 PCP-30、PCP-50、PCP-70和PCP-90。其中PCP-30得率最高,PCP-70得率次之,PCP-70总糖含量及糖醛酸含量最高,且表现出最强的DPPH自由基清除活性及还原力,因此推测乙醇沉淀纯化虎杖多糖的最适宜体系浓度为70%,在此条件下可简单高效的实现虎杖多糖的初步提取纯化,更易实现规模化生产。红外光谱检测4组分都具有多糖的典型基团,且所含基团无明显差异。相关性结果表明,虎杖多糖总糖及糖醛酸含量与其DPPH自由基清除活性及还原力活性之间呈正相关性。结果表明,乙醇分级沉淀是分离纯化虎杖多糖简单高效的方法,有利于提高虎杖的资源利用率,为其在药品及保健食品中的广泛应用奠定基础。

