《元素周期律》教学设计
辽宁省抚顺德才高级中学 赵增薪
一、教材分析
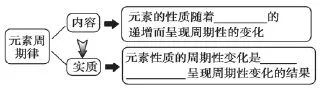
教材内容及地位:本节课为人教版化学必修二第一章第二节内容,教材以1第IA族和第ⅦA元素为例,从原子核外电子排布、原子半径和元素金属性非金属性几个方面,阐述元素性质的周期性变化,导出元素周期律。在高考当中选择题中有一道元素周期律的题,同时若同学们选择选修三的话那么也是以元素周期表为基础来学习。
二、教学目标
知识与技能:
1.知道元素原子核外电子排布,周期表中原子半径,元素金属性和非金属性的周期性变化。
2.认识元素周期律是元素原子核外电子排布随元素核电荷数的递增发生周期性变化的必然结果。
过程与方法:通过元素周期律的推出及运用,初步培养学生抽象归纳以及演绎推理能力;
情感、态度与价值观:结合元素周期律的学习,使学生树立由量变到质变以及“客观事物本来是相互联系的和具有内部规律的”辩证唯物主义观点。
教学重难点:原子的半径和元素金属性和非金属性的变化规律突出方法:小组讨论法
三、学情分析
学生的差异是客观存在的,教师只有全面了解学生情况,才能做到因材施教,有的放矢。本次教学设计主要针对的是普通中学高一年级的学生,该阶段的学生思维敏捷活泼,但不够严谨,而且元素周期律要求同学们必须要细心,所以在做题中培养学生善于思考,善于分析,善于总结的能力。
【教学过程】
引课:回顾上几节课相应的知识点。
【教师活动】:请同学们翻开元素周期表观察同一主族同一周期最外层电子数有什么相同和不同之处?
【学生活动】:翻开元素周期表进行讨论研究
1.实质
【教师活动】请同学们根据元素周期表小组讨论完成以下两个表格?
【学生活动】:翻开元素周期表小组进行讨论研究
【教师活动】总结除由于F、O元素化学性质的特殊性不显正价和稀有气体元素外,其它元素的1.主族元素最高正价=_______=_______
2.∣负价∣= 8-最外层电子数
3.粒子半径的比较
【练习】1.下列元素的原子半径依次减小的是( )
A.Na、Mg、Al B. N、O、Na
C. P、Si、Al D. C、Si、P
2.下列各组微粒半径(r)之比大于1的是( )
A.rCl / rF B.rI-/rI
C.rMg2+/Na+D.rF-/rCl-
3.下列各组物质的性质比较,正确的是( )
A.酸性:HClO4>H3PO4> H2SO4
B.氢化物稳定性:H2S> HF> H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2
D.氧化性:F2>Cl2>Br2>I2
4.已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-<D-
5.(2016·邢台质检)X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是 ()
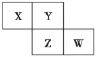
A.X的最常见气态氢化物的水溶液显酸性
B.最高价氧化物对应水化物的酸性W比Z强
C.Z的单质与氢气反应比Y单质与氢气反应剧烈
D.X的原子半径小于Y
(2 0 1 5·山东理综,8)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是()
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
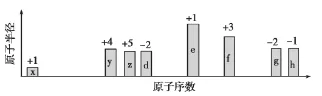
根据判断出的元素回答问题:
(1)f在周期表中的位置是___。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):____>____;比较g、h的最高价氧化物对应水化物的酸性强弱:___>____。
8.(2015·江苏化学,5)短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是( )
A.原子最外层电子数由多到少的顺序:Y、X、W、Z
B.原子半径由大到小的顺序:W、Z、Y、X
C.元素非金属性由强到弱的顺序:Z、W、X
D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
9.(2015·海南化学,12)a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c下列叙述错误的是( )
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b、c、d分别与氢形成的化合物中化学键均为极性共价键
10.(2015·课标全国Ⅰ,12)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是()
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中

