尾叶香茶菜的化学成分及其对酪氨酸酶抑制活性的研究
朴艳, 于畅, 金英今, 李熙峰*
( 1.龙井市环境监测站, 吉林 龙井 133400; 2.延边大学 理学院, 吉林 延吉 133002 )
尾叶香茶菜(Isodonexcisa(Maxin.)Hara)为唇形科香茶菜属植物,又名龟叶草、野苏子,性凉味甘,为多年生草本植物,在我国的吉林、辽宁及河南等地广泛分布[1].尾叶香茶菜全草入药,具有清热解毒、健胃、活血止痛等功效,民间常用于抗菌、消炎和止痛[2].近年来,随着对尾叶香茶菜的药理作用及化学成分研究的不断深入,其在临床的应用愈来愈广泛[3-4].目前,有关尾叶香茶菜对酪氨酸酶的抑制活性尚未见报道.为了进一步开发和利用尾叶香茶菜的药用资源,本文对长白山区尾叶香茶菜的化学成分及其活性进行研究.
1 仪器与材料
1200RRLC -6410B型高效液相色谱 -质谱联用仪(LC -MC),Agilent; AV-500型和AV-300型核磁共振仪,Bruker; LC -6AD型高效液相色谱仪(HPLC),Shimadzu; 手提式紫外检测器(254 nm),上海顾村电光仪器厂; 酶标仪,Molecular Devices; Prestige -21型红外光谱仪(IR),Shimadzu; U-3010型紫外光谱仪(UV),Shimadzu; 维生素C,Sigma -Aldrich; 1,1-二苯基苦酰基苯肼(DPPH),Sigma -Aldrich; Na2HPO4和NaH2PO4,Amresco; 柱色谱用硅胶(74~148 μm),青岛海洋化工厂; 反相色谱硅胶(ODS -A),YMC*GEL; 色谱柱(ODS -AM,250 mm×10 mm,5 μm),YMC -Pack; 薄层色谱板(TLC,Silica gel 60 F254),MERCK; 96孔板,海门市生物技术研究所; 甲醇(色谱纯),Fisher; 甲醇、氯仿、石油醚、醋酸乙酯、正丁醇、二氯甲烷均为分析纯; 尾叶香茶菜采自吉林省延吉市市郊.
2 提取分离
将干燥的尾叶香茶菜的叶子(1.5 kg)用甲醇浸泡后提取3次,每次超声30 min;静置过夜,过滤,将3次的滤液合并后减压浓缩得粗提物I (236.8 g).将粗提物用少量蒸馏水溶解,依次用石油醚、乙酸乙酯和正丁醇进行液-液分配,得64.8 g石油醚萃取物IP、40.6 g乙酸乙酯萃取物IE 和27.8 g正丁醇萃取物IB .
将萃取物IE过ODS -AM层析柱,依次用体积分数分别为90%、95%、100%的甲醇和100%的丙酮洗脱,得4个组分(IE1 — IE4).根据TLC分析结果,选取组分IE1过硅胶层析柱,并用二氯甲烷-丙酮为溶剂系统进行梯度洗脱;经TLC分析,合并相似组分,得8个组分(IE1a — IE1h).根据TLC分析结果和活性筛选结果,利用ODS -A柱色谱、硅胶柱色谱以及HPLC等方法将组分IE1e进行分离纯化,得到化合物1 (8.7 mg)、2 (3.9 mg)、4 (13.1 mg)、5 (2.9 mg).采用相同的方法从组分IE1f中得到化合物3 (4.1 mg).
3 结构鉴定
化合物1: 白色粉末; EI-MSm/z488 [M]+; UV(MeOH)λmax(logε) 268(4.68), 272(4.66) nm; IR(KBr)νmax3 439, 2 932, 1 688, 1 641, 1 454, 1 387, 1 036 cm-1;1H NMR(CD3OD,300 MHz)δ5.30(1H,br s,H-12), 3.93(1H,d,J=11.2 Hz,H-3), 2.57(1H,m,H-2), 2.50(1H,s,H-18), 1.35(3H,s,29-CH3), 1.20(3H,s,27-CH3), 0.99(6H,s,23,26-CH3), 0.93(3H,d,J=6.3 Hz,30-CH3), 0.87(3H,s,24-CH3), 0.79(3H,s,25-CH3);13C NMR(CD3OD,75 MHz)δ182.5(s,C -28), 140.2(s,C -13), 129.5(d,C -12), 80.2(d,C -2), 73.7(s,C -19), 67.3(d,C -3), 55.2(d,C -18), 49.4(d,C -5), 48.3(d,C -9), 43.2(d,C -20), 42.9(s,C -14), 42.6(t,C -1), 41.4(s,C -4), 39.6(s,C -10), 39.5(s,C -8), 39.2(t,C -22), 34.2(t,C -7), 29.7(t,C -15), 29.4(q,C -23), 27.4(t,C -11), 27.2(q,C -27), 26.7(t,C -16), 25.0(q,C -29), 24.8(t,C -6), 22.6(q,C -24), 19.4(t,C -21), 17.7(q,C -25), 16.9(q,C -30), 16.8(q,C -26).以上数据与文献[5]的报道基本一致,故鉴定化合物1为野鸦椿酸,其化学结构如图1所示.
化合物2:白色粉末;(-)-ESI-MSm/z373[M-H]-; UV(MeOH)λmax(logε) 218(4.63), 229(4.57), 251(4.99), 280(4.80) nm; IR(KBr)νmax3 346, 1 449, 1 028 cm-1;1H NMR(CD3OD,500 MHz)δ7.05(2H,t,J=2.4 Hz,H-2′,2″), 6.86(2H,t,J=8.1 Hz,H-6′,6″), 6.78(2H,dd,J=8.1,2.4 Hz,H-5′,5″), 4.84(1H,s,H-2), 4.68(1H,s,H-6), 4.46(1H,t,J=2.4 Hz,H-4a), 4.04(1H,d,J=9.2 Hz,H-8a), 3.87(3H,s,3′-OCH3), 3.86(3H,s,3″-OCH3), 3.85(1H,s,H-8b), 3.76(1H,dd,J=9.1,6.2 Hz,H-4b), 3.04(1H,m,H-5);13C NMR(CD3OD,125 MHz) δ 149.3(s,C -3″), 148.9(s,C -3′), 147.7(s,C -4″), 147.6(s,C -4′), 133.8(s,C -1′), 129.2(s,C -1″), 121.7(d,C -6″), 120.7(d,C -6′), 116.2(d,C -5″), 115.8(d,C -5′), 112.9(d,C -2″), 111.5(d,C -2′), 92.9(s,C -1), 89.5(d,C -6), 88.0(d,C -2), 76.2(t,C -8), 72.2(t,C -4), 62.6(d,C -5), 56.5(q,C -OCH3).以上数据与文献[6]的报道基本一致,故鉴定化合物2为1-羟基松脂素,其化学结构如图1所示.
化合物3: 白色粉末; ESI-MSm/z3 350[M+H]+; UV(MeOH)λmax(logε) 235(5.00) nm; IR(KBr)νmax3 366, 2 928, 1 728, 1 647, 1 456, 1 398, 1 020 cm-1;1H NMR(CDCl3,500 MHz)δ6.19(1H,s,H-17), 5.43(1H,s,H-17), 4.88(1H,br s,H-14), 4.36(1H,dd,J=12.2,4.1 Hz,H-7), 3.21(1H,dd,J=11.6,4.8 Hz,H-3), 3.09(1H,br s,H-13), 1.08(3H,s,20-CH3), 1.05(3H,s,18-CH3), 0.84(3H,s,19-CH3);13C NMR(CDCl3,125 MHz)δ208.1(s,C -15), 147.7(s,C -16), 118.3(t,C -17), 78.6(d,C -3), 75.4(d,C -14), 75.1(d,C -7), 61.9(s,C -8), 54.2(d,C -9), 52.7(d,C -5), 46.2(d,C -13), 39.8(s,C -4), 38.9(s,C -10), 38.0(t,C -1), 31.2(t,C -12), 28.6(q,C -18), 27.9(t,C -6), 27.4(t,C -2), 18.3(q,C -20), 17.8(t,C -11), 15.9(q,C -19).以上数据与参考文献[7]的报道基本一致,故鉴定化合物3为川藏香茶菜甲素,其化学结构如图1所示.
化合物4: 白色粉末; (-)-ESI-MSm/z367[M+Cl]-; UV(MeOH)λmax(logε) 230(4.04) nm; IR(KBr)νmax3 325, 2 938, 1 726, 1 703, 1 649, 1 458, 1 387, 1 256, 1 092 cm-1;1H NMR(CDCl3,300 MHz)δ6.19(1H,s,H-17a), 5.44(1H,s,H-17b), 5.30(1H,br s,—OH), 4.85(1H,s,H-14a), 4.38(1H,br d,J=11.6 Hz,H-7b), 3.11(1H,br s,H-13a), 1.15(3H,s,20-CH3), 1.09(6H,s,18,19-CH3);13C NMR(CDCl3,75 MHz) δ 216.8(s,C -3), 207.7(s,C -15), 147.4(s,C -16), 118.6(t,C -17), 75.0(d,C -14), 74.4(d,C -7), 61.8(s,C -8), 52.9(d,C -9), 51.8(d,C -5), 46.9(s,C -4), 46.1(d,C -13), 39.0(s,C -10), 38.3(t,C -1), 33.8(t,C -2), 30.9(t,C -12), 29.2(t,C -6), 27.9(q,C -18), 21.1(q,C -19), 18.5(q,C -20), 18.3(t,C -11).以上数据与文献[5]的报道基本一致,故鉴定化合物4为兰萼香茶菜甲素,其化学结构如图1所示.
化合物5: 白色粉末; ESI-MSm/z195.4 [M+H]+, 217.3 [M+Na]+; UV(MeOH)λmax(logε) 216(3.85), 243(3.43), 328(3.99) nm;1H NMR(CD3OD,300 MHz)δ7.54(1H,d,J=15.9 Hz,H-3), 7.03(1H,d,J=1.9 Hz,H-2′), 6.94(1H,dd,J=8.2,1.9 Hz,H-6′), 6.77(1H,d,J=8.2 Hz,H-5′), 6.26(1H,d,J=15.9 Hz,H-2), 3.76(3H,s,—OCH3);13C NMR(CD3OD,75 MHz) δ 169.9(s,C -1), 149.7(s,C -4′), 147.1(d,C -3), 147.0(s,C -3′), 127.8(s,C -1′), 123.1(d,C -6′), 116.6(d,C -5′), 115.3(d,C -2), 115.0(d,C -2′), 52.1(q,—OCH3).以上数据与文献[8]的报道基本一致,故鉴定化合物5为咖啡酸甲酯,其化学结构如图1所示.
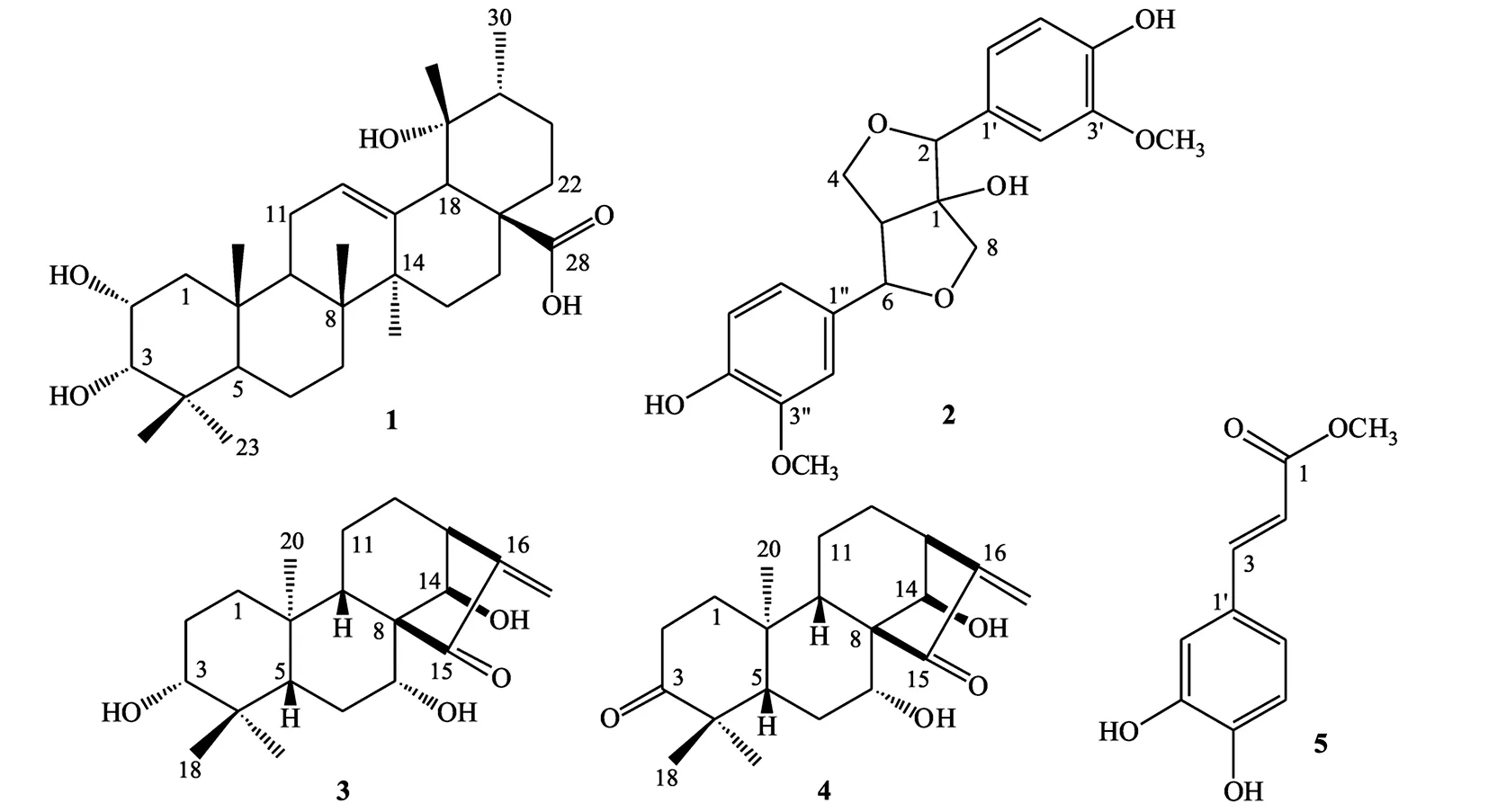
图1 5种化合物的化学结构
4 活性实验
以酪氨酸为阳性对照,对5个化合物分别进行酪氨酸酶抑制活性实验.结果表明,化合物3和化合物5对酪氨酸酶的抑制活性相对较好,其抑制率分别为51.5%和55.0%.
5 结论
本文在长白山区尾叶香茶菜的干燥叶子中,经提取分离得到了5种化合物:野鸦椿酸(1)、1-羟基松脂素(2)、川藏香茶菜甲素(3)、兰萼香茶菜甲素(4)、咖啡酸甲酯(5).其中化合物3和5对酪氨酸酶具有一定的抑制作用,且化合物5为首次在香茶菜属植物中分离得到.本研究结果可为开发和利用长白山区尾叶香茶菜的药用资源提供参考.

