甘蔗HD-Zip I亚家族转录因子基因ScGT1的克隆和生物信息学分析
李旭娟,李纯佳,林秀琴,刘洪博,徐超华,字秋艳,毛钧,陆鑫,刘新龙
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远661699)
0 引言
HD-Zip I亚家族为植物特异转录因子,隶属于Homeobox蛋白家族[1],主要由高度保守的Homeodomain同源结构域和Leu zipper元件组成,前者可与DNA特异结合,后者主要介导蛋白二聚体的形成[2-3]。HD-Zip I转录因子成员通过与其他蛋白互作,参与植物对非生物和生物逆境的应答、激素和光信号响应及器官发育等调控[4]。前人研究表明,植物中的一些HD-Zip I亚家族转录因子成员参与了植物发育等过程的调控,如拟南芥(Arabidopsis thaliana)的 ATHB1[5]、ATHB13[6]、ATHB53[7]和 ATHB16[8]分别参与叶片细胞分化、蔗糖信号转导途径、生长素/细胞分裂素在根发育中的信号转导和蓝光信号转导等途径的调控;大麦(Hordeum vulgare)的Vrs1参与六棱穗状花序的形成,其功能缺失会导致二棱大麦未发育的侧部小穗表现出发育饱满多产的表型[9];复苏植物(Craterostigma plantagineum)的CpHB7参与植物器官的早期发育[10]。一些HD-Zip I亚家族转录因子成员可响应逆境和植物激素胁迫,如拟南芥的ATHB6和ATHB7受干旱和外源脱落酸ABA的胁迫诱导表达[11-12];水稻(Oryza sativa)的Oshox22可调控ABA的合成,并通过ABA代谢途径调控植物对干旱和盐胁迫的响应[13];陆地棉(Gossypium hirsutum)的GhHB1的基因受盐胁迫和ABA的调控[14];向日葵(Helianthus annuus)的HAHB4响应水分胁迫,调控抗旱相关基因的表达[15];番茄(Lycopersicon esculentum )的VAHOX1可被低温诱导表达[16]。
分蘖是影响禾本科农作物穗数和茎数进而影响其株型和产量的重要农艺性状之一[17]。对于无性繁殖经济作物——甘蔗(Saccharum spp.),靠茎秆作为收获产品,而茎秆主要由分蘖茎构成,因此分蘖可直接影响品种产量[18];另外品种的宿根性也受分蘖影响,分蘖强的甘蔗品种往往宿根性也好[19],基于以上认识,解析甘蔗分蘖的生理和分子基础,挖掘分蘖相关基因,对于甘蔗产量的改良具有重要意义。
GT1(Grassy Tiller1)是近年从玉米(Zea mays)中获得的HD-Zip I家族转录因子,该基因可通过抑制玉米腋芽的萌发和侧枝的伸长发育来调控玉米的分蘖表现,其表达量受避荫诱导且依赖于另一个分蘖调控基因TB1的活性,属于TB1的下游基因[20-21]。鉴于GT1在禾本科植物分蘖调控中的重要性,本研究拟采用RTPCR和RACE技术,从甘蔗主栽品种ROC22中克隆出GT1的同源基因,并对其序列、结构和功能预测开展生物信息学分析,以期为该基因后续更深入的功能鉴定和分子辅助育种奠定基础。
1 材料与方法
1.1 材料
使用我国主栽甘蔗品种ROC22为基因克隆材料,于甘蔗分蘖期采集蔗苗梢部生长点组织用于RNA的提取。所有材料均由国家甘蔗种质资源圃提供。
1.2 方法
1.2.1 模板制备
使用全式金TransZolTMPlant RNA试剂盒提取RNA。新鲜的组织样品首先使用液氮快速研磨成粉末状,然后按照试剂盒说明书实验步骤提取样品总RNA。使用1.0%的琼脂糖凝胶和Bio Drop Lite PC超微量可见紫外分光度计检测RNA的质量和浓度,合格的RNA样品使用Trans Script One-step gDNA Removal and cDNA Synthesis Super Mix反转录试剂盒反转录成cDNA,并于-20℃保存备用。
1.2.2 基因克隆
根据前人研究报道,使用Primer Premier 5.0软件在玉米、高粱(Sorghum bicolor)和小米(Setaria italica)GT1同源基因序列(NM001148841、XM002465650.2和XM004985270.4)的保守区设计RT-PCR引物,引物序列信息见表1。使用全式金Trans Taq DNA Polymerase High Fidelity(HiFi)扩增甘蔗GT1基因片段,PCR体系按照说明书进行。以获得的正确基因片段为序列模板,依据RACE引物设计原则和要求设计5′RACE和3′RACE基因特异引物 (见表1),使用SMARTERTMRACE cDNA Amplification Kit试剂盒进行RACE产物的PCR扩增,相关实验体系参照试剂盒说明书进行。所有RT-PCR和RACE产物使用全式金EasyPure Quick Gel Extraction Kit试剂盒回收,回收产物连接PEASY-T5 Zero Cloning Kit载体并转化大肠杆菌DH5α感受态细胞,挑取至少5个克隆交由深圳华大公司测序。将正确的RT-PCR扩增片段和RACE扩增序列拼接形成cDNA全长序列,同时设计基因编码区引物 (表1)扩增甘蔗GT1基因的编码区。所有的序列比对使用DNAMAN5.0软件进行,序列拼接使用Vector NTI 11.5软件。
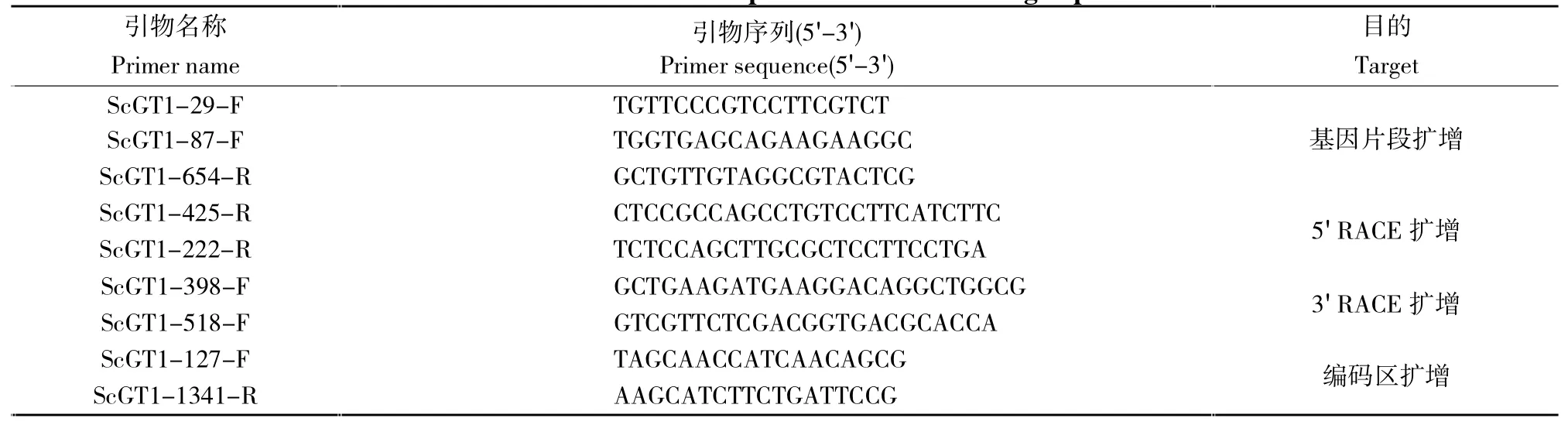
表1 甘蔗ScGT1基因克隆引物信息Table 1 The information of all primers used in cloning experiments of ScGT1
1.2.3 ScGT1生物信息学分析
使用NCBI网站在线工具ORF Finder查找ScGT1基因的开放阅读框和推导氨基酸序列,Conserved domain search 分析蛋白结构域。 使用 ProtScale、ProtParam、SignaIP 4.1、ProtComp Version9.0、SOP-MA、phyre 2、ProtFun等在线蛋白分析软件分析ScGT1蛋白的理化性质、信号肽、亚细胞定位、核定位信号、二三级结构及功能预测。然后在Uniprot数据库(http://www.Uniprot.org)中应用BLASTp寻找并下载ScGT1同源蛋白序列,分别采用DNAman和MEGA7.0进行序列比对和同源性分析,并构建NJ(Neibor-joining)系统进化树。
2 结果与分析
2.1 ScGT1基因全长cDNA的克隆
根据高粱、玉米和小米GT1同源基因保守区设计的RT-PCR引物都可扩增出片段,如图1-A所示,其中引物ScGT1-29-F与ScGT1-654-R获得一条较大的片段,经回收测序,片段大小为629 bp,与高粱、玉米和小米GT1同源基因序列比对,一致性分别达到96%、93%和91%,确定为甘蔗GT1基因的RT-PCR扩增片段。为了获得该基因片段两端序列,使用3′RACE引物ScGT1-398-F和ScGT1-518-F经两轮PCR扩增获得比对正确的3′端片段序列,长度为638 bp(图1-B);再使用5′RACE引物ScGT1-425-R和ScGT1-222-R经两轮PCR扩增获得比对正确的5′端片段序列,长度为559 bp(图1-C)。使用Vector NTI 11.5软件里的ContigExpress程序将RT-PCR基因片段、3′RACE产物和 5′RACE产物拼接后得到全长为1469 bp的cDNA序列。使用编码区扩增引物PCR扩增可获得一条长度为1214 bp的序列(图1-D),与高粱、玉米和小米GT1同源基因序列比对,一致性分别达到93%、85%和87%。该cDNA序列包含286 bp的5′UTR序列,723 bp的编码区序列,460 bp的3′UTR序列,命名为ScGT1,并上传GenBank数据库,编号为MK318528。

图1 ScGT1 PCR扩增电泳结果Fig.1 The PCR amplification picture of ScGT1 geneA:RT-PCR 产物;B:3′RACE 产物;C:5′RACE 产物;D:编码区扩增产物A:the RT-PCR product;B:the 3′RACE product;C:the 5′RACE product;D:The PCR product of code region

图2 ScGT1基因推导出的氨基酸序列Fig.2 The derived amino acid sequence of ScGT1▲:起始密码子;*:终止密码子▲:the initiation codon;*:the termination codon
2.2 ScGT1的生物信息学分析
2.2.1 ScGT1编码氨基酸序列结构
应用NCBI在线ORF Finder程序分析ScGT1的cDNA序列,获得长723 bp的ORF,起始密码子ATG位于161 bp处,终止密码子TGA位于883 bp处,共编码240个氨基酸(图2)。
2.2.2 ScGT1保守结构域和理化性质分析
使用NCBI Conserved domain search在线工具分析ScGT1蛋白的保守结构域,该蛋白包含1个保守结构域Homeodomain,属于Homeodomain超级家族(图3),Homeodomain域上分布有特异性碱基接触位点和DNA binding位点,主要参与植物关键发育过程中的转录调控。使用ProtParam和ProtScale工具预测ScGT1蛋白的理化性质,结果表明,该蛋白分子质量约为26.44 kDa、理化等电点pI为6.04、分子式C1151H1814N336O362S9;在组成该蛋白的 20种氨基酸中丙氨酸(Ala)所占比例最高(14.2%),其次为谷氨酸(Glu),占 10.8%,而异亮氨酸(Ile)和色氨酸(Trp)所占比例最低(0.4%);不稳定指数为 60.49(>40),为不稳定蛋白,脂肪指数为 62.79。总平均亲水性-0.622,从亲/疏水信号图(图 4)来看,第 163 位具有最高分值(2.078),疏水性最强,第 42 位具有最低分值(-4.000),大部分的氨基酸处于0值以下,推测其可能是亲水蛋白。

图3 ScGT1蛋白保守结构域Fig.3 Conserved domain prediction of ScGT1 protein

图4 ScGT1氨基酸序列的亲/疏水性预测Fig.4 Hydrophilic/hydrophobic prediction of the amino acid sequence of ScGT1 protein

图5 ScGT1跨膜结构域和信号肽预测Fig.5 The prediction of transmembrane domain and signal peptide for ScGT1 protein
2.2.3 ScGT1跨膜结构域、信号肽预测和蛋白亚细胞定位
跨膜结构和信号肽分析结果表明ScGT1蛋白1~240位氨基酸都位于细胞膜表面(图5),不存在跨膜结构,不属于膜受体蛋白,不参与细胞信号的传导;第24位丙氨酸(Ala)残基具有最高的剪切位点分值(0.124)和最高的综合剪切点分值(0.125),第 21位丙氨酸(Ala)残基具有最高的信号肽分值(0.169);由于最后算得的信号肽平均值较小,为0.127(远小于0.5),因此推测ScGT1为非分泌蛋白,不存在信号肽。亚细胞定位分析表明ScGT1蛋白位于细胞核、微体、线粒体基质空间、叶绿体类囊体膜的概率分别为70.0%、30.4%、10.0%和10.0%,推测其主要分布在细胞核。
2.2.4 ScGT1的二级结构和功能预测
使用SOPMA软件预测ScGT1蛋白的二级结构,结果如图6所示,该蛋白主要由α-螺旋(h)、无规则卷曲(c)、β-折叠(e)、和 β-转角(t)构成,其中 α 螺旋最多,比例为 49.17%,其次为无规则卷曲(34.17%)和 β-折叠(10.42%),β-转角最少,为6.25%。使用ProtFun 2.2预测ScGT1蛋白功能,结果表明该蛋白主要参与氨基酸生物合成(可能性值最高,为3.539)。

图6 ScGT1二级结构预测Fig.6 The secondary structure prediction of ScGT1 proteinh:α 螺旋;e:β-折叠;c:无规则卷曲;t:β-转角h:alpha helix,e:beta-fold,c:random curl,t:beta-turn
2.2.5 ScGT1的三级结构预测
采用反射折叠法构建ScGT1蛋白的三级结构。根据phyre 2软件预测结果可知ScGT1空间结构以螺旋和无规则卷曲为主(见图7)。将该蛋白与高粱、玉米和水稻GT1蛋白(XP002465695.1、NP001142313.1和XP015629042.1)的三级空间结构图进行比较,结果显示它们的三级空间结构存在小的差异,整体上较相似。

图7 ScGT1三级结构预测Fig.7 The third structure prediction of ScGT1 protein

图8 ScGT1与几种禾本科植物同源蛋白质序列比对图Fig.8 Alignment map of ScGT1 with homologous protein sequences of several gramineous plants
2.2.6 ScGT1同源性分析
利用ScGT1编码蛋白在Uniprot中搜索比对发现,ScGT1编码蛋白与高粱、玉米、黍(Panicum hallii)、二香皮寡毛鱼草(Dichanthelium oligosanthes)、小米、水稻等单子叶禾本科植物的HD-Zip I家族基因序列一致性较高,分别是93%、88.9%、87.6%、87.5%、87.2%、73.6%。DNAman软件比对可知(图8),它们的氨基酸序列整体上较为相似,其中Homeodomain结构域十分保守,变异较少,其次为Coiled coil结构区,Low complexity结构区变异较为丰富些,甘蔗在此结构区前段存在2个氨基酸(DS)的插入,水稻在此结构末端存在6个氨基酸(AAAALA)的插入。

图9 ScGT1与其它禾本科植物同源基因蛋白的NJ系统进化树Fig.9 The NJ phylogenetic tree of ScGT1 and other gramineous plant homologous proteins
另外,使用MEGA7.0构建了ScGT1和其它9种禾本科植物HD-Zip I家族基因的NJ系统进化树,结果如图9所示。10种蛋白可聚为2个组,一组主要由HD-Zip I家族的gt1 Clade组成,另一组主要由HD-Zip I家族的Vrs1 Clade组成。甘蔗GT1蛋白聚在gt1 Clade类群,且跟高粱和玉米的GT1同源蛋白表现出较近的同源关系。该类群基因主要参与腋分生组织的发育调控,推测甘蔗ScGT1也可能参与了腋分生组织的调控,从而影响甘蔗的分蘖表型。
3 讨论
高的蔗茎产量一直是甘蔗品种选育的重要育种目标,为了培育高产品种,育种者对于品系材料的分蘖特性十分关注。为了进一步提高强分蘖高产品种的选择效率,加大对分蘖性状的分子基础解析,同时挖掘优异分蘖相关基因,然后通过分子技术手段调控品种分蘖性状的表现,最终实现高产是改良品种产量潜力十分重要的途径之一。
HD-Zip I家族基因是一类重要的转录因子,其成员参与了植物的发育调控和逆境胁迫响应[22]。玉米GT1基因是HD-Zip I同源基因,参与玉米腋芽休眠、避荫响应以及最终的株型建成和产量构成,属于分蘖负调控基因[20]。本研究通过RT-PCR和RACE技术从甘蔗中克隆出GT1的同源基因,该基因具723 bp的开放阅读框,编码240个氨基酸,比玉米GT1蛋白氨基酸数多1个,都具有Homeodomain保守结构域且三级结构较为相似,同时分子量、理化等电点和总平均亲水性值只有微小的差异,表明甘蔗和玉米GT1基因在序列、结构和理化性质上十分相似。亚细胞定位分析表明该蛋白可能定位于细胞核,这与Whipple等[20]报道的玉米GT1亚细胞定位结果一致。
同源分析表明,甘蔗GT1蛋白与高粱、玉米、小米、水稻等禾本科植物同源蛋白氨基酸序列结构一致性较高,在HD-Zip I家族蛋白的主要结构域(Homeodomain)上表现出高度的保守性,该结构主要功能为参与植物关键发育过程中的转录调控[23],由此表明甘蔗GT1基因也可能参与了甘蔗关键发育过程的调控,但因在其它结构上与其它禾本科植物存在一定变异,可能导致一些小的功能分化。根据前人研究报道,HD-Zip I家族存在两个旁系同源类群,分别为gt1 Clade和Vrs1 Clade,两个类群的基因都可抑制植物腋分生组织的发育,但gt1 Clade主要抑制营养生长发育,Vrs1 Clade抑制花穗的发育[9,20],针对ScGT1的系统进化分析表明该蛋白聚在gt1 Clade,由此推测,该基因可能像玉米的GT1基因一样参与了分蘖性状的调控,后续应使用基因工程手段进行功能验证。同时鉴于该基因属于转录因子,其调控的下游基因是什么,处于哪条代谢途径上,将成为后续研究的重点方向。

