巯基化纳米TiO2的制备及对痕量镉的吸附性能研究
刘磊,陈蓓蓓,李勤,王艳娇,何锦林
(1.贵州大学 化学与化工学院,贵州 贵阳 550025;2.贵州省分析测试研究院,贵州 贵阳 550001)
重金属污染的治理与监测直接关系到环境的持续发展及人民生活的健康安全。重金属污染物在环境中的存在浓度低,但重金属对环境水质的污染日益严重,长期食用含镉食品可能导致“痛痛病”、 软骨症和自发性骨折等疾病。因此,研究开发水体中痕量镉总量的检测方法,对水产品的安全监管和人民健康安全具有重要意义。
环境水中镉浓度低,基体复杂,常规的检测仪器难以获得理想的数据结果[1]。因此,为提高对环境水中痕量镉的检测精准性和灵敏度,对待测样品中的镉进行有效的富集和分离甚是关键。
由于巯基(—SH)对镉离子具有很强的螯合作用,巯基化改性的TiO2纳米材料其稳定性和对镉离子的吸附选择性有显著提高[2-4],本文制备了巯基化TiO2纳米材料,以期应用于环境水中痕量镉的富集与分离,使用原子吸收分光光度计(连续光源)实现对样品中痕量镉的精确检测。
1 实验部分
1.1 试剂与仪器
盐酸、氢氧化钠、硝酸、钛酸丁酯、乙醇、硝酸镉等均为分析纯;3-(巯基丙基)三甲氧基硅烷(MPTMS),优级纯。
Vertex70型近红外光谱仪(近红外漫反射积分球附件和OPUS 软件);ZEEnit700P原子吸收分光光度计;CENTRA-MDS-LDS-RDS超纯水机;DZF-6050型真空干燥箱;SS-550型扫描电子显微镜。
1.2 吸附材料制备
1.2.1 溶胶-凝胶法制备TiO2纳米材料 取钛醇盐5 g溶解于20 mL乙醇溶液(95%)中,加入0.5 mL 冰醋酸(抑制剂),使之与钛酸丁酯形成螯合物,从而使钛酸丁酯均匀水解,得到均匀胶体溶液。将溶胶在120 ℃真空蒸发、干燥,溶胶逐渐转变为凝胶。将凝胶在250 ℃煅烧1 h,得到白色TiO2纳米材料。
钛酸丁酯的水解反应和缩聚反应[5]如下。
Ti(OR)4+4H2O→Ti(OH)4+4ROH
Ti(OH)4+Ti(OR)4→2TiO2+4ROH
2Ti(OH)4→2TiO2+4H2O
1.2.2 巯基化TiO2纳米材料的制备 将1.5 g TiO2纳米材料、99 mL乙醇和1 mL超纯水加入烧杯中混合,超声振荡20 min,加入0.5 mL MPTMS,在室温及氮气保护下搅拌(280 r/min)6 h。反应结束后,用乙醇和超纯水交替洗涤、抽滤3次,得到MPTMS修饰的TiO2纳米材料,在80 ℃下真空干燥3 h后,得到巯基化TiO2纳米材料。
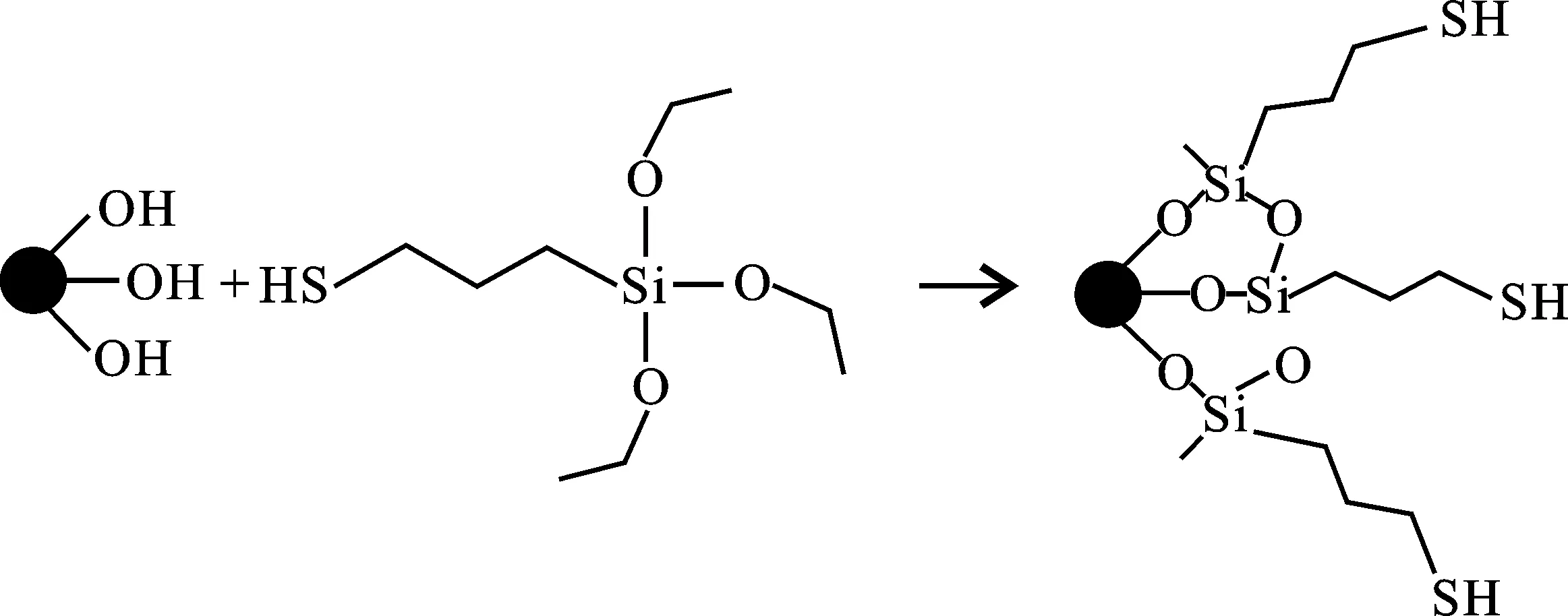
图1 纳米TiO2巯基化反应机理[6]Fig.1 The mechanism of thiolation of nano-TiO2
1.3 Cd2+的富集检测
分别取Cd(Ⅱ)标准溶液150 mL和巯基化TiO2吸附剂(500 mg)加入PET瓶中,用1 mol/L NH3·H2O或1 mol/L HCl 调节pH 值为8,常温下振荡40 min。取上清液,用原子吸收分光光度计(FAAS)测定Cd(Ⅱ)的浓度,计算巯基化TiO2纳米材料的吸附量。
(1)
式中q——吸附容量,μg/g;
c——吸附过程中Cd离子浓度,μg/L;
c0——吸附前Cd离子浓度,μg/L;
V——溶液体积,L;
m——溶剂质量,g。
1.4 巯基含量的测定
使用Ellman方法[7]测定巯基化TiO2纳米材料中 —SH的含量。取0.5 g巯基化TiO2纳米材料,滴加3 mL超纯水,加入1 mL DTNB和0.3 mL的磷酸盐缓冲溶液,室温静置4 h,离心15 min,取上清液测定412 nm处吸光度,计算巯基化TiO2纳米材料中的巯基含量。
1.5 样品中镉的富集检测
样品中加入500 mg巯基化TiO2纳米材料,在最优条件下吸附和洗脱,用原子吸收分光光度计测定洗脱液中离子浓度。
1.6 解析实验
本实验采用HCl溶液为洗脱剂,研究了洗脱效率与洗脱剂浓度之间的关系。实验表明,当HCl溶液浓度在0.05%~1.5%时,随着洗脱剂浓度的增大洗脱效率也随之增大。为保证Cd离子的高效回收,本实验选用浓度2%盐酸为洗脱剂。
2 结果与讨论
2.1 吸附材料表征
2.1.1 TiO2与巯基化TiO2纳米形貌特征 由图2和图3可知,制备的TiO2粉末的粒径在50 nm以下,巯基化TiO2纳米材料大多数微粒的粒径在10~50 nm之间,修饰前后TiO2纳米微粒基本呈球形,由于TiO2纳米材料表面羟基化作用,使得各微粒表面羟基聚合,而产生了一定程度的团聚现象。在极性溶剂中,TiO2纳米材料极易团聚,但是在团聚体中的TiO2颗粒非常明显,由图2和图3对比可知,改性后TiO2纳米材料的团聚现象明显减少,TiO2纳米材料的颗粒大小更加均匀,边界更明显,更有利于颗粒的分散。

图2 TiO2纳米材料SEM图Fig.2 SEM image of TiO2 nanomaterials

图3 巯基化纳米TiO2纳米材料SEM图Fig.3 SEM image of thiolated TiO2 nanomaterials
2.1.2 TiO2和巯基化TiO2的红外光谱 由图4可知,7 097,5 190,5 715,4 358,5 038 cm-1分别归属于O—H的一倍频、O—H 的合频、C—H 的一倍频、C—H 的合频以及S—H 的一倍频,因此可以推断MPTMS已经偶联在TiO2的表面上。

图4 TiO2与巯基化TiO2近红外光谱图Fig.4 Near infrared spectroscopy of TiO2 and thiolated TiO2
2.2 巯基化TiO2纳米材料中巯基含量
由图5可知,当MPTMS的用量小于0.3 mL,巯基化TiO2纳米材料中 —SH含量随着MPTMS用量增大而增加,MPTMS当用量0.3 mL时,巯基化TiO2纳米材料 —SH含量不再增加。因此,选择MPTMS的添加量为0.3 mL,制备的巯基化TiO2纳米材料 —SH含量为3.13 mg/g。

图5 巯基化TiO2纳米材料中 —SH含量与MPTMS的用量的关系Fig.5 Relationship between the content of —SH and theamount of MPTMS in thiolated TiO2 nanomaterials
2.3 pH对镉离子吸附性能的影响
吸附介质的pH值对Cd(Ⅱ)在巯基化TiO2纳米材料表面的吸附率有很大影响[8-9],由图6可知,pH<8时,随着pH的增加,巯基化TiO2纳米材料对Cd(Ⅱ)的吸附率增大,pH=8时,吸附率达到最大,pH>8时吸附率不再增大,吸附量趋于稳定。未改性的TiO2纳米材料,pH<10时,随着pH的降低,其吸附性能急剧下降,当pH<4时,基本不发生吸附反应。

图6 pH值对吸附量的影响Fig.6 Effect of pH on adsorption
2.4 吸附时间的影响
由图7可知,pH=8,随吸附时间增加,巯基化TiO2纳米材料对Cd离子的吸附量增大,吸附时间为40 min时,吸附基本达到平衡,吸附量高达195.5 μg/g。40 min后,其吸附量不再增加。因此,本实验选择最佳吸附时间为40 min。

图7 吸附时间对吸附量的影响Fig.7 Effect of adsorption time on adsorption
2.5 吸附等温线
研究了不同温度下巯基化TiO2纳米材料对Cd离子的吸附等温线,由图8可知,巯基化TiO2纳米材料对Cd离子的吸附量随着Cd离子浓度的增大逐渐增大。实验数据拟合表明,本实验巯基化TiO2纳米材料对Cd离子的吸附行为符合Langmuir等温吸附(R2=0.999 2),Langmuir吸附常数(b)为0.017 L/m,其最大吸附量(qm)可达到60.8 mg/g。
式中qe——平衡吸附量,mg/g;
qm——最大吸附量,mg/g;
Ce——溶液的平衡浓度,mg/L;
KL——Langmuir常数,L/mg。

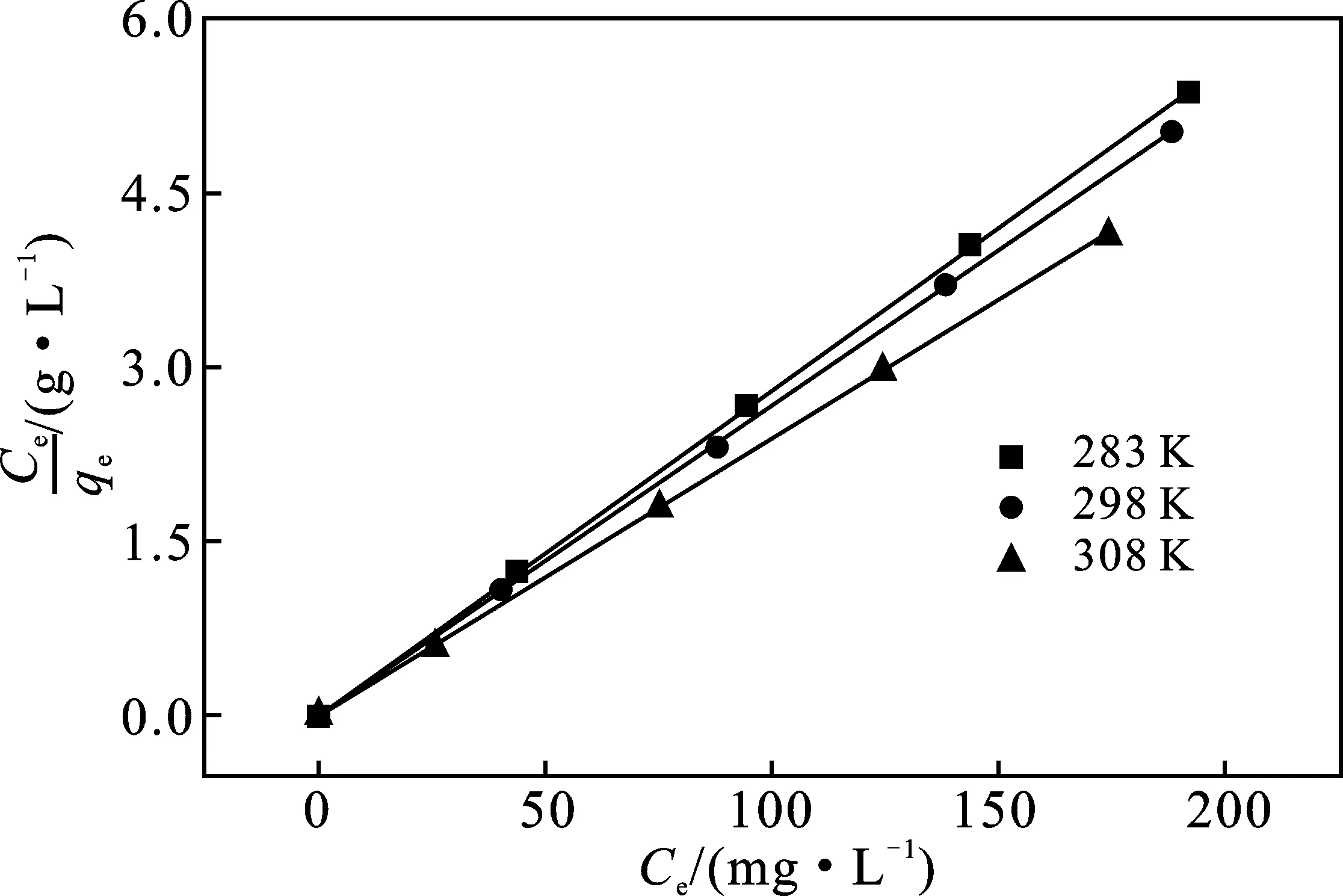
图8 不同温度下Cd离子Langmuir线性拟合等温线Fig.8 Langmuir linear fitting isotherms of Cdions at different temperatures
3 结论
通过溶胶-凝胶法制备纳米TiO2,并进行巯基化表面改性,巯基化TiO2纳米颗粒直径小于100 nm,吸附介质pH=8,吸附时间40 min时可达到最大吸附,使用浓度2%(体积比)HCl溶液为洗脱剂,可将镉离子洗脱下来。巯基化TiO2纳米材料可有效富集样品中的痕量镉离子,并借助原子吸收分光光度计(FAAS)对提高痕量镉检测的灵敏度和准确性起着重要作用。

