海洋低温甾醇酯酶菌株的筛选鉴定及其酶学特性研究
任楠楠,王晓辉,迟乃玉,张庆芳*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
甾醇酯酶(EC 3.1.1.13),又称为胆固醇酯酶,在生物体(如一些高等动物的脏器官、原生动物和微生物)中广泛存在[1]。作为一种酯类水解酶,甾醇酯酶可催化甾醇酯水解生成甾醇和脂肪酸,同时,在适宜条件下也可通过酯化或酯交换反应催化甾醇酯合成。甾醇酯酶可广泛应用于食品、医药和化工产业等[2]。在食品领域中,植物甾醇作为新资源,是食品研发的热点,但植物甾醇在食品体系中会出现结晶现象,稳定性也不及甾醇酯,因此考虑用甾醇酯酶将植物甾醇改性转变成植物甾醇酯,制成功能性食品[3-5];在医药方面,甾醇酯酶可作为工具酶制成试剂盒,测定胆固醇含量,但目前所使用的大多数试剂盒均来自进口,价格昂贵[6];在化工业中,甾醇酯酶可与脂肪酶联合使用,解决“树脂障碍”问题[7-9]。目前,国内外已有关于微生物来源的甾醇酯酶的研究[10-11],但是鲜见从海洋中筛选产甾醇酯酶的低温菌株的相关报道,且国内几乎没有相关商品化的甾醇酯酶的生产。
本研究拟从海洋环境中选育出一株能够高产甾醇酯酶的低温菌株,对该菌株进行系列鉴定,初步探究其产酶特点,为后期海洋低温甾醇酯酶的实际生产与应用奠定理论基础[12]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
试验菌株筛选自辽宁省大连渤海湾(N:39°7′,S:121°41′)的海泥海水样品。
1.1.2 培养基
菌株初筛培养基:植物甾醇酯30.0 g/L,聚乙烯醇10.0 g/L,琼脂粉20.0 g/L,KH2PO41.0 g/L,MgSO4·7H2O 0.1 g/L,CaCl20.1 g/L,(NH4)2SO41.0 g/L,NaCl 0.5 g/L,用0.22 μm的滤膜对0.1%罗丹明B过滤灭菌,加入培养基中,pH自然。
菌株复筛培养基:植物甾醇酯10.0 g/L,酵母粉5.0 g/L,KH2PO42.0 g/L,MgSO4·7H2O 0.5 g/L,(NH4)2SO41.0 g/L,葡萄糖10.0 g/L,pH自然。
种子培养基:胰蛋白胨10.0 g/L,牛肉膏5.0 g/L,NaCl 10.0 g/L,pH 7.0。
(Luria-Bertani)LB培养基:胰蛋白胨10.0 g/L,酵母浸粉5.0 g/L,琼脂20.0 g/L,NaCl 10.0 g/L,pH 7.0。
以上培养基均在0.1 MPa、121℃高压蒸汽灭菌20 min。
1.1.3 试剂
植物甾醇酯:江苏春之谷生物制品有限公司;罗丹明B:国药集团化学试剂有限公司;胆固醇氧化酶(cholesterol oxidase,COD):上海源叶生物科技有限公司;辣根过氧化物酶(horseradish peroxidase,POD):生工生物(上海)股份工程有限公司;胆固醇亚油酸酯、4-氨基安替吡啉(4-aminoantipyrine,4-AA):大连凯美化工工程配套有限公司;其他主要试剂均为国产分析纯。
1.2 仪器与设备
LDZX-40BI压力蒸汽灭菌锅:上海申安医疗器械厂;HD-1360型超净工作台:北京东联哈尔仪器有限公司;BA410E生物显微镜:麦克迪奥实业集团有限公司;雷磁PHS-3E pH计:上海仪电科学仪器股份有限公司;HZP-256全温振荡培养箱:上海智诚分析仪器制造有限公司;Thermo K3型酶标仪:北京昊诺斯科技有限公司;0.22μm一次性针头滤器:生工生物(上海)股份工程有限公司。
1.3 方法
1.3.1 菌株筛选
菌株初筛:称取10.0 g样品加入90 mL无菌水中,摇床振荡30 min后过夜富集培养。用无菌水梯度稀释富集菌液,取适宜浓度的菌液100μL均匀涂布于菌株初筛培养基上,在恒温培养箱内28℃倒置培养[12],观察培养基中菌株生长情况,挑取阳性菌落进行纯化并保存。
菌株复筛:将初筛得到菌株进行摇瓶发酵培养(200 r/min),检测菌株产甾醇酯酶活性高低,逐步筛选出目的高产菌株[12],作为本次试验的出发菌株。
1.3.2 甾醇酯酶活性测定方法
根据甾醇酯酶活性的测定原理[13]进行酶活性测定,具体操作参考曾诚等[14]的报道:分别配制底物溶液(在0.15 mol/L磷酸缓冲液中先后加入胆固醇亚油酸酯0.61 mmol/L,异丙醇8.0%,0.015 Triton X-100 mol/L,调节pH 为7.0)与4-AA-苯酚工作液(0.15 mol/L磷酸缓冲液中分别加入1.48 mmol/L 4-AA,3.0 IU/mL POD,0.5 IU/mL COD,0.01 mmol/L苯酚,pH 7.0),将两者按照1∶2的比例混合,再加入适量酶液,充分混合后于37℃水浴条件下反应15 min,以灭活酶液作为对照,测量波长500 nm处的紫外吸光度值,平行3次,取平均值。
酶活定义:在测定条件下,每分钟催化1μmol底物水解所消耗的酶量为一个酶活单位(IU)。
1.3.3 菌株鉴定
(1)菌株形态学鉴定
将试验菌株在固体培养基(LB琼脂平板)上划线,30℃恒温培养,观察菌株单菌落形态特征,挑取单菌落,进行革兰氏染色,观察单个菌株形状、大小、排列方式等并拍照记录。
(2)菌株生理生化特征鉴定
参照《常见细菌系统鉴定手册》[15]及《微生物实验技术》[16]鉴定试验菌株的生理生化特征。
(3)菌株分子生物学(16S rDNA)鉴定
提取复筛得到的试验菌株的基因组DNA,以它为模板进行聚合酶链式反应(polymerase chain reaction,PCR),将反应产物送至上海生工进行电泳分析与双向测序。在美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站上的GenBank数据库中,将测序结果通过BLAST与已知菌种的16S rDNA序列进行同源性比对,确定目的菌株的种属。选择若干条同源性较高的已知菌株的序列,在MEGA6.06软件中利用Neighbor-Joining法(Bootstrap参数为1 000)构建系统发育树,确定其分类地位。1.3.4酶学性质的初步研究
(1)甾醇酯酶最适作用温度
依据甾醇酯酶活性的测定方法,分别在不同温度条件下(15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃)对发酵得到的粗酶液进行酶活测定[12]。将同组实验中最高酶活的相对值设为100%,做3组平行实验。
(2)甾醇酯酶的热稳定性
将发酵得到的粗酶液在不同的温度条件下(20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃)水浴静置2 h,立即冷却,依据甾醇酯酶活性测定方法测定酶活,将同组实验中最高酶活的相对值设为100%,做3组平行实验。
(3)甾醇酯酶最适作用pH
分别向不同pH值(5.0、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0)的缓冲溶液中加入发酵得到的粗酶液,依据甾醇酯酶活性测定方法测定酶活,将同组实验中最高酶活的相对值设为100%,做3组平行实验。
(4)甾醇酯酶的pH稳定性
在最适作用温度条件下,向不同pH值(4.0、5.0、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0)的缓冲液中加入粗酶液,静置2 h,依据甾醇酯酶活性测定方法测定酶活,将同组实验中最高酶活的相对值设为100%,做3组平行实验。
(5)不同化学物质对甾醇酯酶活性的影响
以原始的发酵粗酶液为对照,设定其相对酶活为100%,向原始发酵粗酶液中分别加入一定浓度的各类化学物质,测定甾醇酯酶活性,做3组平行实验。
2 结果与分析
2.1 菌株的筛选
从渤海湾海泥海水样品中初步筛选分离得到了7株具有甾醇酯酶活性的菌株,从中选取一株长势良好、产甾醇酯酶活性较高的菌株,命名为Q-06。在-20℃条件下对菌株进行甘油保藏,用于后续实验。
2.2 菌株形态学鉴定
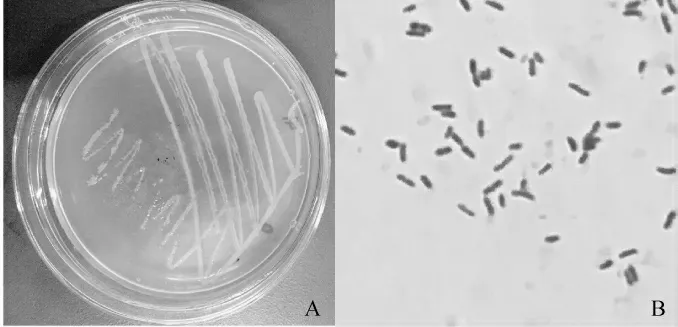
图1 菌株Q-06菌落形态(A)及显微形态(B)Fig.1 Colonial morphology(A)and microscopic morphology(B)of strain Q-06
从图1可以看出,菌株Q-06的单菌落较小,近似圆形,边缘整齐,呈淡黄色,不透明,菌落湿润,用接种环易挑取;在显微镜下可观察到菌株呈杆状,自由排列,革兰氏染色结果呈阴性。
2.3 菌株生理生化特性
参照《常见细菌系统鉴定手册》对菌株Q-06进行生理生化试验,结果见表1。

表1 菌株Q-06的生理生化特征Table 1 Physiological and biochemical characteristics of strain Q-06
由表1可知,菌株Q-06生理生化特征如下:氧化酶试验、接触酶试验呈阳性,能够氧化分解葡萄糖,不能还原硝酸盐,伏普(VP)试验、硫化氢产生试验、甲基红(methyl-red,MR)试验、淀粉水解试验、明胶水解试验均呈阴性,精氨酸双水解酶试验、吲哚乙酸试验呈阳性。根据菌株菌落形态特征,显微观察及《常见细菌系统鉴定手册》,初步鉴定该菌株为假单胞菌属(Pseudomonas sp.)
2.4 分子生物学(16S rDNA)鉴定与系统发育树的构建
对菌株Q-06的DNA样品进行PCR扩增目的片段,并进行琼脂糖凝胶电泳,结果见图2。由图2可知,经PCR扩增得到产物序列长度为1 489 bp。
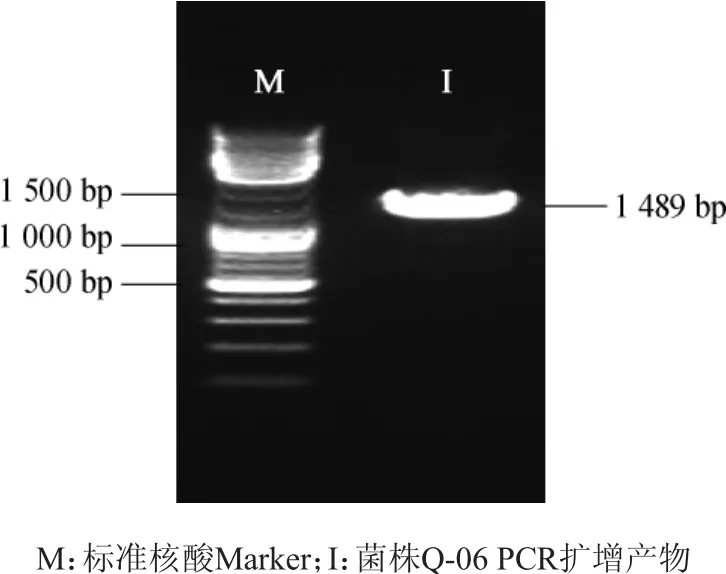
图2 菌株Q-06 16S rDNA PCR扩增产物的琼脂糖凝胶电泳Fig.2 Electrophoregram of 16S rDNA PCR amplification products of strain Q-06
将菌株Q-06的16S rDNA测序结果提交至GenBank数据库,从中选出同源性高的序列与菌株Q-06的16S rDNA基因序列进行比对,用MEGA6.06软件构建系统发育树,结果见图3。由图3可知,菌株Q-06与Pseudomonas fragi strain(NR 112077.1)相似系数接近100%,在系统发育树上聚于同一分支。因此,可以鉴定菌株Q-06为莓实假单胞菌(Pseudomonas fragi)。
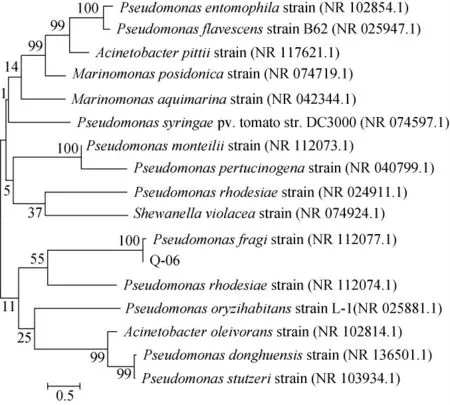
图3 菌株Q-06的16S rDNA序列系统发育树Fig.3 Phylogenetic tree of strain Q-06 based on 16S rDNA sequences
2.5 酶学性质研究
2.5.1 甾醇酯酶最适作用温度
由图4可知,当作用温度低于30℃时,该甾醇酯酶活性随着温度升高而逐渐增大,30℃为最适反应温度,酶促反应温度达到40℃后,酶活性急剧下降,在25~40℃的范围内,相对酶活可保持70%以上,温度高于45℃时,相对酶活在50%以下。由此可以看出该甾醇酯酶对高温条件比较敏感,并且在低温条件下的活性相对较高。这一特性可能会有利于该低温酶在实际生产中的应用[17]。
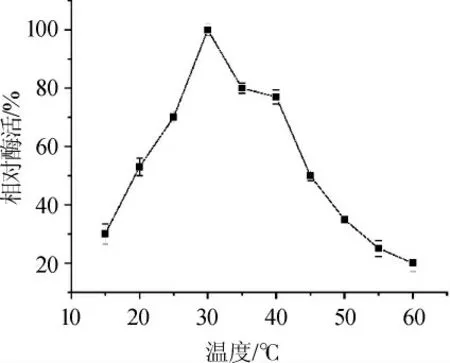
图4 甾醇酯酶最适作用温度曲线Fig.4 Optimal reaction temperature curve of the sterol esterase
2.5.2 甾醇酯酶的热稳定性
对发酵粗酶液进行不同温度的水浴处理,2 h后测定酶活性,结果见图5。由图5可知,发酵粗酶液在25~40℃条件下处理2 h后依然能保持高酶活性。但当温度由30℃逐渐升高时,酶活性呈逐渐下降的趋势,在45℃处理2 h后,相对酶活不足40%。由此判断,该菌株产酶的热稳定性较低。
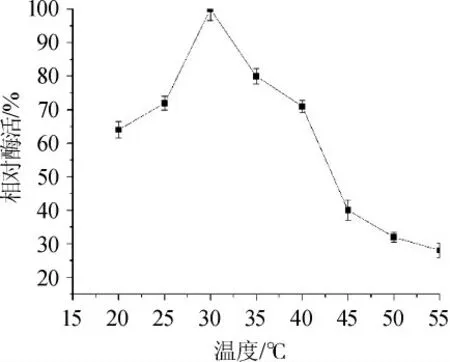
图5 甾醇酯酶的热稳定性Fig.5 Thermostibility of the sterol esterase
2.5.3 甾醇酯酶的最适作用pH及稳定性
由图6可知,该甾醇酯酶的最适作用pH值为7.0,为中性酶。当pH值≤6.0或≥8.0时,酶活性较低;pH在6.5~8.0的范围内,其酶活可保持70%以上;观察该甾醇酯酶的pH稳定性折线可知,在pH 7.0~8.0的范围内,酶活可保持在80%以上,当pH≥8.5时,活性迅速下降。由此可以判断:在中性至弱碱性条件下,甾醇酯酶活性较高,较稳定,即该甾醇酯酶有一定的耐弱碱性。
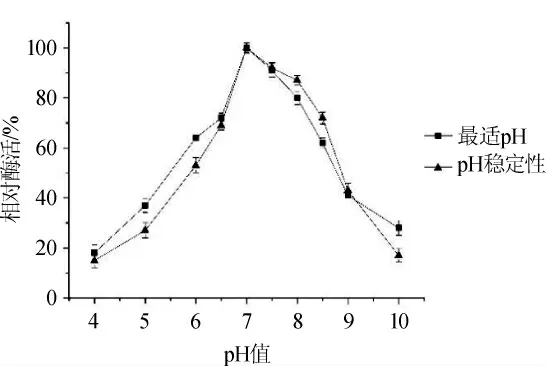
图6 甾醇酯酶的最适pH及其pH稳定性曲线Fig.6 Optimal pH and pH stability curve of the sterol esterase
2.5.4 不同化学物质对酶活性的影响
由表2可知,不同的金属离子对甾醇酯酶酶活性影响不尽相同。其中,Ag+有较强的抑制作用,Cu2+、Co2+、Mn2+、Fe3+也能不同程度地抑制甾醇酯酶活性,Zn2+、Mg2+、Ca2+对酶活影响比较微弱。金属螯合剂乙二酸四乙酸(ethylene diamine tetraacetic acid,EDTA)、蛋白质变性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS)均可对甾醇酯酶活性产生强烈的抑制作用。
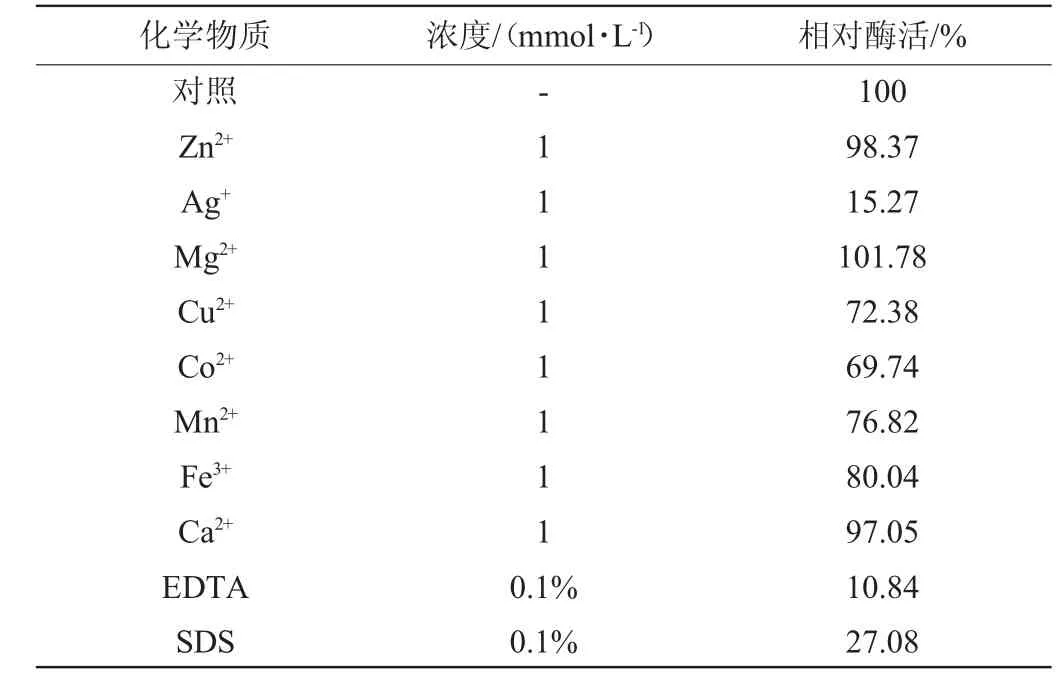
表2 不同化学物质对甾醇酯酶活性的影响Table 2 Effect of different chemical substances on sterol esterase activity
3 结论
本研究所使用的出发菌株筛选自渤海湾的海泥海水样品,先后通过初筛与复筛获得了一株高产甾醇酯酶菌株,命名为Q-06。菌株Q-06经过形态特征、生理生化实验和16SrDNA序列分析等综合检测,被鉴定为莓实假单胞菌(Pseudomonas fragi)。初步探索其产甾醇酯酶的酶学特性,结果显示,该菌株产甾醇酯酶的最适作用温度和pH值分别为30℃和7.0。该酶属于低温酶类,但随着温度的变化,酶的稳定性变差,并且该酶表现出一定的耐弱碱性;Ag+对酶的抑制性较强,Cu2+、Co2+、Mn2+、Fe3+也能不同程度地对甾醇酯酶活性产生抑制作用,而Zn2+、Mg2+、Ca2+则对酶的作用比较微弱,基本无影响;EDTA及SDS均对甾醇酯酶的活性表现出明显的抑制性。与国内外筛选的其他产甾醇酯酶的菌株相比[18-20],该酶最适作用温度低,在低温下具有高酶活力及高催化效率。因此,菌株Q-06作为一株产甾醇酯酶的新菌源,具有潜在的开发价值。下一阶段将从甾醇酯酶的分离纯化及菌株产酶优化等方面进行深入探究,以期为甾醇酯酶的规模化发酵奠定理论基础。

