鼠李糖乳杆菌GG发酵驼乳与牛乳的发酵特性和降糖活性比较
,2,2,*
(1.内蒙古农业大学食品科学与工程学院,乳品生物技术 与工程教育部重点实验室,内蒙古呼和浩特 010018; 2.内蒙古骆驼研究院,内蒙古阿拉善 750306)
糖尿病是一种以高血糖为主要特征的代谢性疾病[1]。随着人们生活水平的提高,糖尿病已经成为危害人类健康的一大疾病。因此严格控制血糖水平,是缓解糖尿病的主要措施。目前使用的降糖药具有一定的疗效,但其副作用大、长期服用会对人体自身造成一定的损害[2]。因此,研发各类副作用小、能兼顾治疗并发症的药物,特别是天然物质在治疗糖尿病方面受到日益重视[3]。
驼乳营养结构独特,易于消化吸收,富含蛋白质、不饱和脂肪酸、维生素和人体所需的矿物质等营养成分,具有很高的营养和保健价值[4]。在辅助治疗糖尿病方面也格外突出,其降糖因子如乳铁蛋白、免疫球蛋白等保护性蛋白及维生素C等均高于牛乳[5-6]。已有研究发现,驼乳能显著降低糖尿病小鼠的血糖水平,会明显降低其空腹血糖[7-9]。Sahani等[10]也对驼乳的口服降血糖活性进行了对照研究,发现驼乳喂养的大鼠与牛乳喂养的大鼠相比,平均血糖水平显著降低,表明驼乳对糖尿病的辅助治疗有一定的作用。
乳中发挥作用的主要物质是生物活性肽,乳源性生物活性肽是以乳蛋白为原料经过分离纯化得到的具有特殊生物活性的一类物质[11]。目前主要采用酶解和发酵的方法制备乳源性生物活性肽。发酵法是制备生物活性肽最传统的方法,因其独特的蛋白酶系统,可制备功能丰富的生物活性肽,受到人们的广泛关注[12]。目前,多采用植物乳杆菌、嗜酸乳杆菌、瑞士乳杆菌等乳酸菌发酵,其中的鼠李糖乳杆菌GG能够耐受并定植于动物消化道,可调节肠道菌群、排除毒素、提高机体免疫力等功能特性,受到人们的青睐[13]。已有研究表明,鼠李糖乳杆菌发酵动物乳,可产生具有降压、抗氧化等生物活性的肽[14]。因此,本试验预采用耐酸、耐氧、定植力强及功能性丰富的鼠李糖乳杆菌GG发酵驼乳和牛乳,通过一系列的发酵乳指标及α-淀粉酶和α-葡萄糖苷酶抑制活性的研究,比较不同发酵乳的发酵性能和体外降糖活性,以期找到一种辅助治疗糖尿病的天然物质。
1 材料与方法
1.1 材料与仪器
双峰驼乳 内蒙古阿拉善盟阿拉善右旗养驼户提供;牛乳 内蒙古呼和浩特市养牛户提供;鼠李糖乳杆菌GG(ATCC7469)、MRS琼脂培养基、MRS肉汤培养基 广东环凯微生物科技有限公司;1,4-二巯基苏糖醇(1,4-Dithiothreitol,DTT,纯度为99%)、α-淀粉酶(40000 U/g)、可溶性淀粉、DNS试剂 北京索莱宝科技有限公司;α-葡萄糖苷酶(10000 U/g)、十二烷基硫酸钠(Sodium dodecyl sulfate,SDS) 美国Sigma公司;对硝基苯基-α-D-吡喃葡萄糖苷(p-Nitrophenylα-D-glucopyranoside,pNPG) 上海源叶生物科技有限公司;邻苯二甲醛(o-Phthalaldehyde,OPA,纯度为97%) 天津市光复精细化工研究所;其他试剂 均为分析纯。
FE28pH计 上海梅特勒-托利多仪器有限公司;5810R高速冷冻离心机 德国艾本德有限公司;BJ-2CD净化工作台 上海博讯实业有限公司;GHP-9270隔水式恒温培养箱 上海一恒科学仪器有限责任公司;Synergy H1多功能微孔板检测仪 美国伯腾实验仪器有限公司。
1.2 实验方法
1.2.1 菌种活化培养 鼠李糖乳杆菌GG于脱脂乳中-80 ℃保存备用,按2%的接种量接种到MRS肉汤培养基中活化传代,在37 ℃恒温静置培养24 h,直至第三代。为了保持乳酸菌的活性,每周进行一次活化培养。
取三代鼠李糖乳杆菌GG培养液,在4000 r/min,4 ℃条件下离心15 min,收集菌体,用0.85%生理盐水洗涤2次后,混匀制成供试菌悬液(>8.00 lg CFU/mL),以供后续试验使用。
1.2.2 鼠李糖乳杆菌GG生长曲线的测定 活化培养的二代鼠李糖乳杆菌GG接种到MRS肉汤培养基中,37 ℃恒温培养48 h,每隔1 h采样。取200 μL上述混匀的接种液加入到检测孔板中,做三个重复孔,在600 nm处测定吸光度[15]。以发酵时间为横坐标,吸光度值为纵坐标,绘制鼠李糖乳杆菌GG生长曲线。
1.2.3 原料乳预处理 原料乳(驼乳和牛乳)经离心脱脂(6000 r/min,30 min,4 ℃),并巴氏消毒杀菌(90 ℃,10 min),冷却至37 ℃备用。
1.2.4 发酵乳的制备 按3%的接种量将1.2.1中得到的菌悬液接种于处理好的原料乳中,在37 ℃下静置培养24 h。取出后置于4 ℃下储藏28 d,并在不同发酵时间(3、6、9、12、15、18、21和24 h)和储藏时间(0、7、14、21和28 d)采样。
1.2.5 指标测定
1.2.5.1 pH测定 pH直接用FE28 pH计测定。
1.2.5.2 滴定酸度测定 取10 g发酵乳于三角瓶中,加入20 mL蒸馏水,滴入2~3滴酚酞指示剂,用浓度为0.1 mol/L的NaOH标准溶液滴定,不断轻微摇动,直至微红色在30 s内不消失为止[16]。发酵乳的滴定酸度按下面公式计算。

式中:c表示标准NaOH的浓度,mol/L;v表示滴定所消耗标准NaOH的体积,mL;m表示样品质量,g;0.1表示酸度理论定义NaOH的摩尔浓度,mol/L。
1.2.5.3 乳酸菌活菌数测定 称取25 mL发酵乳放于225 mL无菌生理盐水中,充分振摇后形成均匀的稀释液。用无菌生理盐水进行梯度稀释。取合适稀释度的溶液1 mL于无菌培养皿中,倒入50 ℃左右的灭菌MRS琼脂培养基,立即混匀,待凝固后倒置,37 ℃培养(48±1) h。观察菌落生长情况,并计数,每个梯度重复3次取平均值[17]。
1.2.6 发酵乳水溶性提取物的制备 发酵乳经离心分离(8000 r/min,15 min,4 ℃),取上清液于0.45 μm过滤器过滤,置于-20 ℃保存。
1.2.7 发酵乳蛋白质水解活性的测定
1.2.7.1 OPA试剂的配制 200 mg十二烷基硫酸钠,7.62 g四硼酸钠,160 mg邻苯二甲醛,4 mL乙醇和176 mg 1,4-二巯基苏糖醇定容到200 mL,避光冷藏。
1.2.7.2 酪氨酸标准曲线的绘制 将酪氨酸配制成不同浓度(0、100、200、300、400和500 μg/mL)的标准溶液,分别取400 μL标准溶液加入3 mL的OPA试剂,漩涡混匀5 s,在室温下反应2 min后,测定340 nm处的吸光度。以酪氨酸浓度为横坐标,吸光度值为纵坐标,绘制酪氨酸标准曲线。所得标准曲线方程为y=0.0018x+0.005,R2=0.997。
1.2.7.3 蛋白质水解活性的测定 准确吸取1.2.6所得的发酵乳水溶性提取物400 μL,加入3 mL的OPA试剂,漩涡混匀5 s,室温下反应2 min后,在340 nm处测定其吸光度。对应酪氨酸标准曲线得出相当于酪氨酸的量,以此反映蛋白质水解活性[18]。
1.2.8α-淀粉酶抑制活性的测定 吸取1.2.6所得的发酵乳水溶性提取物100 μL及1 U/mL的α-淀粉酶(用pH6.8,0.1 mol/L的磷酸缓冲液配制)100 μL于试管中,混匀后于37 ℃恒温反应5 min,再加入250 μL 1%淀粉溶液(用pH6.8,0.1 mol/L的磷酸缓冲液配制),混匀后于37 ℃恒温反应5 min,加入200 μL的DNS试剂,反应液于沸水浴中加热15 min后取出,并于冰水浴中迅速冷却,再加入2 mL蒸馏水,于540 nm处测定吸光度,记作A样品。以磷酸缓冲液代替样品,其它条件同A样品,记作A对照。以磷酸缓冲液代替酶,其它条件同A样品,记作A空白[19]。
抑制率(%)=[1-(A样品-A空白)/A对照]×100
1.2.9α-葡萄糖苷酶抑制活性的测定 吸取1.2.6所得的发酵乳水溶性提取物50 μL及1 U/mL的α-葡萄糖苷酶(用pH6.8,0.1 mol/L的磷酸缓冲液配制)100 μL于试管中,混匀后于37 ℃恒温反应10 min,加入50 μL 5 mmoL/L的pNPG溶液(用pH6.8,0.1 mol/L的磷酸缓冲液配制),混匀,37 ℃恒温反应30 min,再加入0.1 moL/L的Na2CO3溶液1 mL,并于400 nm处测定吸光度,记作A样品。以磷酸缓冲液代替样品,其它条件同A样品,记作A对照。以磷酸缓冲液代替酶,其它条件同A样品,记作A空白[19]。
抑制率(%)=[1-(A样品-A空白)/A对照]×100
1.3 数据处理
所得数据均用SPSS 16.0和Microsoft Excel 2010进行数据处理、统计分析和作图。各组实验均重复三次,以平均值(Mean)±标准偏差(Standard deviation)来表示,采用ANOVA进行邓肯氏(Duncan’s)差异分析,以P<0.05表示差异显著。
2 结果与分析
2.1 鼠李糖乳杆菌GG的生长曲线
鼠李糖乳杆菌GG在0~48 h的生长曲线,如图1所示。
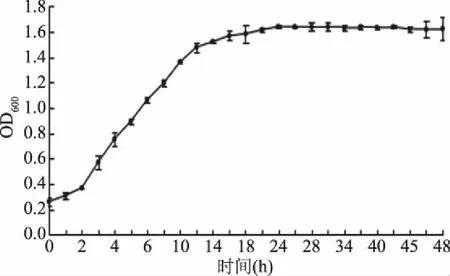
图1 鼠李糖乳杆菌GG生长曲线Fig.1 The growth curve of Lactobacillus rhamnosus GG
由图1可知,鼠李糖乳杆菌GG在培养2 h后进入生长对数期。在2~14 h内,菌液OD600值迅速升高,随后逐渐进入稳定期。当培养至24 h时,菌液的OD值出现最高值,其原因可能是随着鼠李糖乳杆菌GG的生长繁殖,代谢产物不断积累,到24 h时吸光度达到最大1.64±0.01。因此,鼠李糖乳杆菌在24 h时活力较强,适合接种于原料乳中,并且具有良好的发酵特性。
2.2 发酵指标测定结果
2.2.1 发酵乳的pH和滴定酸度 如图2可知,随着发酵时间的增加,发酵驼乳和发酵牛乳二者的pH都呈下降的趋势,在发酵24 h时,达到最低。如图3,在冷藏期间由于发酵乳的后酸化现象,导致冷藏28 d时达最低,而两种发酵乳的滴定酸度(图4、图5)呈上升的趋势,冷藏28 d时达最高。可以看出pH与滴定酸度存在极强的负相关(发酵驼乳r=-0.97,发酵牛乳r=-0.96,数据表未显示,下文同)。可能的原因是随着鼠李糖乳杆菌GG的生长繁殖,分解乳糖产生乳酸的效率增加,代谢产物(如乳酸等)不断积累,整个发酵体系的酸度也随之升高。冷藏后,发酵乳出现后熟现象,酸度继续上升[20]。发酵驼乳的pH较发酵牛乳低,滴定酸度较发酵牛乳高,这可能是由于原料乳成分不同所致。研究表明,驼乳成分不同于牛乳,其蛋白质、乳糖、干物质和灰分等成分含量均高于牛乳[21]。驼乳的蛋白质种类也十分丰富,还有一些短肽、氨基酸和维生素等生长因子含量较高。可认为是驼乳的营养成分营造出了利于鼠李糖乳杆菌GG生长的环境,使其更易生长繁殖,发酵驼乳因此能产生更多的有机酸。
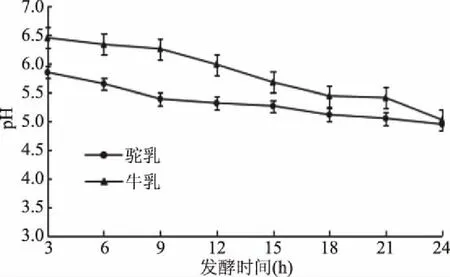
图2 不同发酵时间发酵乳的pHFig.2 pH of fermented milk at different fermentation time
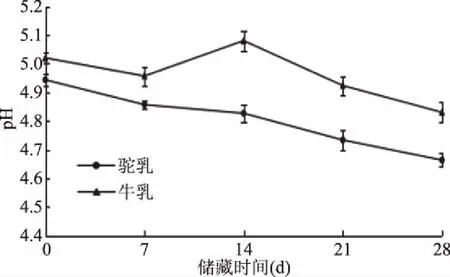
图3 不同储藏时间发酵乳的pHFig.3 pH of fermented milk at different storage time

图4 不同发酵时间发酵乳的滴定酸度Fig.4 Titratable acidity of fermented milk at different fermentation time

图5 不同储藏时间发酵乳的滴定酸度Fig.5 Titratable acidity of fermented milk at different storage time
2.2.2 发酵乳的活菌数 发酵乳中乳酸菌的活菌数一方面反映了发酵乳的保健功效,另一方面反映了发酵乳的储藏性能,对于发酵乳是一个重要的参考指标[22-23]。根据图6的发酵曲线可知,鼠李糖乳杆菌GG在发酵期间利用原料乳中的营养物质促进自身的生长繁殖,使得两种发酵乳的活菌数整体都呈上升的趋势。图7可以看出,随着储藏时间的不断延长,发酵乳酸度过高,鼠李糖乳杆菌GG利用的氮源等一些生长因子也消耗殆尽,已不利于菌体的生长,使菌体逐渐衰亡;也可能是鼠李糖乳杆菌GG是嗜温性细菌,在4 ℃的储藏条件下处于冷应激状态,使得储藏期间的活菌数一直下降[24]。但两种发酵乳的活菌数在储藏期间仍大于8.00 lg CFU/mL,符合国标中发酵乳活菌数的要求,这也与Moslehishad等[14]研究的结果所一致。

图6 不同发酵时间发酵乳的活菌数Fig.6 Bacterial counts of fermented milk at different fermentation time

图7 不同储藏时间发酵乳的活菌数Fig.7 Bacterial counts of fermented milk at different storage time
经过相关性分析可以发现,发酵乳的活菌数与pH有一定的关系,表现为极强的负相关(发酵驼乳r=-0.93,发酵牛乳r=-0.92)。发酵期间原料乳营养物质丰富,鼠李糖乳杆菌GG处于增长期,导致在该时期鼠李糖乳杆菌GG生长繁殖旺盛,活菌数不断增加,pH不断下降。在储藏期间,由于外界温度和发酵乳酸度的变化,影响了鼠李糖乳杆菌GG的生长,使其增殖受到抑制[25],活菌数和pH呈下降的趋势。
2.3 发酵乳的蛋白质水解活性
蛋白质水解活性是表明发酵产品健康作用的初步指标,OPA法可以评估发酵产品中的游离氨基酸和小肽的含量[26]。酪氨酸当量越高,表明水解的程度也越大。乳酸菌可提供几种蛋白质水解酶,如蛋白酶、肽酶和氨基肽酶等,可提高乳中的蛋白水解程度[27]。由图8、图9所示,在整个发酵和储藏期间,酪氨酸当量显著增加,并高于未发酵乳,表明蛋白质水解的程度也不断增加。说明鼠李糖乳杆菌GG是一种蛋白水解菌株,并且随着时间的延长,鼠李糖乳杆菌GG不断生长繁殖,代谢产物不断积累,使得蛋白水解活性增加[28]。在发酵和储藏期间,发酵驼乳的酪氨酸当量基本都高于发酵牛乳,表明发酵驼乳的蛋白质水解活性明显高于发酵牛乳,这与Shori等[29]研究结果相一致。导致这个结果的原因一方面可能由于驼乳中蛋白质含量高,使得酶水解的底物含量变高;另一方面可能是由于鼠李糖乳杆菌GG所产生的蛋白水解酶与驼乳中的酪蛋白作用效果更好,使得蛋白质水解活性提高。

图8 不同发酵时间发酵乳的蛋白质水解活性Fig.8 Proteolytic activity of fermented milk at different fermentation time注:不同小写字母表示相同乳在不同时间下差异显著(P<0.05);不同大写字母表示不同乳在同一时间下差异显著(P<0.05)。不同字母表示差异显著;相同字母表示差异不显著(P>0.05);图9~图13同。

图9 不同储藏时间发酵乳的蛋白质水解活性Fig.9 Proteolytic activity of fermented milk at different storage time
发酵驼乳和发酵牛乳的OPA值与滴定酸度呈极强的正相关(发酵驼乳r=0.96,发酵牛乳r=0.92),可能是由于菌株发酵原料乳提高了蛋白质水解活性和乳糖代谢所致。此外,由于相对较高的蛋白质水解活性,使得发酵后的驼乳生物活性提高。
研究发现,蛋白质水解活性与鼠李糖乳杆菌GG的生长繁殖有密切关系。在发酵过程中,随着鼠李糖乳杆菌GG的生长繁殖,蛋白质水解活性也不断增加。在储藏时期,发酵驼乳中酪蛋白水解和多肽继续分解,酪氨酸当量继续升高。发酵牛乳在储藏14 d前,蛋白质水解活性增加,而在储藏14 d后,由于鼠李糖乳杆菌GG在低温和酸胁迫的条件下,使得鼠李糖乳杆菌GG的代谢活动发生改变,酪蛋白降解和多肽分解释放氨基酸的速度减慢,表现为酪氨酸当量无显著差异(P>0.05)。
2.4 发酵乳的降糖活性
抑制α-淀粉酶和α-葡萄糖苷酶活性是体外测定降糖活性最常用的指标,二者是通过阻碍食物中的淀粉及其他碳水化合物的消化和分解,选择性的减少糖分摄取,从而降低血糖水平[30-31]。因此,抑制α-淀粉酶和α-葡萄糖苷酶的活性在防治糖尿病方面具有巨大的潜力。从图10、图11整体看出,发酵驼乳和发酵牛乳都具有较强的α-淀粉酶抑制活性,并且都高于未发酵的原料乳,这是由于未经发酵原料乳中的蛋白质没有被鼠李糖乳杆菌GG产生的蛋白酶分解,产生有效的肽段,导致原料乳本身的α-淀粉酶抑制活性较低。除未发酵的原料乳外,发酵驼乳和牛乳在发酵和储藏时期的抑制率都大于70.00%,说明时间不是影响降糖活性的因素,其原因可能是鼠李糖乳杆菌GG是一种蛋白水解菌株,使得乳中的蛋白质水解生成降糖活性肽,也可能是鼠李糖乳杆菌GG本身或其产生的代谢产物就具有一定的降糖活性。在发酵24 h时,菌活力最高时,α-淀粉酶抑制率达到最高,表明鼠李糖乳杆菌GG的生长影响着发酵乳的降糖活性。在发酵24 h时,鼠李糖乳杆菌GG代谢产物的积累有益于降糖成分的产生,使得降糖活性最高。
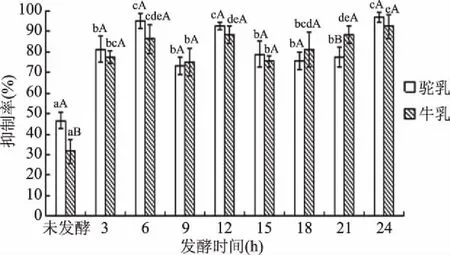
图10 不同发酵时间发酵乳的α-淀粉酶抑制率Fig.10 α-Amylase inhibition rate of fermented milk at different fermentation time

图11 不同储藏时间发酵乳的α-淀粉酶抑制率Fig.11 α-Amylase inhibition rate of fermented milk at different storage time

图12 不同发酵时间发酵乳的α-葡萄糖苷酶抑制率Fig.12 α-Glucosidase inhibition rate of fermented milk at different fermentation time
图12、图13表现出极低的α-葡萄糖苷酶抑制率,这可能与α-葡萄糖苷酶抑制活性与疏水氨基酸密切相关,从而导致水解液抑制活性偏低。并且图12中驼乳和牛乳发酵9 h前还出现了负抑制率,表明在水解过程中,蛋白质结构发生变化,分解成无效的小分子非蛋白类物质,如小分子肽段和单个氨基酸,对抑制率产生了负面的影响。发酵驼乳的α-葡萄糖苷酶抑制率都普遍高于发酵牛乳,这可能与原料乳有关。驼乳本身就含有降糖活性因子,具有较高降糖活性[5-6],表现出驼乳的α-淀粉酶和α-葡萄糖苷酶抑制率高于牛乳。图13中,发酵驼乳在储藏7 d后的α-葡萄糖苷酶抑制率呈下降趋势,可以解释为水解进一步分解成无活性肽和氨基酸[32]。Ayyash等[19]研究表明蛋白质水解活性与生物活性有一定的关系,而2.3中蛋白质水解程度显著增加(P<0.05),降糖活性无太大变化,说明蛋白质水解的程度与降糖活性没有直接的关系。
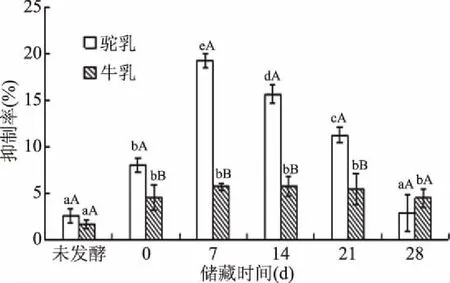
图13 不同储藏时间发酵乳的α-葡萄糖苷酶抑制率Fig.13 α-Glucosidase inhibition rate of fermented milk at different storage time
3 结论
从鼠李糖乳杆菌GG生长曲线可以看出,24 h作为本文驼乳和牛乳的发酵时间。发酵结果发现,鼠李糖乳杆菌GG在驼乳中生长繁殖更旺盛,其酸度更高,活菌数更多,蛋白质水解活性更高。pH、滴定酸度、鼠李糖乳杆菌GG活菌数和蛋白质水解活性存在一定的内在联系。降糖活性方面,发现鼠李糖乳杆菌GG发酵的驼乳和牛乳都具有较高的降糖活性,且发酵驼乳的降糖活性稍高于发酵牛乳。因此由鼠李糖乳杆菌GG发酵乳和驼乳都具有开发成辅助降糖的保健食品或药品的潜力,二者都为辅助治疗糖尿病开辟一条新的道路。但本文只对发酵乳的降糖活性进行了体外测定,缺乏体内降糖活性的验证,并且对降糖的机制未给出确定的解释,还需进一步研究探索。

