不同浓度低聚半乳糖对初断乳大鼠肠道菌群的影响
王艺苑,林姗姗,热依拉·阿巴拜克热,陈珊珊,陈洁华,邓红
(南方医科大学公共卫生学院营养与食品卫生学系,广东广州510515)
低聚糖俗称寡糖,是由2个~10个同种或不同种单糖通过糖苷键连接而成的低质量小聚合体。按照生物学功能可分为普通低聚糖和功能性低聚糖,功能性低聚糖因不可被消化大多进入消化道后端被肠道菌群发酵利用,从而诱导双歧杆菌及乳酸杆菌等有益菌增殖,减少大肠杆菌等有害菌定植,调节肠道pH值的功能[1-3]。
普通人体肠道内蕴藏着庞大的菌群系统,它们的基因总量是我们人体自身基因的100倍以上[4],并因机体生理状态、饮食习惯、遗传、年龄处于动态平衡中[5],且对机体的营养吸收、免疫调节、防癌抗病等方面起调节作用[6]。膳食改变是影响肠道菌群种类及丰度最重要也较为快速直接的方法。低聚半乳糖(galactooligosaccharide,GOS)作为一种由葡萄糖和乳糖组成的低聚糖可经发酵诱导有益菌群扩增,常作为益生元添加到婴幼儿奶粉中以弥补非母乳喂养造成的肠道菌群失衡的负面影响[7-8],目前低聚果糖(fructo-oligosaccharide,FOS)的研究已有很多,然而低聚半乳糖的摄入推荐量文献报道没有统一的结论[9]。
本试验通过对初断乳大鼠饮食中添加不同浓度的低聚半乳糖,研究其作为益生元添加到大鼠饲料中对肠道结构、形态功能的影响以及对肠道菌群的调节作用,并与普通饲料组及添加10%低聚果糖试验组相比较,以期为低聚半乳糖营养补充剂的应用提供理论依据。
1 材料与方法
1.1 试验动物与饲料
30只3周龄雄性初断乳SD大鼠,体重(40±5)g:南方医科大学动物实验中心,动物许可证号为SCXK2016-0041。各试验组大鼠饲料根据AIN-93G标准饲料配方调整,将纤维素分别并用不同浓度的低聚半乳糖或低聚果糖代替,制作质量浓度0%低聚半乳糖添加饲料(0%GOS),5%低聚半乳糖添加饲料(5%GOS),10%低聚半乳糖添加饲料(10%GOS),10%低聚果糖添加饲料(10%FOS),普通AIN-93G饲料(AIN 93),其中10%低聚果糖为阳性对照,AIN-93G为普通饲料对照。饲料组分:深圳睿迪生物科技有限公司,饲料配方见表1。
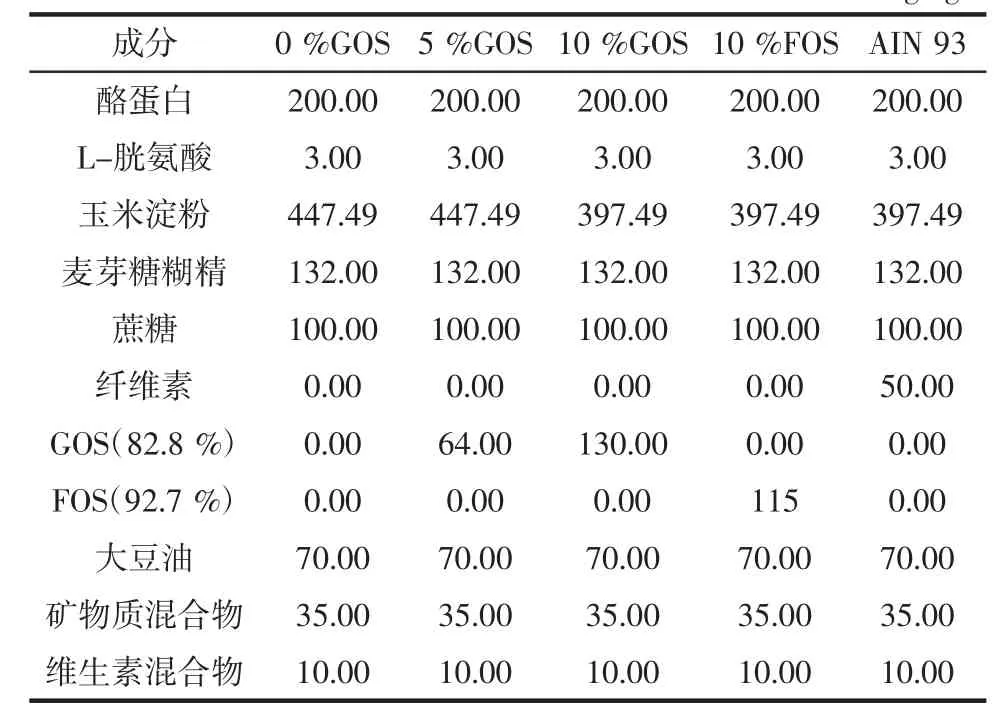
表1 饲料组成成分表Table 1 Compositions of the experimental diets g/kg
1.2 试剂与仪器
低聚半乳糖GOS(82.8%):英国BimunoTM公司;低聚果糖 FOS(92.7%,Synergy1):比利时 Beneo公司;4%多聚甲醛溶液:广州Panera生物有限公司;HE染色液(苏木素/伊红)试剂盒:湖北白奥斯生物科技有限公司;其余试剂为分析纯。
YP10001电子天平:常州衡正电子仪器有限公司;IX73倒置显微镜:日本 OLYMPUS公司;Modell RM2135石蜡切片机:德国Leica公司。
1.3 试验方法
1.3.1 分组及干预
30只初断乳大鼠适应性喂养3 d后,按照体重随机分为0%低聚半乳糖组、5%低聚半乳糖组、10%低聚半乳糖组、10%低聚果糖组、普通饲料饲喂组,并投喂相应种类的饲料。大鼠单笼饲养在清洁动物房不锈钢笼中,采用塑料饮水瓶自由给水,温度控制在22℃~25℃,湿度控制在45%~60%,每日给予光照12 h,室内循环换气。每天下午4:00定时收集大鼠粪便,称重记录后于-80℃冰箱中保存。记录大鼠起始体重及每日进食量,每2 d对大鼠体重进行称重记录,计算体重增加量。
1.3.2 组织样本制备
连续干预14 d,每组大鼠禁食12 h后,用10%水合氯醛麻醉后,分别取空肠、盲肠,于4℃生理盐水中漂洗干净肠道内容物后,取中间1 cm小段于4%多聚甲醛中常温下充分固定,剩余部分放入冻存管中,迅速放入液氮,之后-80℃保存。取盲肠称重,用无菌手术刀剖开后,一次性药勺刮取盲肠内容物分存于冻存管中,-80℃保存。
1.3.3 组织学检查
经4%多聚甲醛充分固定的组织块在梯度酒精中进行脱水处理,然后将脱水的组织透明处理,依次经过浸蜡、包埋、修快、切片和粘片步骤,而后用二甲苯对切片进行脱蜡、复水、及苏木精-伊红乙醇染色,染好色的切片用中性树胶封片,观察。用数码医学图像采集处理系统采图,测量回肠黏膜绒毛高度、隐窝深度等形态学指标。
1.3.4 肠道菌群检测
采用粪便DNA提取试剂盒提取肠道菌群细菌基因组DNA后,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,质控合格后,使用无菌水稀释样本至1ng/μL。对细菌基因组进行16S rDNA PCR扩增,采用正向引物341F和反向引物806R进行V3+V4区扩增。正向引物序列为 341F:5’-CCTAYGGGRBGCASCAG-3’,反向引物序列为 806R:5’-GGACTACNNGGGTATCTAAT-3’。送至北京诺禾生物股份有限公司,PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测,后根据PCR产物浓度进行等质量混样,使用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermofisher的Life Ion S5TM或Ion S5TMXL进行上机测序。使用Cutadapt软件过滤和按barcode拆分样本后,对所有样本的Clean reads以97%的一致性进行可操作分类单元(operational taxonomic units,OTUs)聚类和物种分类分析。
1.4 统计学方法
用SPSS20.0软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,p<0.05为差异有统计学意义。
2 结果与分析
2.1 低聚糖类益生元对初断乳大鼠体重及粪便的影响
体重增长趋势见图1。
试验前各组大鼠体重基本相同,14d干预后大鼠体重出现不同程度的增长,其中10%GOS组增长量最少,普通组增长量最大,10%FOS组与普通组接近,但差异均不存在统计学差异(p>0.05)。根据图1,各组增长趋势相近。
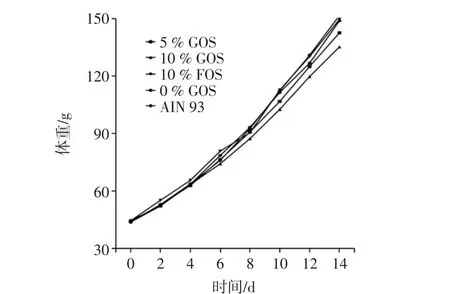
图1 体重增长趋势图Fig.1 Body weight growth trend
不同浓度低聚半乳糖对初断乳大鼠粪便质量的影响见图2。

图2 不同浓度低聚半乳糖对初断乳大鼠粪便质量的影响Fig.2 Effect of different concentration of galacto-oligosaccharide on the weight of fecal feces
肉眼观察,各试验组大鼠粪便形态颜色等有明显差异,0%GOS组粪便色黑质硬,形状短圆,普通组粪便色灰白质稀疏,形状多呈规则椭圆,添加益生元类组粪便呈现棕黄色,质湿软形态呈长条状。粪便总质量有统计学差异(p<0.01),0%GOS组与其余各组均存在统计学差异,5%GOS组与10%GOS组无差异,10%FOS与普通组间无差异,其余各组间均存在统计学差异。
不同浓度的低聚半乳糖作为益生元添加到大鼠每日饲料中未影响到大鼠的进食量及体重增长情况,干预期内大鼠毛发光泽,喜活动,精神状态良好。目前研究普遍认为低聚糖类益生元具有增加粪便含水量及体积从而软化粪便,改善便秘的作用[10-11],元添加组的粪便量较空白组有所增加,其中10%GOS组比5%GOS组的促排便能力要强,推测低聚半乳糖对便秘调节功能主要是依靠食物的物理吸水性来增加粪便体积及肠道的润滑程度,并与菌群改变与发酵产物有一定关系。
2.2 低聚糖类益生元对初断乳大鼠肝脏及盲肠质量的影响
不同浓度低聚半乳糖对初断乳大鼠肝脏及盲肠质量的影响见表2。
表2 不同浓度低聚半乳糖对初断乳大鼠肝脏及盲肠质量的影响(±s)Table 2 Effects of different concentrations of galactooligosaccharide on the weight of liver and cecum in the newly weaned rats(±s)
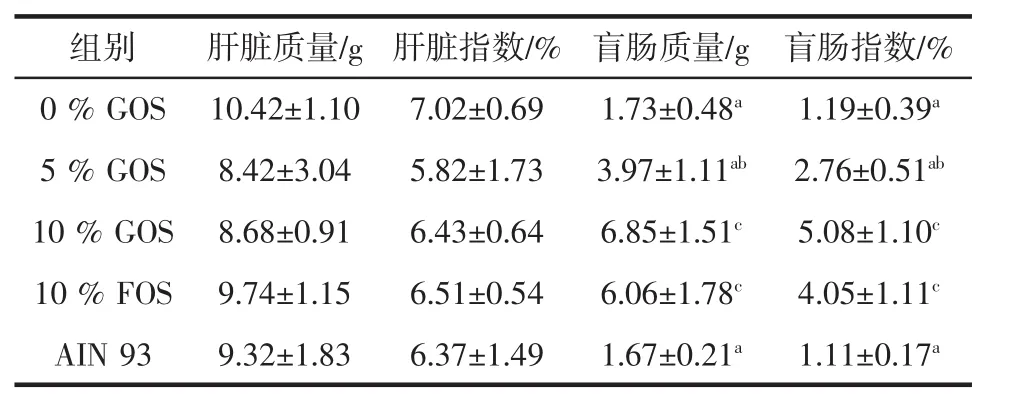
表2 不同浓度低聚半乳糖对初断乳大鼠肝脏及盲肠质量的影响(±s)Table 2 Effects of different concentrations of galactooligosaccharide on the weight of liver and cecum in the newly weaned rats(±s)
注:肝脏指数=肝脏质量/体重,盲肠指数=盲肠质量/体重。标号表示相比较时存在统计学差异:a与0%GOS组相比;b与10%FOS组相比;c与 AIN 93 组相比,p<0.01。
组别 肝脏质量/g 肝脏指数/% 盲肠质量/g 盲肠指数/%0%GOS 10.42±1.10 7.02±0.69 1.73±0.48a 1.19±0.39a 5%GOS 8.42±3.04 5.82±1.73 3.97±1.11ab 2.76±0.51ab 10%GOS 8.68±0.91 6.43±0.64 6.85±1.51c 5.08±1.10c 10%FOS 9.74±1.15 6.51±0.54 6.06±1.78c 4.05±1.11c AIN 93 9.32±1.83 6.37±1.49 1.67±0.21a 1.11±0.17a
各试验组肝脏质量及肝脏指数有不同,但不存在统计学差异(p>0.05)。盲肠质量有显著差异(p<0.01),其中0%GOS组与普通组间无统计学差异外,与其他各组均有统计学差异(p<0.05),10%GOS组盲肠质量最大(见表2)。
病理检查研究发现,各组大鼠脏器变化不大,但空肠、盲肠形态结构发生变化,尤其盲肠差异巨大,补充低聚糖类益生元组的盲肠体积、质量、盲肠内容物质量均发生显著变化,其中10%GOS体积和质量最大,分析原因,可能与低聚糖类益生元在肠道内虽不能被消化吸收却可以经发酵后产酸产气,改变肠道酸碱环境有关[12]。本研究发现与杭苏琴早先发表果寡糖对于仔猪肠道形态变化研究结果类似,FOS组仔猪小肠绒毛高度、绒毛高度与隐窝深度之比均高于对照组,且胃肠道内有机酸增高显著[13]。
2.3 低聚糖类益生元对初断乳大鼠肠道形态结构的影响
不同浓度低聚半乳糖对初断乳大鼠肠道绒毛高度及隐窝深度的影响见表3。
各组大鼠空肠的绒毛高度、隐窝深度及绒毛高度/隐窝深度比值无明显变化,其中,表3可见,0%GOS组低于其他试验组及普通饲料组,但差异无统计学意义。盲肠绒毛高度有明显变化,其中0%GOS组最短,10%GOS组最长,低聚糖添加组较普通组有所增长。盲肠绒毛高度/隐窝深度的比值亦存在0%GOS组最低,且结果又统计学差异(p<0.05)。
表3 不同浓度低聚半乳糖对初断乳大鼠肠道绒毛高度及隐窝深度的影响(±s)Table 3 Effects of different concentration of galacto-oligosaccharide on intestinal villi height and crypt depth in newly weaned rats(±s)μm

表3 不同浓度低聚半乳糖对初断乳大鼠肠道绒毛高度及隐窝深度的影响(±s)Table 3 Effects of different concentration of galacto-oligosaccharide on intestinal villi height and crypt depth in newly weaned rats(±s)μm
注:标号表示相比较时存在统计学差异:a与0%GOS组相比;b与AIN 93组相比,p<0.01,x与0%GOS组相比,p<0.05。
项目 0%GOS 5%GOS 10%GOS 10%FOS AIN 93空肠绒毛高度 240.58±30.64 258.25±20.97 249.92±35.61 258.39±31.60 258.82±40.03空肠隐窝深度 150.43±18.84 153.17±17.09 152.23±26.18 152.83±13.03 153.02±19.98空肠绒毛高度/隐窝深度 1.61±0.15 1.70±0.20 1.64±0.25 1.68±0.16 1.69±0.21盲肠绒毛高度 139.31±14.62 205.31±20.44a 216.13±27.63a 209.96±20.13a 194.91±23.59a盲肠隐窝深度 33.35±7.72 25.40±11.72 23.49±9.85 27.03±9.59 21.08±6.13盲肠绒毛高度/隐窝深度 4.41±4.46 9.77±4.50 10.71±4.84x 8.81±3.80 10.19±4.04x盲肠肌层厚度 226.99±56.11 167.72±50.85ab 163.35±49.63ab 165.50±20.34ab 268.43±50.13
不同浓度低聚半乳糖对初断乳大鼠盲肠结构形态的影响见图3。
显微镜下观察肠道切片形态,空肠处各组干预组变化不大,但盲肠的绒毛高度有显著差异(见图3),较0%GOS组,各组均明显升高(p<0.01)。绒毛高度的升高及绒毛高度/隐窝深度的比值增大表明肠道具有更强的吸收能力,因此盲肠器质类改变表明功能状态的改变,低聚半乳糖的增加干预诱导刺激了绒毛的增长,使肠道吸收能力更优,其可能与某些文献中报道的低聚糖类益生元类物质增加钙、铁、镁等矿物质有关[11,14-15]。
2.4 低聚糖类益生元对初断乳大鼠肠道菌群的影响
不同低聚半乳糖组肠道菌群排名前10的菌种相对丰富度见图4A。
不同低聚半乳糖组肠道菌群双歧杆菌与乳酸杆菌相对丰富度见图4B。
聚类分析后选取试验组在属分类水平上最大丰度排名前10的物种,生成物种相对丰度柱形图(图4A),可直观查看到低聚糖添加饲料中双歧杆菌及乳酸杆菌的组分明显增加,其中10%GOS组增加最明显,甚至优于10%FOS阳性对照组(图4B)。
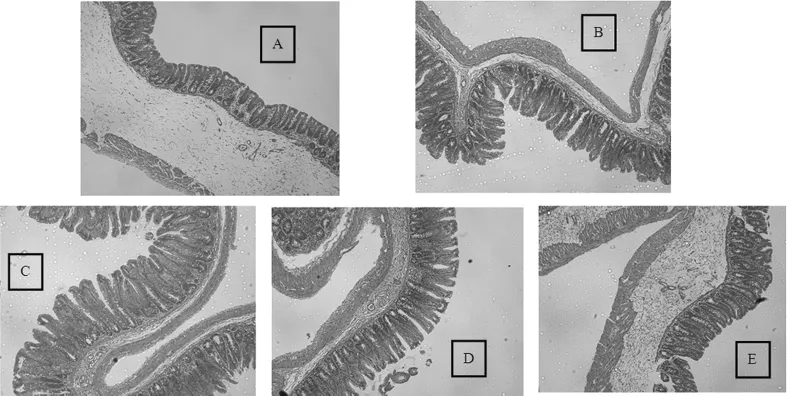
图3 不同浓度低聚半乳糖对初断乳大鼠盲肠结构形态的影响(HE染色,100倍放大)Fig.3 Effects of different concentrations of galacto-oligosaccharide on the structure and morphology of cecum in newly weaned rats(HE,100X)

图4 不同低聚半乳糖组肠道菌群物种相对丰富度柱形图Fig.4 Histogram of relative abundance of intestinal microbiome in different galacto-oligosaccharide groups
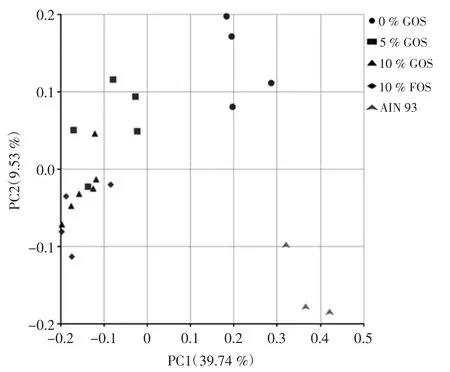
图5 不同低聚半乳糖组肠道菌群PCoA图Fig.5 Principal co-ordinates analysis of intestinal microbiome distribution in different galacto-oligosaccharide groups
不同低聚半乳糖组肠道菌群分布主坐标分析(principal co-ordinates analysis,PCoA)见图5。
基于Weighted Unifrac距离来进行主距离分析PCoA,如果样品距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开。由图5可见,各组不同干预组大鼠的肠道菌群的群落分布差异明显,低聚糖添加组多聚集在一起,即菌群结构相似。
不同低聚半乳糖浓度组双歧杆菌丰度MetaStat分布见图6。
进一步筛选组间具有显著性差异的物种并绘制差异物种在组间的丰度分布箱图(图6)。下图显示在双歧杆菌种属下各组的差异,0%GOS组与其余浓度低聚糖添加组均有差异,且(p<0.01),普通组与低聚糖组也存在统计学差异(p<0.01),其中10%GOS对于双歧杆菌的增长作用最显著。
目前,越来越多的研究表明肠道菌群的稳态与人体健康息息相关,它与心脑血管疾病、代谢性疾病,胃肠道炎症及自身免疫综合征等疾病的关系也在层层揭开[16-17]。本研究通过细菌16S rDNA保守区扩增后,对高变区V3V4区进行测序及菌种测定后发现,低聚半乳糖添加组中双歧杆菌与乳酸杆菌的增殖较空白对照及普通对照发生明显升高,其中10%GOS组对于促进益生菌增殖作用最显著,致使大鼠肠道菌群组成出现差异。即从物种丰度前十的相对丰富度上看,低聚半乳糖添加组的双歧杆菌与乳酸杆菌显著增多。双歧杆菌与乳酸杆菌作为人体内组成优势菌的有益菌群,其丰度和分布占据着重要作用,一旦两者数量增多可抑制大肠杆菌、产气荚膜菌等条件致病菌的增殖[18]。低聚果糖的双歧因子作用在改善肠道菌群方面已获得较多较全面研究[19-20],从PCoA图可以看到添加了低聚糖类益生元的组别相距较近说明物种差异不大,但是进一步关注组间差异性物种,5%、10%低聚半乳糖组改善肠道菌群的能力相较于10%低聚果糖的阳性对照组也存在一定优势,发现低聚半乳糖对于双歧杆菌的增殖效果更显著。
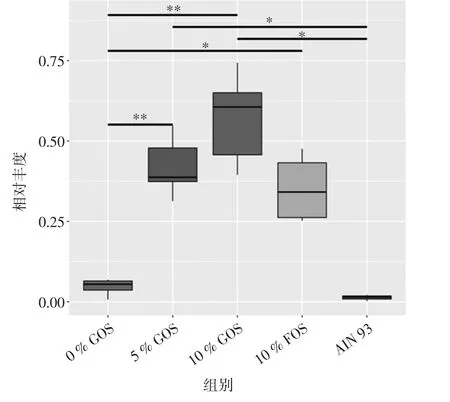
图6 不同低聚半乳糖浓度组双歧杆菌丰度MetaStat分布Fig.6 MetaStat distribution of bifidobacteria in different galactooligosaccharide concentration groups
3 结论
低聚半乳糖的添加可在一定程度上改善大鼠的肠道吸收能力,并有效促进肠道中双歧杆菌与乳酸杆菌的增殖,并且高浓度低聚半乳糖的添加可以更显著的改善肠道菌群。5%、10%低聚半乳糖组改善肠道菌群的能力相较于10%FOS存在一定优势。