弓形虫TgHly-Ⅲ蛋白诱导虫体从宿主细胞逸出
张 倩,金 郁,姚 湧,计永胜,汪学龙
刚地弓形虫(Toxoplasmagondii)是一种细胞内寄生原虫,世界人群的隐性感染率约为30%[1]。弓形虫逸出时破碎宿主细胞是虫体损伤机体的主要原因。课题组在弓形虫基因组(http://toxodb.org/toxo/)中发现一个与细菌三型溶血素(Hemolysin III)同源的弓形虫三型溶血素(TgHly-Ⅲ)基因。研究[2]显示蜡样芽孢杆菌的三型溶血素可以结合到人红细胞表面,形成微孔道,造成红细胞裂解。弓形虫TgHly-Ⅲ基因在虫体入侵细胞后33~44 h达到转录峰值,与虫体逸出时间以及另一调节物质脱落酸的合成峰值时间吻合。但TgHly-Ⅲ在弓形虫逸出过程的作用尚未明确。该研究通过生物信息学分析了TgHly-Ⅲ的结构和进化,并对TgHly-Ⅲ进行了外源表达,用TgHly-Ⅲ诱导了弓形虫的逸出。结果显示,外源性TgHly-Ⅲ可以诱导弓形虫从宿主细胞提前逸出,此类逸出和宿主细胞凋亡途径相关。该研究从弓形虫自身蛋白角度解析了弓形虫致病作用,为弓形虫病的防治提供了新的线索。
1 材料与方法
1.1细胞、虫株与主要试剂虫体细胞质表达黄色荧光蛋白的弓形虫RH株(TgMic-Yfp)由中国农业大学国家动物寄生原虫实验室索勋教授课题组惠赠,并在液氮保存。实验所用人包皮成纤维细胞(human foreskin fibroblast, HFF)购自中国医学科学院细胞资源中心。BAPTA-AM、Z-VAD-FMK、Nec-1购自美国Sigma-Aldrich公司;anti-Bax、anti-JNK、anti-pJNK、anti-actin、anti-p38、anti-p-p38抗体购自上海生工生物工程股份有限公司。蛋白纯化试剂盒购自北京康为世纪生物科技有限公司;BCA蛋白浓度测定试剂盒购于南京碧云天生物科技有限公司。
1.2生物信息学分析和蛋白表达本研究所用蛋白序列比对网站为欧洲生物信息研究所https://www.ebi.ac.uk/Tools/msa/clustalo/;蛋白三级结构预测网站为华盛顿大学Baker实验室http://robetta.bakerlab.org/。转化有pET28a-TgHly-Ⅲ载体的BL21感受态以菌液形式保存于本实验室-80 ℃冰箱。将此菌液接种于含卡那霉素的Luria-Bertani(LB)液体培养基中,37 ℃培养过夜,约12 h,次日用异丙基硫代半乳糖苷(IPTG)诱导表达,分时间段收集菌液,进行SDS-PAGE 凝胶电泳。用Ni-Agarose His标签蛋白纯化试剂盒对蛋白进行纯化,并用BCA蛋白浓度测定试剂盒进行浓度测定。
1.3虫体逸出实验弓形虫TgMic-Yfp速殖子培养于HFF细胞,36 h后,向细胞培养基中加入重组TgHly-Ⅲ至终浓度10 μg/ml (以不加蛋白和10 μg/ml BSA作为对照组),分别孵育0、30和60 min。收集细胞培养上清液,流式细胞仪对培养基中的速殖子进行计数,体积为每个处理计数50 μl培养基。为检测逸出是否与虫体钙离子、运动能力有关,TgHly-Ⅲ孵育前先用BAPTA-AM(5 μmol/L、10 min)、细胞松弛素-D(Cytochalasin-D,Cyto-D,5 μmol/L、20 min)进行预处理;为检测逸出是否与宿主细胞凋亡或程序性坏死通路有关,感染细胞用Z-VAD-FMK(10 μmol/L、20 min)或Nec-1(20 μmol/L、20 min)进行预处理[3];然后用10 μg/mlTgHly-Ⅲ孵育60 min,用流式细胞仪对逸出虫体进行计数。
1.4Westernblot实验弓形虫TgMic-Yfp速殖子培养于HFF细胞,36 h后,向细胞培养基中加入TgHly-Ⅲ蛋白至终浓度10 μg/ml,分别孵育0、30和60 min。收集细胞总蛋白,用SDS-PAGE电泳分离蛋白(20 μg/孔),转膜至PVDF膜,按顺序孵育抗体,显色。抗体稀释比例按照文献报道[4],做相应调整为:Anti-Bax(1 ∶2 000)、anti-JNK(1 ∶1 000)、anti-pJNK(1 ∶1 000)、anti-actin(1 ∶5 000)、anti-p38(1 ∶1 000)、anti-p-p38(1 ∶500)。
1.5统计学处理采用SPSS 20.0软件进行统计分析,作图软件为GraphPad Prism 6.0。组间比较采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1TgHly-Ⅲ蛋白的生物信息学分析和表达克隆得到了TgHly-Ⅲ基因片段,并提交到美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库(GenBank: KF651011.1),对TgHly-Ⅲ蛋白序列进行了生物信息学分析。结果显示,TgHly-Ⅲ属于溶血素蛋白家族成员,氨基酸序列同诺氏疟原虫溶血素蛋白(PkHly)和夏氏疟原虫溶血素蛋白(PcHly)、蜡样芽孢杆菌三型溶血素(SaHly-Ⅲ)存在很大相似性,尤其是80个氨基酸以后的三型溶血素蛋白功能区域,进化上也比较相近。见图1A。对TgHly-Ⅲ三级结构进行预测显示其为跨膜蛋白,可能存在细胞膜穿孔功能。TgHly-Ⅲ大小约为30 ku,与预测结果相近。见图1B。
2.2外源性TgHly-Ⅲ蛋白诱导虫体逸出用弓形虫TgMic-Yfp感染HFF细胞36 h后,用10 μg/ml的TgHly-Ⅲ孵育细胞不同时间(0 、30 、60 min),收集细胞培养液,用流式细胞仪分析50 μl培养液中虫体数目,计算逸出效率。结果显示,随着外源表达的TgHly-Ⅲ蛋白孵育时间延长,培养基中虫体数目升高(F=254.4,P<0.05),差异有统计学意义,而无蛋白添加组和BSA组虫体数目无明显变化,显示TgHly-Ⅲ蛋白可以有效诱导虫体逸出。 用钙离子螯合剂BAPTA螯合虫体内钙离子后,TgHly-Ⅲ诱导虫体逸出比率显著下降(TgHly-Ⅲ组vsTgHly-Ⅲ+BAPTA组:22 470±4 203vs2 164±666.1),差异有统计学意义(F=69.33,P<0.05)。同样结果出现在Cyto-D处理组,虫体逸出比率下降(TgHly-Ⅲ组vsTgHly-Ⅲ+BAPTA组:21 514±3 157vs2 250±871.6),差异有统计学意义(F=104.8,P<0.05)。此结果提示TgHly-Ⅲ诱导虫体逸出与钙离子和虫体运动能力有关。见图2。
2.3宿主细胞凋亡蛋白的表达用细胞死亡抑制剂对TgHly-Ⅲ诱导虫体逸出进行阻断。结果显示:细胞凋亡抑制剂Z-VAD-FMK能有效抑制TgHly-Ⅲ诱导性虫体逸出(TgHly-Ⅲ组vsTgHly-Ⅲ+Z-VAD-FMK组:25 455±3 244vs6 218±938.4),差异有统计学意义(F=81.51,P<0.05)。但是,细胞程序性坏死抑制剂Nec-1对TgHly-Ⅲ诱导性虫体逸出的阻断效果不明显(TgHly-Ⅲ组vsTgHly-Ⅲ+Nec-1组:25 455±3 244vs20 117±4 412),差异无统计学意义(F=81.51,P>0.05)。此外,检测了TgHly-Ⅲ孵育细胞后主要凋亡相关蛋白的表达。结果显示:促凋亡蛋白Bax随着TgHly-Ⅲ孵育时间增加表达量上升。同时JNK蛋白和p38蛋白的磷酸化水平提高。见图3。
3 讨论
弓形虫对宿主的致病性多是在胞内增殖末期逸出时破碎被感染细胞引发的。因此,研究虫体逸出的调控机制有助于解析虫体的毒力及其致病机制[5]。
早期研究[6]表明,诱导弓形虫从宿主细胞逸出的是钙离子载体A23187。钙离子载体诱导体逸出赖于虫体细胞骨架的重组和虫体的运动能力。用膜通透性钙离子螯合剂BAPTA-AM处理虫体感染的细胞后,钙离子载体诱导虫体逸出就不会发生。诱导弓形虫逸出的虫体效应蛋白也多与钙离子相关,例如弓形虫穿孔素样蛋白(TgPLP-1)[5]、弓形虫肌球蛋白H(TgMyoH)[7]、弓形虫钙依赖蛋白激酶1(TgCDPK1)[8]和弓形虫钙依赖蛋白激酶3(TgCDPK3)[9]等。本研究建立了用流式细胞仪检测弓形虫逸出的实验平台,发现外源表达纯化的TgHly-Ⅲ蛋白可以有效诱导弓形虫从宿主细胞逸出,提示此蛋白在弓形虫致病过程中的作用。同时,TgHly-Ⅲ蛋白诱导弓形虫逸出与虫体内钙离子以及虫体运动能力有关,提示逸出过程是虫体主动的。弓形虫虫体钙离子调节通路主要有IP3依赖途径[10]和脱落酸途径[11],TgHly-Ⅲ蛋白诱导弓形虫逸出所依赖的信号通路仍有待于进一步研究。TgPLP-1是弓形虫经典的膜穿孔蛋白,在弓形虫逸出细胞前释放,定位于虫体微线体。本文所研究的TgHly-Ⅲ蛋白生物信息学分析也合成于虫体逸出前期,但具体虫体定位需要进一步实验确定。
此外,死亡受体Fas与其配体的结合以及穿孔素孵育、一氧化氮[12]、肿瘤坏死因子-α等宿主细胞免疫因子都能激发虫体从感染细胞中逸出,与含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)介导的宿主细胞钙离子释放有关[13],并引发细胞凋亡。细胞凋亡分为内源性凋亡和外源性凋亡两种。本研究显示,TgHly-Ⅲ蛋白诱导弓形虫逸出依赖于宿主细胞凋亡途径,并且凋亡相关蛋白JNK和p38的表达或磷酸化水平提高,与蜡样芽孢杆菌非溶血性肠毒素诱导非洲绿猴肾细胞(Vero细胞)凋亡的模式相似[3]。需要说明的是,本研究结果显示,TgHly-Ⅲ蛋白诱导弓形虫逸出依赖于宿主细胞凋亡途径的完整以及虫体的运动能力,两者缺一不可。虽然尚未检测TgHly-Ⅲ蛋白对宿主细胞膜完整性的影响,根据已得实验结果推测,外源性TgHly-Ⅲ蛋白孵育可能使宿主细胞膜产生微孔,进而引起细胞稳态发生变化,促进宿主细胞发生凋亡,最后引发虫体逸出。阻断凋亡途径后,虽说细胞膜产生微孔,但虫体并不逸出,提示宿主细胞凋亡途径的相关因子激发虫体运动逸出,这个衔接因子值得进一步研究确定。本研究结果为进一步探讨虫体内源性TgHly-Ⅲ在虫体逸出过程中的作用及其与宿主细胞蛋白的相互作用奠定基础。
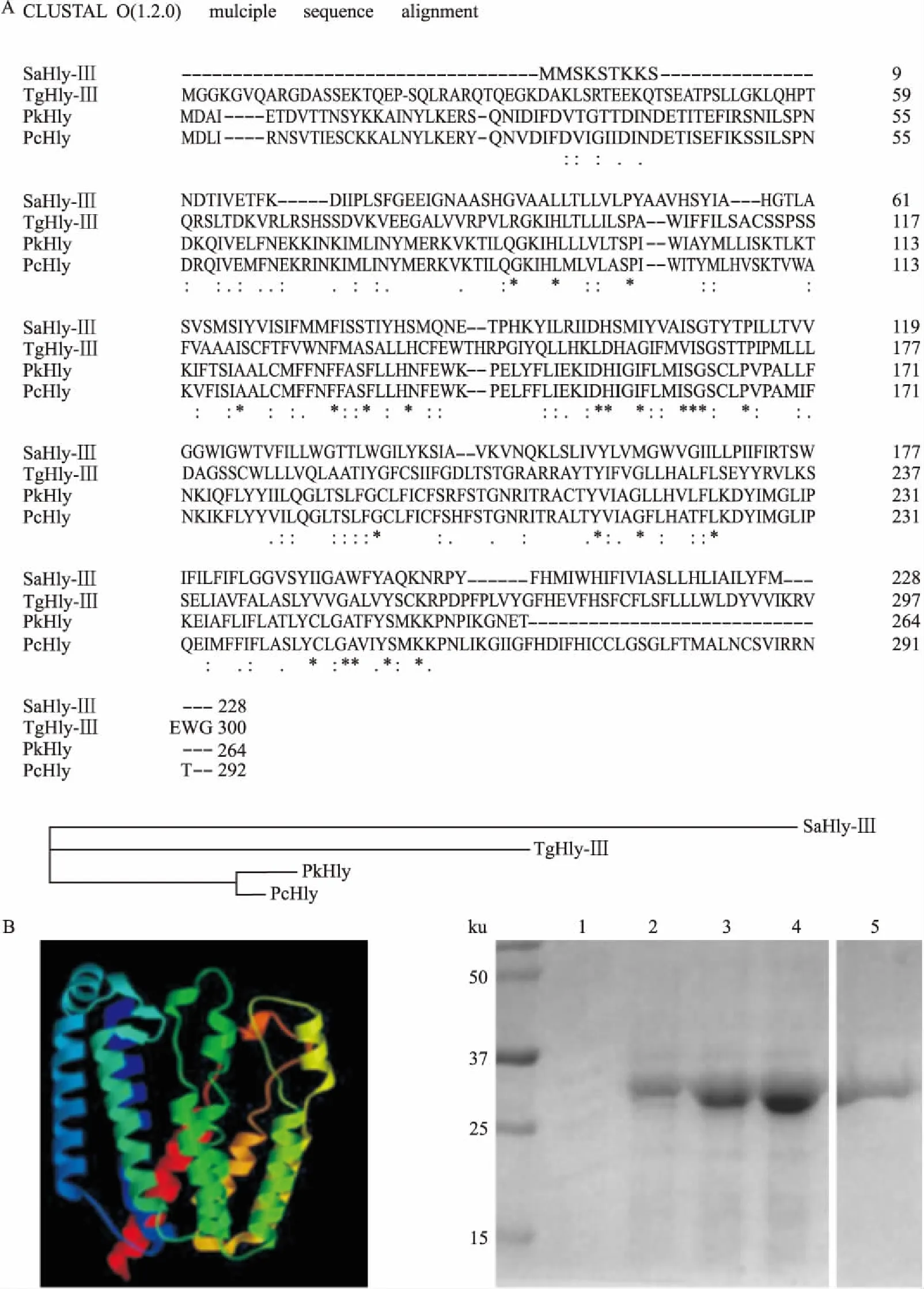
图1 TgHly-Ⅲ蛋白的生物信息学分析和蛋白表达
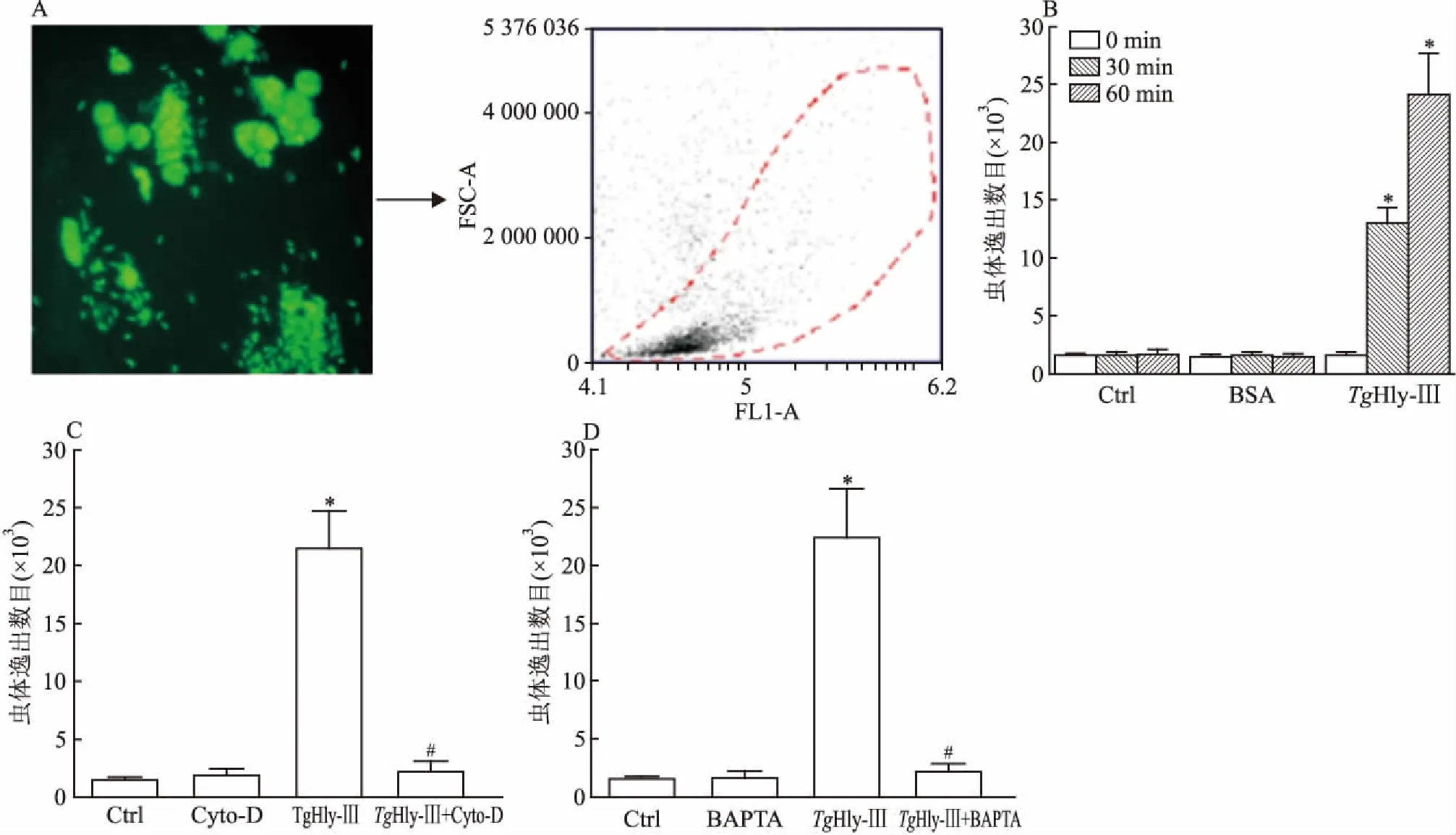
图2TgHly-Ⅲ蛋白诱导弓形虫逸出以及与钙离子、虫体运动能力的关系检测
A:检测系统;B:TgHly-Ⅲ蛋白诱导弓形虫逸出;与TgHlyⅢ 0 min组比较:*P<0.05;C、D:TgHly-Ⅲ蛋白诱导弓形虫逸出与虫体运动能力、钙离子的关系;与Ctrl组比较:*P<0.05;与TgHlyⅢ组比较:#P<0.05
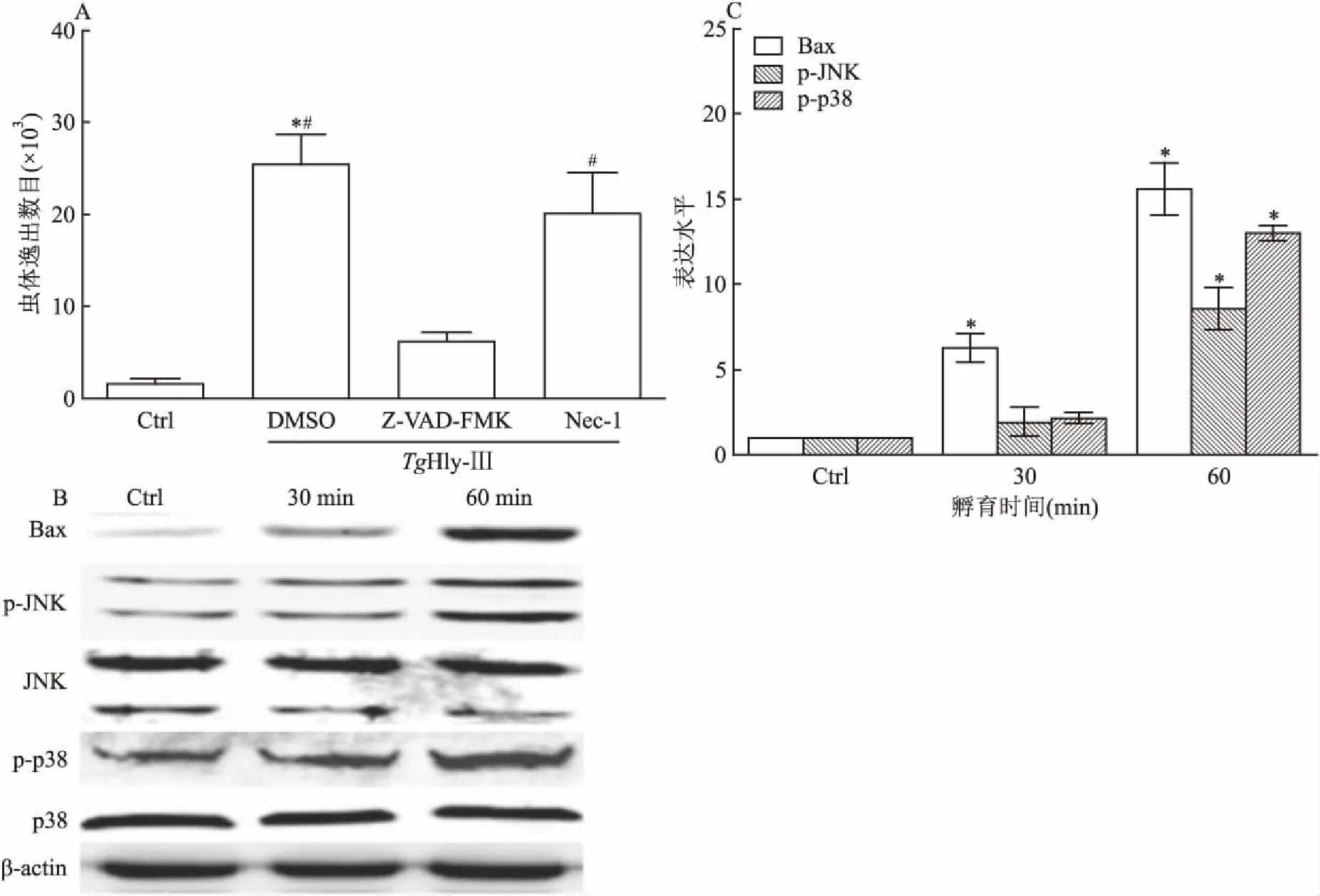
图3TgHly-Ⅲ蛋白诱导弓形虫逸出与细胞凋亡、程序性坏死的关系检
A:TgHly-Ⅲ蛋白诱导弓形虫逸出与细胞凋亡相关;与Ctrl组比较:*P<0.05;与Z-VAD-FMK组比较:#P<0.05;B、C:细胞凋亡相关蛋白的检测;与Ctrl组比较:*P<0.05

