豌豆低聚肽硒螯合物制备及结构特征研究
秦修远,刘文颖,陈立城,刘戚,鲁军,谷瑞增,蔡木易*,张春乐*
1(中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京,100015)2(广东中食营科生物科技有限公司,广东 东莞,523122)
大量科学研究表明,经蛋白酶水解蛋白质得到的生物活性多肽,具有很好的溶解性,更容易被消化吸收,并且具有许多独特的生理功能[1]。豌豆低聚肽是对豌豆蛋白进行酶解得到的多肽,研究表明,豌豆低聚肽具有抗菌、抗氧化等生物活性[2]。硒是生物体内必不可缺的营养元素之一,具有抗氧化、抗肿瘤、提高机体免疫力等显著生理功能,因此维持机体中合适的硒水平能够预防多种疾病,如癌症、克山病、大骨节病等[3-4]。世界上约有40个国家或地区缺硒,据统计我国约有2/3地区属缺硒地区[5]。由此造成人体缺硒或低硒,对健康不利。
目前,人们可以通过药物、硒营养强化剂、膳食等途径补充硒,但是随着分析化学、分子生物学、毒理学研究的不断进步,人们发现硒的生理功能不仅与其含量有关,也与其形态相关[6]。与无机硒相比,有机硒具有更高的吸收率、生物活性强、毒性低等特点[7-8]。已有研究通过螯合的方式,将多肽与硒结合,但由于原料限制,产品的腥味去除和螯合率仍有待提高[9]。本研究将食源性豌豆低聚肽与亚硒酸钠螯合,以期为有机硒补充剂的生产提供理论依据。
1 材料和方法
1.1 材料与仪器
1.1.1 实验材料
豌豆低聚肽,广东中食营科生物科技有限公司;五水亚硒酸钠(分析纯),天津市大茂化学试剂厂;3′3-二氨基联苯胺(DAB 4HCl)。(试剂级)、乙二胺四乙酸二钠(EDTA-2Na)(生物技术级),Biotopped Amresco;氢溴酸(分析纯),天津市福晨化学试剂厂;盐酸羟胺、高氯酸、硝酸、盐酸、氢氧化钠、95%乙醇(分析纯),均购自北京化工厂;超纯水,实验室自制。
1.1.2 实验仪器
pH计(EL20),Mettler Toledo;超声波清洗器(KQ-250E),昆山市超声仪器有限公司;恒温水浴锅(1204007),苏州珀西瓦尔实验设备有限公司;Phenom Prox台式扫描电子显微镜、Dynex Spectra Mr酶标仪、Frontier FT-IR型傅里叶变换红外光谱仪,Perkin Elmer; DHG-9075A电热恒温鼓风干燥箱,北京陆希科技有限公司。
1.2 实验方法
1.2.1 硒标准曲线的绘制
硒标准储备溶液:准确称取2.190 g Na2SeO3·5H2O,以少量超纯水溶解后,加48%氢溴酸,然后以超纯水定容至1 L,制备成657.474 6 mg/L的硒标准储备溶液。
硒标准工作溶液:吸取1 mL硒标准储备溶液,以超纯水定容至100 mL,制备成6.57 μg/mL的硒标准工作溶液。
精确量取0、2、4、6、8、10 mL硒标准工作溶液,根据陈甫等[9]提出的分光光度法,以酸消解后测量3, 3’ -二氨基联苯胺与还原硒反应后产生的黄色络合物在420 nm处的吸光值。
按上述方法绘制,得到标准曲线如图1所示。

图1 硒标准曲线
Fig.1 Selenium standard curve
1.2.2 螯合物硒含量的测定
准确称量一定量待测样品,以10 mL超纯水溶解后,采用上述方法处理样品,测量处理后样品的吸光值。对应标准曲线,确定螯合物硒含量。
1.2.3 硒的螯合率的计算
(1)
式中:m1为螯合物中硒元素的质量;m2为加入螯合体系硒元素的质量。
1.2.4 螯合物得率的计算
(2)
式中:m3为螯合产物质量;m4为加入螯合体系总物质的质量。
1.2.5 豌豆低聚肽硒螯合物制备工艺单因素试验
1.2.5.1 豌豆低聚肽硒螯合物制备方法
豌豆低聚肽硒螯合物的制备工艺流程为:豌豆低聚肽→超纯水溶解→加入亚硒酸钠→超声波混匀→调节pH值→恒温螯合→醇沉→干燥得成品。
1.2.5.2 豌豆低聚肽硒螯合物单因素实验设计
肽质量浓度设计为10 g/L,肽盐质量比为2∶1,螯合pH值为8.5,分别在60、70、80、85、90 ℃条件下反应30 min。考察反应温度对得率和螯合率的影响。
肽质量浓度为10 g/L,螯合pH值为8.5,螯合温度为85 ℃,分别在肽盐质量比为1∶1,2∶1,3∶1,4∶1,5∶1的条件下反应30 min。考察肽盐质量比对得率和螯合率的影响。
肽盐质量比为3∶1,螯合pH值为8.5,螯合温度为85 ℃,分别在肽质量浓度为20,30,40,50 g/L的条件下反应30 min。考察肽质量浓度对得率和螯合率的影响。
肽质量浓度为40 g/L,肽盐质量比为3∶1,螯合温度为85 ℃,分别在螯合pH值为6.5、7、8、8.5、9的条件下反应30 min。考察反应pH值对得率和螯合率的影响。
肽质量浓度为40 g/L,肽盐质量比为3∶1,螯合温度为85 ℃,螯合pH值设计为8.5,分别反应20、30、40、50、60 min。考察反应时间对得率和螯合率的影响。
1.2.6 豌豆低聚肽硒螯合物制备工艺优化正交试验
在单因素实验基础上,选择温度、肽盐质量比、pH值和肽质量浓度,进行正交实验优化,筛选出豌豆低聚肽硒螯合物的最佳工艺制备条件。正交试验因素水平如表1所示。

表1 正交实验水平表Table 1 Orthogonal experiment level
1.2.7 豌豆低聚肽硒螯合物的结构特征
1.2.7.1 紫外全波长扫描
分别称取豌豆低聚肽及豌豆低聚肽硒螯合物于超纯水中,配制成0.05 g/mL溶液。对2组溶液进行全波长紫外扫描,扫描波长200~600 nm。
1.2.7.2 扫描电镜
分别将豌豆低聚肽及豌豆低聚肽硒螯合物干粉样品涂抹在样盘双面胶上,然后进行氮吹处理。处理好的样品放入扫描电镜抽真空,施加一定的电压,调整束斑尺寸待聚焦清晰后分别在×1 000倍数下获取图像,观察。
1.2.7.3 傅里叶红外光谱扫描
称取豌豆低聚肽10 mg和干燥的光谱纯KBr 1 000 mg置于玛瑙研钵中,研磨均匀后压片得到透明的KBr样品片,利用傅里叶红外光谱仪进行定性分析。同样方法对豌豆低聚肽硒螯合物进行红外光谱测定。
仪器参数设置:光谱范围为 4000~400 cm-1;分辨率 4 cm-1,扫描时扣除水和二氧化碳的干扰。
1.2.8 数据处理
采用SPSS v20处理实验数据,结果采用单因素方差分析。
2 结果与讨论
2.1 豌豆低聚肽的基础理化成分
豌豆低聚肽中总蛋白含量为88.30%,酸溶蛋白含量为84.20%,水分含量为4.46%,灰分含量为5.04%,游离氨基酸含量(以干基计)为2.93%,水解氨基酸含量为66.82%,肽含量(以干基计)为81.27%。
2.2 豌豆低聚肽硒螯合物制备工艺单因素实验结果
2.2.1 反应温度对螯合结果影响
在化学反应中,温度是影响反应进程的一个不可忽略的因素。从图2可以看出,随着温度的升高,螯合率和得率都逐渐升高,说明温度的升高有助于螯合过程的进行。当温度超过85 ℃时,得率逐渐下降,而螯合率基本保持不变,说明过高的温度会阻止反应进行。经方差分析,85与80 ℃组的得率为差异显著(P<0.05),与组间(除80 ℃)为差异极其显著(P<0.01),85 ℃螯合率与80 ℃组和90 ℃组差异不显著,与组间(除80、90 ℃)差异极显著(P<0.01)。因此,综合2项指标,温度选择为85 ℃。

图2 温度对螯合反应的影响
Fig.2 Effects of temperature on the chelating reaction
2.2.2 肽盐质量比对螯合结果影响的研究
在化学反应过程中,反应物的相对比例可能对一些空间键位的形成构成影响。从图3可以看出,随着肽盐质量比(肽∶盐)的逐渐增加,螯合率逐渐减少,而得率逐渐增加,两项指标的变化趋势相反,随着肽盐比的增加,肽浓度保持不变,则盐的质量减少。

图3 肽盐质量比(肽∶盐)对鳌合反应的影响
Fig.3 Effects of the mass ratio of oligopeptideto salt
on the chelating reaction
盐质量的减少,是导致螯合率下降的主要原因。但当肽盐质量比超过3∶1时,产物得率也呈下降趋势,而螯合率的下降趋势逐渐平缓。肽盐质量比为3∶1时,螯合得率最高。经方差分析,在3∶1时的得率和螯合率与组间相比,差异极显著(P<0.01)。综合2项指标,肽盐质量比选择为3∶1。
2.2.3 肽浓度对螯合结果影响的研究
在化学反应过程中,除了反应速率,反应物的浓度也是影响反应进行程度的重要因素。从图4可以看出,随着肽浓度的增加,螯合率与得率都呈现了先增加再稳定后减小的变化趋势。化学反应是一个动态平衡的过程,若产物在反应体系中浓度很高,则不利于反应的正向进行。平稳的浓度即达到了化学平衡的最适浓度。经方差分析,肽质量浓度为30 g/L时的得率和螯合率与组间(除40 g/L外)2项指标相比为差异极显著(P<0.01),与40 g/L的2项指标为不显著。综合2项指标,且从节约肽的经济角度出发,选择肽质量浓度为30 g/L。

图4 肽浓度对鳌合反应的影响
Fig.4 Effects of the concentration of oligopeptideon on
the chelating reaction
2.2.4 反应pH值对螯合结果影响的研究
从图5可以看出,随着溶液pH值的增加,螯合率和得率整体上都呈增加趋势,但是pH值超过8以后,2项指标呈下降趋势并逐渐趋于平缓。说明该鳌合反应在弱碱性的环境下有更好的反应结果。从表2经方差分析,在pH=8时,得率和螯合率与组间相比均为极显著差异(P<0.01)。

图5 pH值对鳌合反应的影响
Fig.5 Effects of the pH value on the chelating reaction
当豌豆低聚肽与亚硒酸钠完全溶解时,溶液的pH值即为8左右。因此,综合2项指标,选择pH=8。
2.2.5 反应时间对螯合结果影响的研究
由图6可以看出,随着螯合时间的延长,螯合率和得率都逐渐增加。当螯合时间超过30 min时,螯合率与得率都下降,并在一定值的范围内波动。经方差分析,30 min的得率和螯合率与20 min组的2项指标达到了差异极显著(P<0.01),与组间(除20 min组外)为差异显著(P<0.05)。40、50、60 min组间2项指标差异不显著。综合2项指标,选择螯合时间为30 min。

图6 反应时间对螯合反应的影响
Fig.6 Effects of reaction time on the chelating reaction
2.3 豌豆低聚肽硒螯合物制备正交实验结果
综合以上单因素试验的结果,以豌豆低聚肽硒的螯合率和得率为指标,采用L9(34)正交试验优化豌豆低聚肽硒螯合物的制备工艺。结果如表2所示。

表2 豌豆低聚肽硒螯合物正交试验结果Table 2 Orthogonal experiment results of the peaoligopeptideselenium chelate
以得率为指标,由表2可看出,各因素对豌豆低聚肽硒螯合物得率的影响大小依次为:肽盐比>肽质量浓度>pH值>温度。最佳因素组合为A1B3C1D3,即螯合温度80 ℃,豌豆低聚肽浓度为5%,肽盐质量比为2∶1,螯合pH值为8,反应时间为30 min。
以螯合率为指标,由表2可看出各因素对豌豆低聚肽硒螯合物螯合率的影响大小依次为肽盐比>pH值>肽浓度>温度。最佳因素组合为A1B3C3D3,即螯合温度80 ℃,豌豆低聚肽浓度为5%,肽盐质量比为2∶1,螯合pH值为9,反应时间为30 min。
综合以上2项指标,确定豌豆低聚肽硒螯合物最佳制备工艺为螯合温度80 ℃,豌豆低聚肽质量浓度为50 g/L,肽盐质量比为2∶1,螯合pH值为9,反应时间为30 min。
2.4 豌豆低聚肽硒螯合物的结构特征
2.4.1 紫外全波长扫描
分别将配制成0.05 g/mL溶液的豌豆低聚肽和豌豆低聚肽硒螯合物进行全波长紫外扫描,扫描波长200~600 nm。结果如图7所示。

图7 豌豆低聚肽与豌豆低聚肽硒螯合物紫外
全波长扫描图
Fig.7 UV scanning analysis of the pea oligopeptide
and pea oligopeptide selenium chelate
由图7可以看出,豌豆低聚肽在309 nm处有最大吸收峰,当豌豆低聚肽与亚硒酸钠螯合形成豌豆低聚肽硒螯合物时,最大吸收峰红移到322 nm处,并且最大吸收峰的OD值也变大,证明螯合使物质的结构发生变化,硒元素与肽的配合形成对光吸收性能更强的结构,这是豌豆低聚肽与硒螯合后,价电子跃迁程度变化的结果。
2.4.2 扫描电镜
由图8可以看出,在螯合前(图8-a),豌豆低聚肽具有明显的球体颗粒状,在1 000放大倍数下,可以看出豌豆低聚肽颗粒表面都存在褶皱,完整颗粒的粒径均小于50 μm。由图8-b可以看出,经过螯合后,豌豆低聚肽硒螯合物粒型变化较大,失去球状形态。最远粒径大于300 μm。豌豆低聚肽硒螯合物的表面褶皱大部分伸展开,并且存在孔洞。推测是经过螯合,豌豆低聚肽表面展开,结构发生变化,以提供与硒的结合位点。颗粒前后变化明显,证明是2种物质。
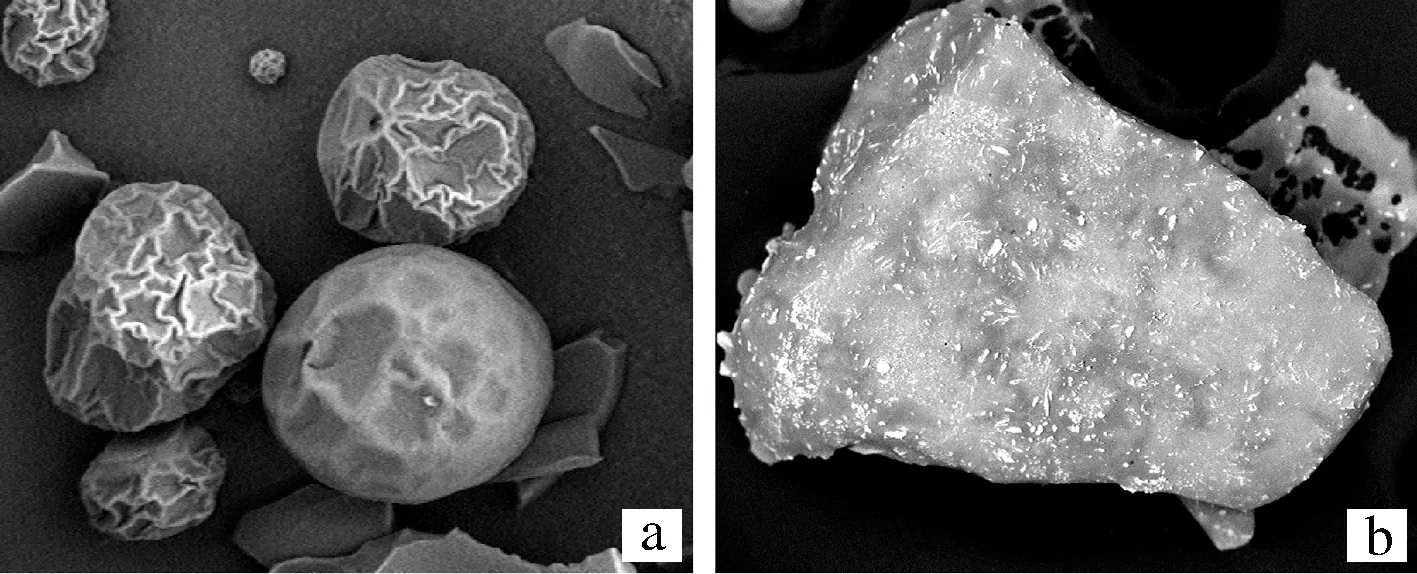
图8 豌豆低聚肽(a)和豌豆低聚肽硒螯合物(b)的
扫描电镜图
Fig.8 Scanning electron microscope of the pea oligopeptide
(a) and pea oligopeptide selenium chelate (b)
2.4.3 傅里叶红外光谱结果分析
豌豆低聚肽与螯合物的吸收峰相比,峰的形状出现了变化,如图9所示。豌豆低聚肽在3 040、954附近有吸收峰,说明存在—COOH,而螯合物在3 040附近的吸收峰变窄,954附近吸收峰变得很弱,说明游离羧基不存在,可能是羧基以共价键形式与硒配合。螯合物在3 158和3 436附近有双峰,在1 216附近有峰,说明存在—NH2,且—NH2为自由的。从理论上分析,肽硒螯合物的螯合机制为Se4+与—NH2配合,羧基以共价键方式也与Se形成配合。推测豌豆低聚肽硒螯合物中,由Se4+提供4 d空轨道,N、O能够提供孤对电子,可分别占据空轨道形成配位键。这一推测也与其他相关研究相符[11-12]。

图9 豌豆低聚肽和豌豆低聚肽硒螯合物红外
光谱对比
Fig.9 Infrared radiation spectrum of the pea oligo-
peptide and pea oligopeptide selenium chelate
3 结论
豌豆低聚肽与亚硒酸钠螯合制备豌豆低聚肽硒螯合物的最佳工艺制备条件为:螯合温度80 ℃,豌豆低聚肽质量浓度50 g/L,肽盐质量比为2∶1(肽∶盐),pH=9,时间30 min。在此条件下的产物得率为27.87%,螯合率为57.23%。
通过紫外全波长扫描的结果可以看出,由于豌豆低聚肽与硒元素螯合后,相应的原子价电子跃迁发生变化,因此豌豆低聚肽硒螯合物的最高吸收峰发生红移,且吸收峰更强;扫描电镜结果显示豌豆低聚肽经过螯合,其微观形态发生变化,表面褶皱舒展,以提供与硒配合的位点,最终配体颗粒体积变大;傅里叶红外光谱结果显示,螯合反应使豌豆低聚肽的结构发生变化,推断是硒离子可与多肽中NH2+以及—COO—形成配位键,豌豆低聚肽硒螯合物是一种新型含硒的螯合物。本实验开辟了补硒产品的新思想,为进一步产业化奠定了理论基础。

