氮对地枇杷幼苗生长及生理特征的影响
王勇 马军 秦航道
摘要:探討了水培条件下,不同浓度的氮对地枇杷生长和抗氧化酶活性的影响。结果表明,水培条件下地枇杷的最适氮浓度为300 mg/L,此时地枇杷干物质积累量较高,且总分枝的长度、叶片数和分枝没有受到抑制,地枇杷叶绿素含量也有所增加。不同浓度氮处理均能促进地枇杷根中氮的积累,而对茎叶中氮含量影响不大;此外,缺氮会促进地枇杷根对磷的吸收,而高浓度的氮能够抑制磷在地枇杷茎和叶中的积累;氮对地枇杷根中钾的含量影响不大,而随氮浓度增加,氮对地枇杷茎和叶中钾的累积有抑制作用。氮浓度不同,地枇杷不同部位的酶活性变化也不相同。低浓度氮处理下,地枇杷主要通过增加根中CAT活性、叶中SOD活性和CAT活性来适应环境;高浓度氮处理时,地枇杷主要通过增加根中SOD活性和POD活性、叶中CAT活性和POD活性来适应环境。
关键词:地枇杷;氮;叶绿素含量;抗氧化酶活性;生物量
中图分类号: S567.901 文献标志码: A 文章编号:1002-1302(2019)23-0181-05
营养元素是植物生长的必需元素,营养物质的匮乏不仅会影响植物生物量的积累而且会影响其正常的生理功能[1-2]。而过量的营养物质一样会破坏植物生长微环境内的动态平衡,引起植物中毒,甚至死亡。氮作为植物体重要组成元素,在植物生长过程中起着重要的作用,因此研究植物对氮的吸收与分配具有重要意义[3]。一方面,氮的供应不足会引起植物叶片发黄、生长变慢、叶绿素含量降低,植物光合作用效率降低[4];另一方面,大量氮元素的存在会造植物体内营养元素失衡,引起代谢功能紊乱,影响植物生长[5]。不仅如此,氮元素还会对植物的抗病虫害能力、体内酶活性产生影响[6-8]。
地枇杷属于桑科榕属的一种常见多年生常绿藤本植物,常生于荒地、草坡或岩石缝中,广泛分布于我国湖南、贵州、云南、广西等省份[9]。地枇杷的用途广泛,不仅是一种良好的药材,具有抗菌、消炎和抗氧化的作用[10-13],而且由于地枇杷具有较好的抗旱性和重金属耐受性,在水土保持和重金属污染植物修复中有良好的应用前景[14-15]。然而由于对地枇杷的生长与营养特性研究较少,这极大地限制了地枇杷的生产应用,本试验通过对地枇杷在不同浓度氮元素影响下的生理生化特征变化进行研究,进一步明确地枇杷对氮元素的吸收行为,初步确定地枇杷对氮的需求关系,为地枇杷的大规模培养提供科学依据。
1 材料与方法
1.1 苗木培养与试验设计
地枇杷扦插苗采集于湖南省冷水江市锡矿山(111°29′E、27°45′N),并在温室内使用珍珠岩进行扦插繁殖。其中完全营养液按照霍格兰营养液进行配制,温室条件设置为光照白天14 h,晚上10 h,温度为白天25 ℃,晚上18 ℃,湿度设定在60%~80%之间。
本试验采用水培方式进行,分别设置不同的氮浓度处理。添加氮浓度设置0、150、300、450、600 mg/L 6个处理,氮源为NH4NO3,培养液中分别加入KH2PO4 0.135 g/L、K2SO4 0.174 g/L、CaCl2 0.444 g/L、MgSO4·7H2O 0.492 g/L。所有处理微量元素组成同样采用霍格兰微量元素混合液:H3BO3 2.86 mg/L,ZnSO4·7H2O 0.22 mg/L,MnCl2 1.81 mg/L,CuSO4·5H2O 0.08 mg/L,(NH4)2MoO4 0.02 mg/L,EDTA-Fe 2.8 mg/L。水培试验在4 L塑料盆中进行,每盆6棵地枇杷,每盆装3.5 L 1/2浓度霍格兰营养液,每间隔4 d更换1次营养液,共培养30 d后收获。试验在温室中进行,培养条件与地枇杷繁殖时间相同。在收获时取新鲜地枇杷叶片测定叶绿素含量,剩余植物样品先用自来水冲洗干净后分为根、茎、叶3个部分,再使用去离子水冲洗3遍,使用110 ℃杀青15 min后,在70 ℃烘干至恒质量,每个处理3次重复。
1.2 氮磷钾含量测定
称取一定量地枇杷烘干样品,用H2SO4与H2O2进行消解,消解液用于测定氮磷钾元素含量[16]。氮元素含量测定采用凯氏定氮仪(KDA-08)蒸馏后,盐酸滴定的方法测定;磷元素含量采用钒钼黄吸光光度法测定;钾元素元素测定采用火焰原子吸收分光光度计方法测定。
1.3 抗氧化酶活性及丙二醛含量测定
称取约0.2 g的新鲜植物组织样品使用预冷后的研钵和5 mL磷酸盐缓冲液(50 mmol/L,pH值7.8)研磨成匀浆。然后把匀浆在离心力为11 000 g、温度为4 ℃条件下离心 20 min,收集上清液用于酶活性的测定[17]。上清液中的超氧化物歧化酶活性、过氧化物酶活性、过氧化氢酶活性、丙二醛含量和可溶性糖含量使用以下的分光光度计-化学方法测定:(1)SOD活性测定参考修改后的Tang等的方法[18]进行测定。1个单位的酶活性被定义为引起抑制NBT比率减少50%所需要酶的数量。(2)POD活性是指反应混合液在波长为470 nm、温度为25 ℃时的吸光度变化值[17]。1个单位的POD酶活性被定义为波长为470 nm时的吸光度在1 min内增加0.1时所需要的酶量。(3)CAT活性是指过氧化氢在波长为240 nm、温度为25 ℃条件下的吸光度1 min内的降低程度[19]。1个单位的CAT活性被定义为在波长为 240 nm 时吸光度1 min降低0.1时所需要的酶量。(4)氧化损伤(膜脂过氧化作用)通过测定MDA的含量来衡量[20]。可溶性糖含量的计算公式参考文献[21]。
1.4 叶绿素含量测定
培养30 d后采集地枇杷从上至下的第4张或第5张完全展开叶,使用80%丙酮研磨后置于称取新鲜叶片样品 0.2 g 在研钵中,使用少许进行研磨提取,混匀后用80%丙酮定容至25 mL,并在黑暗条件下放置24 h,提取液用于测定叶绿素和类胡萝卜素的含量。提取液中的叶绿素a、叶绿素b、类胡萝卜素的含量用分光光度计(UV-4100,日立)测定,波长分别为646、663、470 nm[22]。
1.5 數据处理
使用SPSS统计软件进行数据的方差分析(ANOVA),采用Tukey test检验对处理间的平均值进行显著性分析,当P<0.05 时表示差异显著。试验数据用3次重复的“平均值±标准差”表示。
2 结果与分析
2.1 生物量变化
地枇杷根茎叶的干质量在不同氮营养水平下的变化趋势如表1所示。地枇杷叶片干物质积累随着氮浓度增加呈先升高后降低的趋势,氮浓度为300 mg/L时,叶片的干质量最大(1.17 g),然而随着氮浓度进一步增加,叶片的干质量表现出下降的趋势,在氮浓度为450 mg/L时地枇杷叶的干质量最低,为0.35 g。地枇杷茎的干质量在氮浓度为450、 600 mg/L 时比对照有所下降,而且在氮浓度为450 mg/L时茎干质量降低更为显著,比对照降低了34.1%。地枇杷根的干质量在所有氮处理下都明显地低于对照,而且在氮浓度为450 mg/L地枇杷根的干质量最低(0.04 g)。不同氮浓度对地枇杷茎叶干质量的影响表明,氮浓度为300 mg/L以下时,增加氮的供应能够促进地枇杷叶的干物质积累,而对地枇杷茎的干质量影响不大;氮浓度在450 mg/L以上时,氮浓度的增加会抑制地枇杷茎叶的干物质积累。对照的地枇杷根干质量最高,而随着氮浓度的增加,地枇杷根的干质量有显著降低,这表明氮的加入能够在一定程度上抑制地枇杷根的物质积累。
不同氮浓度处理下,地枇杷不仅质量发生了变化,而且总分枝长度、叶片数和分枝数也受到了影响(图1)。在氮浓度为300 mg/L以下时,总分枝长度、叶片数和分枝数都没有明显地受到抑制;而氮浓度为450、600 mg/L时,总分枝长度、叶片数明显减少,结果进一步表明,合适的氮浓度能够促进地枇杷生长,高浓度氮则会抑制地枇杷的生长。
2.2 氮磷钾的吸收积累规律
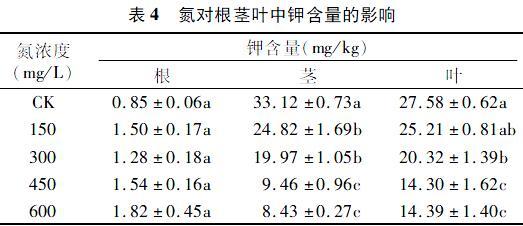
不同氮营养水平下地枇杷氮磷钾含量变化规律如表2至表4所示。从表2可知,地枇杷根中氮的含量随着氮浓度的增加而增加,在氮浓度为450、600 mg/L时,氮含量较高,分别为37.9、33.8 mg/kg,而氮对地枇杷茎和叶中的氮含量没有影响,与对照相比没有显著差异。
培养液中未添加氮源的处理地枇杷根系磷含量显著高于施氮处理中根系磷含量,但根系磷含量在氮浓度150、300、450、600 mg/L之间差异不明显。当氮浓度在300 mg/L以下,施氮处理茎中磷含量没有显著变化,而只有在高氮处理下(450、600 mg/L)茎中磷含量显著降低。地枇杷叶片磷含量随氮浓度变化趋势跟茎中磷含量变化趋势类似(表3)。
氮的施用对地枇杷根中钾含量无影响,根中钾含量在各氮浓度处理中没显著差异。与对照相比,所有施氮处理均能显著降低地枇杷茎中钾含量,且高氮浓度处理(450、 600 mg/L)下茎中钾含量降低更为显著,降低幅度分别为714%、 74.6%。低氮处理(150 mg/L)下地枇杷叶片中钾含量与对照没有明显差异,而氮浓度超过150 mg/L时施氮处理反而降低叶片中的钾含量,这种降低趋势在高氮(450、600 mg/L)水平下更为显著,与对照相比降低幅度分别为482%、47.8%(表4)。
2.3 叶绿素含量变化
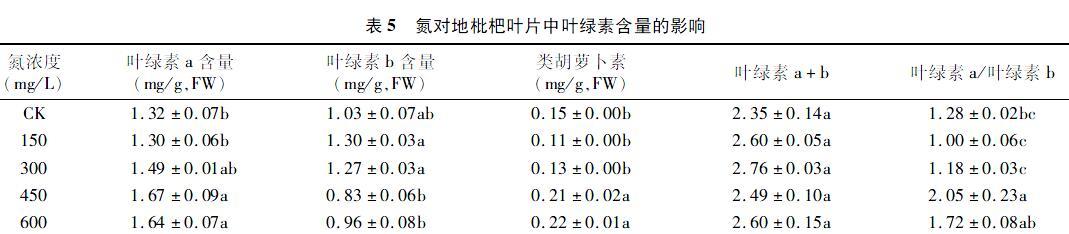
从表5可知,叶绿素a含量随着氮浓度的增加有一定的增加趋势,特别是在氮浓度为450、600 mg/L时,叶绿素a含量比对照显著增加,为1.67、1.64 mg/L。虽然叶绿素b的含量在所有氮处理下与对照相比没有显著差异,但叶绿素b含量在450、600 mg/L氮处理时明显低于150、300 mg/L氮处理时的叶绿素b含量。氮浓度为150、300 mg/L时对地枇杷类胡萝卜素含量没有影响,而氮浓度为450、600 mg/L时能显著增加地枇杷类胡萝卜素含量。以上结果表明,氮浓度在 300 mg/L 及以下时对地枇杷叶片中的叶绿素a、叶绿素b和类胡萝卜素含量没有影响,但是氮浓度为450、600 mg/L时能增加地枇杷叶片中叶绿素a和类胡萝卜素的含量,降低叶绿素b的含量。
氮对地枇杷叶绿素a+b的含量没有影响,所有氮处理下地枇杷叶绿素a+b的含量并没有显著差异。虽然氮浓度为150、300、600 mg/L时地枇杷叶绿素a/b与对照相比并没有显著差异,但氮浓度为450 mg/L时地枇杷叶绿素a/b显著增加,比对照增加 60.15%。这表明除了氮浓度为450 mg/L时对叶绿素a/b有增加作用外,其他氮浓度对地枇杷叶绿素a+b 的含量和叶绿素a/b并没有影响(表5)。
2.4 抗氧化系统酶活性
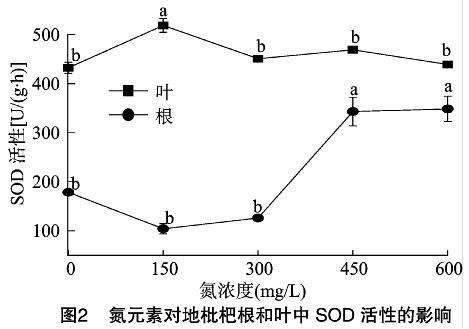
不同浓度氮元素处理下地枇杷的SOD、CAT、POD活性如图2至图4所示。在不同浓度氮元素处理下,地枇杷叶片的SOD活性仅在氮浓度为150 mg/L时显著增加,而其他的处理和对照相比都没有明显的变化。此外,与对照相比,根中SOD活性在氮浓度为150、300 mg/L时变化不明显,而在氮浓度为450、600 mg/L时明显增加,分别为343.05、 348.56 U/(g·h)。结果表明,低浓度氮处理会增加地枇杷叶中SOD活性,而高浓度的氮处理会增加地枇杷根的SOD活性。
地枇杷叶中POD活性随着氮浓度增加呈先增加后减少的趋势,但与对照相比,POD的活性在氮浓度为300、450、600 mg/L 时显著增加,其中在氮浓度为在300 mg/L时最高,为180.28 U/(g·min)。在地枇杷根中,POD活性的变化规律与在叶中的变化规律类似,但是POD活性在氮浓度在 450 mg/L 时最高,为120.81 U/(g·min)。结果表明,虽然低浓度氮处理对地枇杷叶和根POD活性没有显著影响,但中高浓度的氮处理会显著增加POD活性。
与对照相比,所有氮处理下地枇杷叶片的CAT活性都显著增加,而且在氮浓度为150、450 mg/L时活性较高,分别为577.38、516.24 U/(g·min)。而在地枇杷根中,CAT活性除了在氮浓度为300 mg/L时有明显降低以外,其他氮处理对CAT活性影响不大。这表明虽然氮能明显增加叶片中CAT活性,但是不同处理间的差异并不显著,同时随氮浓度的增加,地枇杷根中CAT的活性并不会显著增加。
2.5 可溶性糖和丙二醛含量
在不同浓度的氮处理下,叶片中的MDA含量随着氮浓度的升高而呈现先降低后升高趋势,MDA含量在氮浓度为300 mg/L时最低,为41.01 nmol/g;而在氮浓度为600 mg/L时最高,分别为56.04 nmol/g。另外,根中MDA的含量在所有处理下都没有显著差异。说明氮浓度的差异会引起地枇杷叶片的膜脂过氧化作用增加,从而增加MDA含量,而氮浓度的变化对地枇杷根的膜脂过氧化没有显著影响(图5)。
叶片中可溶性糖含量随氮浓度的升高而先降低后升高。叶片中可溶性糖含量在300 mg/L时最低,为 197.34 μmol/g;在600 mg/L时最高,为371.34 μmol/g。根中可溶性糖含量随氮浓度的增加而先增加后降低,且在氮浓度为150、300 mg/L 时较高,分别为48.85、 48.83 μmol/g。这表明氮浓度的变化会增加叶片中可溶性糖含量,而中低浓度的氮亦能增加根中可溶性糖含量(图6)。
2.6 脯氨酸含量
从图7中可以看出,不同部位地枇杷体内的脯氨酸含量变化规律不同。在地枇杷叶片中,脯氨酸含量在氮浓度为450、 600 mg/L 时分别为30.98、30.03 μg/g,是对照的3.04、2.95倍,而在氮浓度为与150、300 mg/L时脯氨酸的含量并没有显著降低。在地枇杷根中,脯氨酸含量在氮浓度为 600 mg/L 时含量最高,为6.25 μg/g,为对照的6.01倍;而脯氨酸的含量在氮浓度为150、300、450 mg/L时与对照相比没有显著差异。这表明中低浓度的氮处理并不会显著增加地枇杷根和叶片中的脯氨酸含量,而高浓度会显著增加脯氨酸的含量,而且高浓度氮对叶的影响大于对根的影响。
3 讨论与结论
大量研究表明,提供充足的植物生长所需的大量营养元素能够促进植物生长、繁殖和抗性能力。然而不同植物对于营养元素的需求量不同,在适宜浓度范围内增加营养元素浓度能够大幅促进干物质积累[23-24],而超过适宜浓度后,干物质累积并没有随着营养元素浓度增加而增加,甚至出现了抑制作用[2,25]。在本研究中,地枇杷葉干质量随着氮浓度的增加而增加,在氮浓度为300 mg/L时最高,而随着氮浓度的增加,地枇杷叶片的干质量出现明显降低。这与宋志东等在对水葫芦上的研究结果相似,研究表明在一定氮浓度范围内,氮使用量的增加会增加植物的干质量[26]。从不同部位来看,地枇杷叶片对氮元素的浓度变化较根和茎敏感,氮对地枇杷叶中干物质的累积影响大于其在茎和根的累积。
一般情况下,氮元素的供应量增加会提高植物叶片中的叶绿素含量,但是不同植物的变化趋势不同[1,27-28]。在本研究中,在氮浓度低于300 mg/L时,氮的增加对地枇杷叶绿素含量影响不大,而在高浓度氮(450、600 mg/L)处理下,叶绿素a含量增加,而叶绿素b含量降低。这进一步表明合理的氮浓度处理下地枇杷采取增加叶面面积的方式,而不是增加叶绿素含量的方式来提高地枇杷对氮的吸收。
植物对氮元素的吸收存在着复杂的关系,当在适宜的浓度范围内时,氮浓度增加会促进氮元素的累积[29-33]。在本试验中,氮浓度增加仅对地枇杷根中氮的含量影响较大,而对茎叶中氮的含量影响不大。地枇杷茎和叶中磷和钾的含量随着氮浓度增加有所降低,这表明提高氮浓度会降低磷和钾在地枇杷叶和茎中的累积。
元素的缺乏或者过量也是一种胁迫作用,会引起体内抗氧化系统酶活性的变化,但是这种现象在不同部位的表现不尽相同[4,28]。随着氮浓度的增加,地枇杷根中SOD活性、POD活性均在氮浓度大于300 mg/L时有明显增加;而在地枇杷叶中,CAT活性增加,但在不同浓度氮处理间没显著差异,仅POD随着氮浓度增加而增加。这表明氮浓度为400、600 mg/L时地枇杷根通过提高SOD、POD活性,叶主要通过提高CAT、POD活性来去除多余的活性氧,从而适应高氮的环境。
参考文献:
[1]Al-Qurashi A D,Awad M A,Ismail S M. Growth,yield,fruit quality and nutrient uptake of tissue culture-regenerated ‘Barhee date palms grown in a newly established orchard as affected by NPK fertigation[J]. Scientia Horticulturae,2015,184:114-122.
[2]Kong J,Dong Y J,Zhang X W,et al. Effects of exogenous salicylic acid on physiological characteristics of peanut seedlings under iron-deficiency stress[J]. Journal of Plant Nutrition,2015,38(1):127-144.
[3]吴 巍,赵 军. 植物对氮素吸收利用的研究进展[J]. 中国农学通报,2010,26(13):75-78.
[4]叶冰竹,施晟璐,张润枝,等. 缺氮和复氮处理对菘蓝幼苗生长及部分生理生化指标的影响[J]. 植物资源与环境学报,2015(4):83-88.
[5]陈 晨,龚海青,张敬智,等. 水稻根系形态与氮素吸收累积的相关性分析[J]. 植物营养与肥料学报,2017,23(2):333-341.
[6]Medici L O,Azevedo R A,Smith R J,et al. The influence of nitrogen supply on antioxidant enzymes in plant roots[J]. Functional Plant Biology,2004,31(1):1-9.
[7]段旺军,杨铁钊,戴 亚,等. 植物氮素营养与病害发生关系研究进展[J]. 西北植物学报,2011,31(10):2139-2146.
[8]叶莉莎,陈双林. 氮素形态及配比对雷竹光合特性和氮代谢酶活性的影响[J]. 生态学杂志,2016,35(9):2355-2360.
[9]中国科学院中国植物志编辑委员会.中国植物志(第23卷)[M]. 北京:科学出版社,1990:156.
[10]Wei S,Ji Z,Wu W. New antifungal pyranoisoflavone from Ficus tikoua Bur[J]. International Journal of Molecular Sciences,2012,13(6):7375-7382.
[11]Wei S P,Zhang J W,Wu W J,et al. Water-soluble constituents of Ficus tikoua[J]. Chemistry of Natural Compounds,2014,49(6):1134-1136.
[12]Wu B,Song J M,Li X G. Distribution and chemical speciation of dissolved inorganic arsenic in the Yellow Sea and East China Sea[J]. Acta Oceanologica Sinica,2015,34(6):12-20.
[13]Sirisha N,Sreenivasulu M,Sangeeta K,et al. Antioxidant properties of Ficus species—a review[J]. International Journal of Pharmtech Research,2010,2(4):2174-2182.
[14]Liu C C,Liu Y G,Guo K,et al. Exploitation of patchy soil water resources by the clonal vine Ficus tikoua in karst habitats of southwestern China[J]. Acta Physiologiae Plantarum,2011,1:93-102.
[15]劉益贵,彭克俭,沈振国. 湖南湘西铅锌矿区植物对重金属的积累[J]. 生态环境,2008,17(3):1042-1048.
[16]农业部果品及苗木质量监督检验测试中心. 植物中氮、磷、钾的测定:NY/T 2017—2011[S]. 北京:中国农业出版社,2011.
[17]Feng R W,Wei C Y,Tu S X,et al. Antimony accumulation and antioxidative responses in four fern plants[J]. Plant and Soil,2009,317(1/2):93-101.
[18]Tang S R,Liao S Q,Guo J K,et al. Growth and cesium uptake responses of Phytolacca americana Linn. and Amaranthus cruentus L. grown on cesium contaminated soil to elevated CO2 or inoculation with a plant growth promoting rhizobacterium Burkholderia sp. D54,or in combination[J]. Journal of Hazardous Materials,2011,198:188-197.
[19]Feng R W,Wei C Y. Antioxidative mechanisms on selenium accumulation in Pteris vittata L.,a potential selenium phytoremediation plant[J]. Plant Soil & Environment,2012,58(3):105-110.
[20]Qu Y,Zhou Q,Yu B. Effects of Zn2+ and niflumic acid on photosynthesis in glycine soja and glycine max seedlings under NaCl stress[J]. Environmental and Experimental Botany,2009,65(2):304-309.
[21]Cheng Z W,Dong K,Ge P,et al. Identification of leaf proteins differentially accumulated between wheat cultivars distinct in their levels of drought tolerance[J]. PLoS One,2015,10(5):e0125302.
[22]Wellburn A,Lichtenthaler H. Formulae and program to determine total carotenoids and chlorophylls a and b of leaf extracts in different solvents[M]//Advances in photosynthesis research. Netherlands:Springer,1984,2:9-12.
[23]Lombardo S,Pandino G,Mauromicale G. The nutraceutical response of two globe artichoke cultivars to contrasting NPK fertilizer regimes[J]. Food Research International,2015,76(3):852-859.
[24]Wendt V,Büll L T,Corrêa J C,et al. Green fertilization effect,associated to NPK doses,in sunflower crop in two sowing systems[J]. Acta Scientiarum. Agronomy,2005(4):617-621.
[25]Huang Z,Jiang D,Yang Y,et al. Effects of nitrogen deficiency on gas exchange,chlorophyll fluorescence,and antioxidant enzymes in leaves of rice plants[J]. Photosynthetica,2004,42(3):357-364.
[26]宋志东,唐永金. N、K元素对水葫芦修复水体铯污染的影响[J]. 环境科学与技术,2016(6):117-122.
[27]李 彩. 纽荷尔脐橙不同叶片N、K水平对光合及生长的影响[D]. 重庆:西南大学,2012:19-22.
[28]Hernández-Pérez A,Valdez-Aguilar L A,Villegas-Torres O G,et al. Effects of ammonium and calcium on lisianthus growth[J]. Horticulture Environment and Biotechnology,2016,57(2):123-131.
[29]李海霞,张妍妍,白 卉,等. 供氮水平对白桦幼苗生物量、碳氮含量与储量的影响[J]. 江苏农业科学,2017,45(22):156-159.
[30]刘晓伟,王火焰,周健民,等. 供氮浓度与时期对水稻产量及氮吸收的影响[J]. 江苏农业科学,2017,45(7):66-69.
[31]陸景陵. 植物营养学(上)[M]. 2版. 北京:中国农业大学出版社,1994:69-72.
[32]王晴芳,袁伟玲,甘彩霞,等. 氮肥用量对萝卜肉质根产量及氮素吸收利用的影响[J]. 安徽农业科学,2013,20(20):8580-8582.
[33]黄明丽,邓西平,白登忠. N、P营养对旱地小麦生理过程和产量形成的补偿效应研究进展[J]. 麦类作物学报,2002,22(4):74-78.
收稿日期:2018-09-12
基金项目:贵州省铜仁市科学技术项目(编号:2017TRS97693);铜仁学院博士启动基金(编号:)。
通信作者:王 勇(1985—),男,湖南怀化人,博士,主要从事植物生态与植物修复研究。E-mail:wy7185299@126.com。

