蛋氨酸缺乏对雏鸡抗氧化功能和免疫球蛋白的影响
蒋蓓蕾, 陈金拳, 吴邦元
(1.淮安生物工程高等职业学校,江苏淮安 223200;2.江苏食品药品职业技术学院,江苏淮安 223200;3.西华师范大学生命科学学院,四川南充 637009)
蛋氨酸作为畜禽日粮中必需氨基酸,禽类的第一限制性必需氨基酸,具有较高的营养价值和重要的生理功能(Oz等,2008;杨丽杰等,2004;胡杰等,2003),适量的蛋氨酸可促进畜禽生长发育,改善生产性能和胴体质量(Xie等,2007),也可增强动物的免疫功能 (Swain等,2000;瞿明仁等,1999)。若蛋氨酸缺乏将会影响动物的采食,导致其体重降低,影响其免疫器官发育,甚至导致免疫器官受损(Wu等,2013),也会导致动物患营养性疾病(Cummins等,1986)。
免疫球蛋白是介导体液免疫的主要抗体,也是衡量机体免疫功能的重要指标。蛋氨酸作为谷胱甘肽的前体氨基酸,在保护机体组织和细胞免受氧化损伤中发挥着重要的作用。本试验拟饲喂雏鸡蛋氨酸缺乏的日粮,探讨其对雏鸡抗氧化功能和免疫球蛋白含量的影响,为蛋氨酸在动物生产中的应用提供理论依据。
1 材料方法
1.1 试验动物及日粮组成 1日龄科宝(Cobb)肉鸡健雏 120 羽,体重(41±3)g,购于常州市广大养殖有限公司。随机分为2组,每组6个重复,每个重复10只雏鸡,其中一个重复用于全程观察记录体重使用。各组雏鸡分别饲养于试验禽笼内,自由采食,饮用去离子水。管理方式与常规育雏一致,试验期42 d。日粮配方参照肉鸡NRC(1994)的营养标准(表1)。
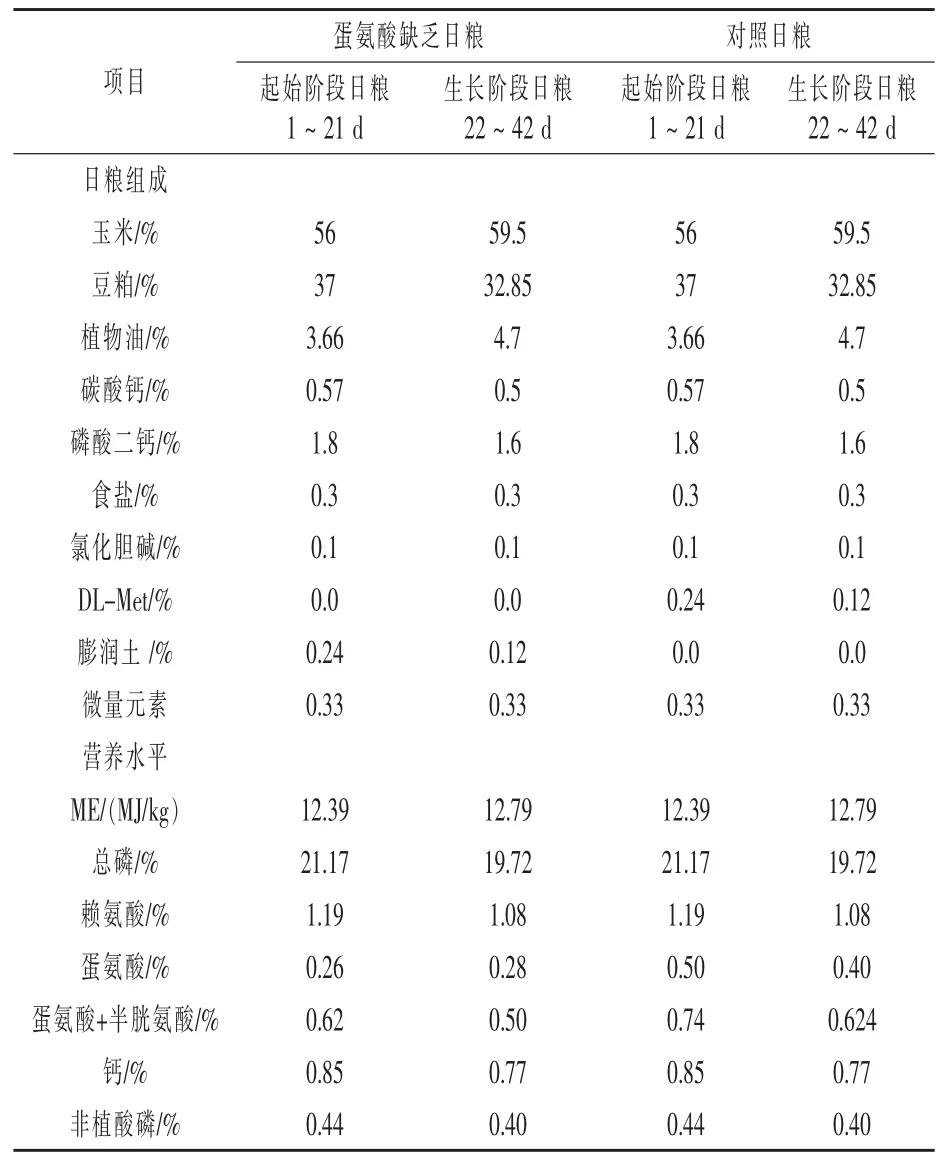
表1 试验日粮组成及营养水平
1.2 主要试剂和仪器 主要试剂:过氧化氢酶(CAT)测定试剂盒(A007-2)、总超氧化物歧化酶(T-SOD)测试盒(A001-1-1)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒 (A005)、还原型谷胱甘肽(GSH)测定试剂盒(A006-1)、羟自由基测试试剂盒(A018)以及丙二醛(MDA)测定试剂盒(A003-1)(购自南京建成生物工程研究所,南京,中国),IgAELISA 试剂盒 (A003403)、IgG-ELISA 试剂盒(A003421)以及 IgM-ELISA 试剂盒(A003403)(上海抚生实业有限公司),生理盐水,PBS缓冲液,冰醋酸(AR级,乙酸含量99%以上)。
主要仪器:分光光度计/酶标仪/半自动生化分析仪 (比色测定波长为532 nm)、恒温水浴箱(孵育温度为95℃以上)、台式离心机、漩涡混匀器、微量移液器、注射器等。
1.3 试验方法
1.3.1 临床观察 试验第 7、14、21、28、35、42 天空腹称取对照组及蛋氨酸缺乏组雏鸡体重,全程观察、统计分析两组雏鸡体重增长情况。
1.3.2 抗氧化指标的检测 试验第14、28、42天,对照组及蛋氨酸缺乏组每组随机抽取5只雏鸡,颈静脉采血,分离血清(不抗凝),用于以下检测抗氧化指标:SOD活性的检测——羟胺法,CAT活性的检测——紫外分光光度法,GSH-Px活性的检测——DTNB显色法比色法,GSH含量性的检测——Pseudo-end Point分光光度法;抑制羟自由基的检测——邻苯三酚比色法,MDA含量的检测——硫代巴比妥酸法TBA法。
具体检测步骤参照南京建成生物工程研究所试剂说明书进行。
1.3.3 免疫球蛋白含量检测 试验第14、28、42天,每组随机抽取5只雏鸡,颈静脉抗凝采血并分离血清,采用鸡免疫球蛋白ELISA测定试剂盒分别测定血清中IgG、IgM和IgA的含量,操作步骤如下:
各组血清样本40 μL,分别加入抗-IgA、抗-IgG以及抗-IgM抗体10 μL、链霉亲和素-HRP 50 μL,盖膜混匀后于 37℃孵育 60 min;清洗后加入显色剂A 50 μL和显色剂B 50 μL,混匀后37℃避光显色10 min;各孔加入终止液50 μL,终止反应至蓝色转为黄色;以空白孔调零,450 nm波长测量各孔吸光度(OD值)。
按照说明书做标准曲线,根据标准品的浓度及对应的OD值计算出标准曲线回归方程,再根据两组中各测定血清样品的OD值在回归方程上计算出对应的样品浓度即为对应免疫球蛋白的含量。
1.4 数据处理 数据经SPSS 16.0及Excel软件统计。各组数据均以“平均数±标准差”表示,并用独立样本T检验分析法比较蛋氨酸缺乏组与对照组间差异的显著性。其中P<0.05表示与对照组相比差异显著,P<0.01表示与对照组相比差异极显著。
2 试验结果
2.1 临床观察 试验第6天开始,蛋氨酸缺乏组雏鸡采食量与对照组比较出现较小程度的下降。试验期间对照组及蛋氨酸缺乏组雏鸡均未死亡。蛋氨酸缺乏组雏鸡的生长发育迟缓,与对照组比较,体重降低,体形小。两组雏鸡初始体重无显著差异。14日龄至42日龄蛋氨酸缺乏组雏鸡体重均显著或极显著低于对照组(P<0.05或P<0.01),体重分别降低了 40.54、191.6、218.4 g,如图 1。

图1 试验雏鸡体重增长
2.2 抗氧化指标检测结果
2.2.1 SOD活性的变化 由图2可见,SOD活性在14日龄时与对照组比较降低了21.73 U/mL,但不显著(P>0.05);28日龄时SOD酶的活性显著降低了55.52 U/mL (P<0.05);42日龄时活性极显著降低(P<0.01),降低了52.58 U/mL。
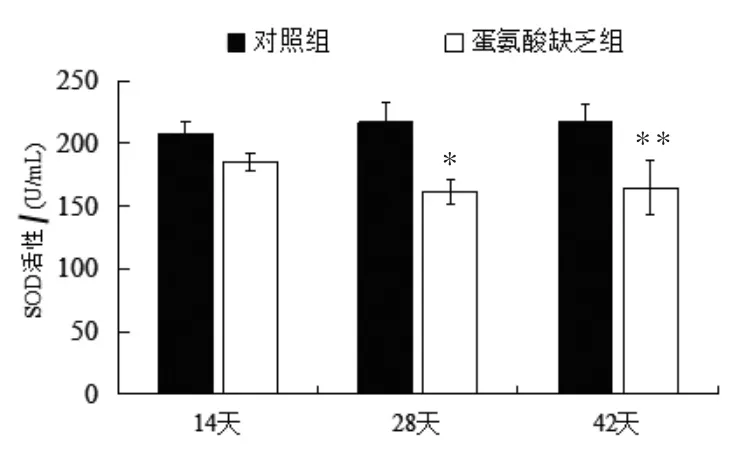
图2 血清SOD活性变化
2.2.2 CAT活性的变化 如图3所示,14日龄和28日龄时蛋氨酸缺乏组CAT酶活性与对照比较分别显著降低 (P < 0.05)14.54、17.31 U/g Hb;42日龄时,蛋氨酸缺乏组CAT酶的活性降低了 29.35 U/gHb(P < 0.01)。

图3 血清CAT活性变化
2.2.3 GSH-Px活性的变化 如图4所示,GSH-Px活性在14日龄时与对照组比较均无显著变化(P>0.05),降低了79.71 U,28日龄和42日龄时蛋氨酸缺乏组GSH-Px活性显著降低(P<0.05),分别减少了 102、132.75 U。

图4 血清GSH-Px活性变化
2.2.4 GSH含量性的变化 如图5所示,GSH的含量变化较显著,14日龄时蛋氨酸缺乏组GSH含量无显著变化,仅降低了0.12 mg GSH/L(P>0.05),28日龄和42日龄时GSH含量与对照组相比分别降低了 0.71、0.88 mg GSH/L(P < 0.01)。

图5 血清GSH含量性变化
2.2.5 抑制羟自由基的变化 如图6所示,14日龄时蛋氨酸缺乏组抑制羟自由基能力与对照组相比无显著的变化(P>0.05),仅降低了1.1 U/mL;28日龄和42日龄时缺乏组抑制羟自由基能力显著或极显著降低 (P<0.05或P<0.01),分别降低了46.5、91.5 U/mL。

图6 血清抑制羟自由基能力变化
2.2.6 MDA含量的变化 如图7所示,MDA的含量在14日龄时蛋氨酸缺乏组与对照组相比升高了0.26 nmol/mL(P < 0.05),28日龄和 42日龄时缺乏组MDA的含量分别升高了1.11、1.28 nmol/mL(P<0.05或P<0.01)。

图7 血清MDA含量变化
2.3 免疫球蛋白含量检测结果
2.3.1 IgA含量的变化 由图8可见,14日龄时,蛋氨酸缺乏组IgA含量与对照组比较无显著变化 (P>0.05),28日龄和42日龄时,IgA含量与对照组比较差异极显著(P<0.01),分别降低2.22、3.07μg/mL。
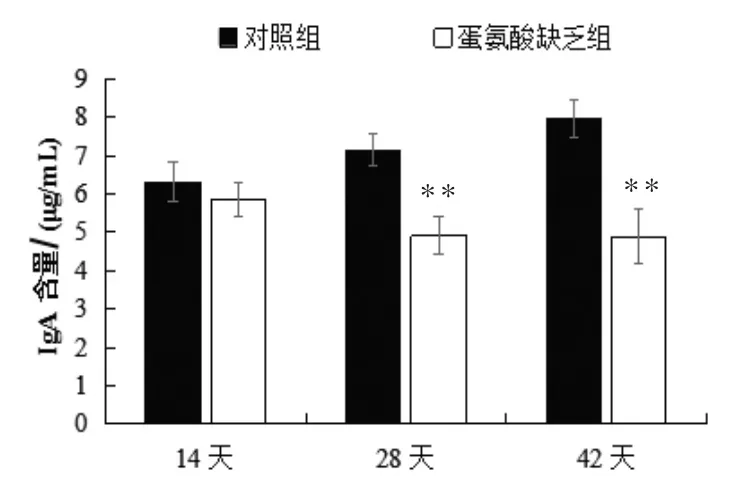
图8 血清IgA含量变化
2.3.2 IgG含量的变化 由图9可见,14日龄和28日龄时,蛋氨酸缺乏组IgG含量与对照组相比分别显著降低了 3.46和 3.55 μg/mL (P<0.05),42日龄时,IgG含量极显著低于对照组 (P<0.01),降低了 7.16 μg/mL。

图9 血清IgG含量变化
2.3.3 IgM含量的变化 由图10可见,14日龄至42日龄时,蛋氨酸缺乏组IgM含量与对照组相比均显著或极显著低于对照组 (P<0.05或P<0.01),分别降低了 1.71、2.7、2.85 μg/mL。

图10 血清IgM含量变化
3 讨论
本试验临床研究发现,雏鸡饲料中蛋氨酸缺乏会导致雏鸡生长受到抑制,食欲减退等临床症状,这与 Carew 等(2003)及 Konashi等(2000)研究报道的临床症状相似。雏鸡出现生长抑制可能主要是蛋白质沉积能力受到影响,即蛋氨酸对蛋白质的合成率和分解率起作用(容庭等,2008),蛋氨酸摄入不足就会影响蛋白质的合成,继而导致雏鸡生长受到抑制。
机体一直处于自由基产生和清除的平衡过程,若平衡失调,机体细胞就会有过多的氧化脂质类物质积聚,自由基的持续产生会超过细胞内的抗氧化防御机制,导致氧化应激(Halliwell,2007)。抗氧化防御机制最主要的即是抗氧化剂,它主要包括抗氧化酶类和非抗氧化酶类。抗氧化酶类有SOD和CAT,它们是组织细胞抗氧化的第一道防线,可以清除细胞产生的H2O2(Adedara等,2010)。本试验研究发现,蛋氨酸缺乏组雏鸡抗氧化酶SOD、CAT和GSH-Px活性均降低,最终导致羟自由基的产生而引起脂质过氧化作用。在非酶类抗氧化剂中GSH发挥着主要作用,它是机体氧化应激的早期生物学标志 (Gagliano等,2006)。本试验中GSH-Px活性的降低可能也由于GSH活性的降低导致的。本试验发现蛋氨酸缺乏组MDA含量均显著升高。MDA是通过某些初级或次级脂质过氧化产物的分解产生的终产物。它的产生可以导致膜流动性的改变,并使膜的脆性增加(Chen等,1994),并产生许多生物分子,包括DNA、脂质、蛋白质、碳水化合物或任何相近的分子,最终一连串的连锁反应导致机体组织细胞的损伤。而蛋氨酸缺乏导致氧化损伤可能是因为它作为谷胱甘肽的前体氨基酸,在保护细胞免受氧化损伤和抗氧化中发挥着十分重要的作用(Reed,1990;Reed 等,1977),其缺乏可导致自由基产生,最终因蛋氨酸缺乏诱导了雏鸡机体的抗氧化功能降低。
免疫球蛋白尤其是血清中的免疫球蛋白是介导体液免疫的主要抗体,也是反映全身免疫水平或免疫应答水平的重要指标。本研究发现,蛋氨酸缺乏组雏鸡血清IgA、IgG和IgM含量与对照组相比显著或极显著降低,其原因可能是与法氏囊结构受损后B淋巴细胞数量的减少有着密切的关系(Wu 等,2013),此结果也与张永翠等(2009)和侯永清等(2001)在新西兰肉兔和断奶仔猪上研究结果一致。由此推测蛋氨酸缺乏会导致雏鸡浆细胞抗体产生过程受到抑制,从而使免疫球蛋白(I-gA、IgG和IgM)生成量减少,表明机体体液免疫功能受损。
4 结论
蛋氨酸缺乏可导致雏鸡抗氧化功能和体液免疫功能下降,从而造成机体损伤和抵抗力降低。

