再造型胡萝卜复合脆片中类胡萝卜素生物利用度
候春辉,易建勇,毕金峰,金新文*,彭 健,刘嘉宁,赵圆圆,刘常金
(1.中国农业科学院农产品加工研究所,农业农村部农产品加工重点实验室,北京 100193;2.天津科技大学食品工程与生物技术学院,天津 300457;3.新疆农垦科学院农产品加工研究所,新疆 石河子 832000)
类胡萝卜素是一类广泛存在于果蔬中,具有8 个类异戊二烯基本结构的脂溶性天然色素,具有VA原活性、抗氧化、预防心血管疾病、保护视网膜等功效[1]。在植物组织中,类胡萝卜素主要存在于细胞内的有色体中,在有色体的发育过程中,形成油脂类、蛋白质和类胡萝卜素组成的特殊亚结构单元,常见的有色体结构形态有晶体状、球状、纤维状、膜状或管束状等[2-3],这种独特的结构对类胡萝卜素在加工过程中的释放率、稳定性以及消化率有很大的影响[4]。由于类胡萝卜素的脂溶特性和其特殊的胞内存在形式,类胡萝卜素被人体利用前必须从植物组织细胞中释放出来,然后在消化过程中进入油相并形成脂滴,进而形成可被小肠吸收的微胶束。因此,大部分果蔬食品中类胡萝卜素的生物利用度通常很低,不到10%[5]。
众所周知,发挥类胡萝卜素上述生理功效的决定因素是生物利用度而不是食品中类胡萝卜素的绝对含量[6]。实现生物利用度的前提条件是其生物有效性[7],即食物经胃肠道消化后释放出来的,且可被小肠吸收的那部分类胡萝卜素[8],因为在很多研究中将其作为生物利用度,在本实验中亦将生物有效性称作生物利用度。虽然人体与动物实验是研究营养素生物利用度最直接有效的方式,但这些方法受到技术和伦理的限制[9],而采用体外消化模型能很好地解决以上问题。体外消化模型相对容易,且适用于大量的样品,适合作为研究各种消化条件或其他因素对营养素生物利用度影响的手段[1]。近年来,在类胡萝卜素的体外消化模型研究中,一方面集中于机械破碎程度(粒径大小)[10-11]、加热过程[12-13]以及油脂类别[14-15]等因素对类胡萝卜素的释放、保留率和生物利用度的影响;另一方面集中于利用高压均质、加热、超声处理、加入油脂等[16-18]方式提高果蔬食品中类胡萝卜素生物利用度,且基本停留在对汁状、乳状或浆状样品[9,19]的胃和小肠阶段的体外模拟消化层面。但是对固体或干燥产品的消化特点,尤其是真实的口腔咀嚼对生物利用度影响的研究很少,口腔咀嚼部分被机械破碎方式(切碎、打粉、筛分、打浆等)所代替,然而这样的机械方式不足以反映咀嚼食物的真实性。Epriliati等[20]发现牙齿对食物既有猛烈的冲击作用又有温和的挤压作用;而且Hoerudin等[21]发现咀嚼与机械破碎对蔬菜细胞结构的破坏有显著性差异;除此之外,咀嚼还包括润滑、软化以及唾液的稀释等过程[22],这是机械方式不能模拟的。
胡萝卜中富含类胡萝卜素,其中β-胡萝卜素含量较高。本研究以前期研究得到的感官品质较佳的胡萝卜鲜样、热风联合压差闪蒸干燥胡萝卜脆片(以下简称AD-DIC脆片)、热风联合压差闪蒸干燥再造型胡萝卜复合脆片(以下简称R-AD-DIC脆片)、真空冷冻干燥联合压差闪蒸干燥再造型胡萝卜复合脆片(以下简称R-FD-DIC脆片)为对象,将人体口腔咀嚼与胃、小肠的体外模拟消化结合,探究不同加工方式和口腔咀嚼程度对胡萝卜产品消化特性以及类胡萝卜素生物利用度的影响,为开发品质优良且具有较高类胡萝卜素吸收率的再造型复合果蔬休闲产品提供理论支撑。
1 材料与方法
1.1 材料与试剂
胡萝卜(品种:黑田五寸;产地:河北)、马铃薯(品种:大白花,产地:河北)、麦芽糖醇购于北京上地小营批发市场,均存放于4 ℃冷库。
胃蛋白酶(≥250 U/mg)、脂肪酶(100~500 U/mg)美国Sigma公司;猪胆盐 国药集团有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CPA-125电子天平 德国Sartorius公司;DHG-9123A电热恒温鼓风箱 上海精宏实验设备有限公司;QDPH10-1压差闪蒸干燥设备 天津市勤德新材料科技有限公司;ALPHA1-4Lplus真空冷冻干燥设备 德国Christ公司;UV-1800紫外分光光度计 日本岛津公司;907 Titrando全自动电位滴定仪 瑞士Metrohm有限公司;Mastersizer 2000激光粒径仪 英国Malvern公司;LSM 880激光共聚焦扫描显微镜 德国蔡司公司。
1.3 方法
1.3.1 样品制作
胡萝卜脆片:胡萝卜→清洗、去皮→切片→-18 ℃冷冻12 h→常温渗透90 min(麦芽糖醇液60 °Brix)→热风预干燥至干基水分质量分数35%~40%→压差闪蒸干燥(闪蒸温度100 ℃,停滞时间15 min,抽空温度65 ℃,抽空时间3 h)。
再造型胡萝卜复合脆片:胡萝卜、马铃薯→清洗、去皮、切条→蒸汽加热30 min→复配(胡萝卜、马铃薯质量比1∶1)→打浆→添加辅料(麦芽糖醇:添加量为浆料总质量的11.6%)→摊片→预干燥至干基水分质量分数25%→压差闪蒸干燥。
其中,再造型胡萝卜复合脆片的预干燥分别采用真空冷冻(FD)和热风(AD)预干燥,真空冷冻预干燥条件为:再造型浆片在-80 ℃条件下进行预冻,预冻12 h后随即真空冷冻干燥12 h,冷阱温度为-49 ℃,真空度约为0.37 mbar;热风预干燥条件为:热风温度70 ℃,将复合脆片预干燥至干基水分质量分数25%(需要3.5~4.0 h)。压差闪蒸干燥的条件均为:闪蒸温度90 ℃,停滞时间10 min,抽空温度65 ℃,抽空时间1 h。
1.3.2 口腔咀嚼与体外胃肠消化模拟
1.3.2.1 口腔消化
分别称取胡萝卜鲜样、AD-DIC脆片、R-AD-DIC脆片、R-FD-DIC脆片1.0 g,用纯净水将口腔漱干净后,再将样品放入口中进行咀嚼,由6 名志愿者分别咀嚼5、15、30 次后收集于容器中。再用19 mL纯净水漱口,将消化液收集于同一个容器中。按口腔消化液总质量计算,加入1%的玉米油。将上述样品分别置入37 ℃水浴锅中保温10 min。
1.3.2.2 体外模拟胃消化
胃和小肠的体外消化模拟参照Espinal-Ruiz等[23]的方法并稍作调整。提前将人工胃液储备液(2 g NaCl、7 mL HCl定容于1 L蒸馏水中)配制好,溶液可在4 ℃冰箱中贮藏一个月。胃蛋白酶工作液现配现用,消化实验前45 min将质量分数0.32%胃蛋白酶加入人工胃液储备液中配成胃蛋白酶工作液,按照工作液与口腔液质量比1∶1配制,并搅拌30 min后,于37 ℃水浴锅中保温15 min。将口腔阶段后的消化液pH值调节到2.50±0.02,再加入胃蛋白酶工作液,搅拌混匀,随后调节pH值到2.50±0.02,置于37 ℃恒温水浴锅中100 r/min振荡2 h。
1.3.2.3 体外模拟小肠消化
消化实验前24 h配制好胆盐溶液(54 mg/mL,溶于5 mmol/L磷酸盐缓冲液中),并提前45 min配制好脂肪酶工作液(24 mg/mL,溶于5 mmol/L磷酸缓冲液中),分别搅拌30 min,于37 ℃水浴锅中保温15 min。将胃消化阶段后的消化液(40 mL)转移至pH自动电位滴定仪的水循环杯中(温度37 ℃),用0.25 mol/L NaOH溶液将消化液的pH值滴定至6.995±0.005后,加入2 mL小肠盐溶液(含0.25 mol/L CaCl2和3.0 mol/L NaCl)和5 mL胆盐溶液。消化液充分混合后,再加入3.5 mL脂肪酶溶液。用pH自动电位滴定仪将pH值恒定在6.995±0.005,小肠消化阶段持续2 h。将消化结束后的消化液在4 ℃、9 048hg条件下离心40 min,取出上清液,用于类胡萝卜素含量和生物利用度分析。
1.3.3 类胡萝卜素的提取与测定
根据Knockaert等[24]的方法调整后进行测定。取消化后的上清液20.0 g,加入0.2 g的NaCl或CaCl2,再加入50 mL提取液(50%(体积分数,下同)正己烷、25%丙酮、25%乙醇、0.1% 2,6-二叔丁基-4-甲基苯酚),混合液在室温下搅拌20 min后,加入15 mL蒸馏水,再搅拌10 min。用分液漏斗将含胡萝卜素的有机相和水相分离,进行旋转蒸发,用正己烷溶解残渣并转移至容量瓶中定容至5 mL,并在450 nm波长处测吸光度,以正己烷作对照。类胡萝卜素含量及生物利用度分别按式(1)、(2)计算。
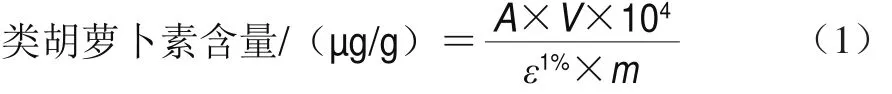
式中:A为450 nm波长处的吸光度;V为提取液总体积/mL;m为测定用样品的质量/g;ε1%为β-胡萝卜素在正己烷中的摩尔消光系数(2 560 cm2/mol)。
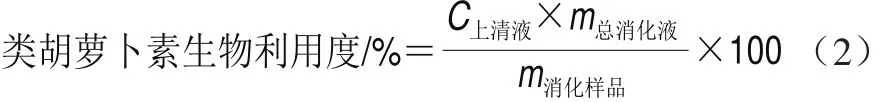
式中:C上清液为离心后在上清液中提取的类胡萝卜素含量/(μg/g);m总消化液为消化结束后消化液的质量/g;m消化样品为消化样品所测得的类胡萝卜素总质量/μg。
1.3.4 粒径分布测定
将各阶段结束后的消化液摇匀,稳定体系1 min,使大颗粒和残渣沉淀到底部,取出消化液的上清液部分(口腔:10 mL、胃:30 mL、小肠:30 mL)放入装有蒸馏水的测量杯中,在激光粒度仪(1 250 r/min)中进行测定,每种样品重复2 次,平均粒径用体积平均粒径(D32)表示,粒径分布用相对体积含量表示。
1.3.5 微观结构观察
电子扫描显微镜:胡萝卜样品→采样→固定→喷金→电子显微镜扫描→电子显微镜拍照观察。
激光共聚焦荧光显微镜:取出2 mL各消化阶段的消化液,加入20 μL尼罗红染液(1 mg/mL溶于无水乙醇中储存在-4 ℃冰箱中,稀释4 倍使用)。尼罗红是一种亲脂性的荧光染色剂,能够跟踪油脂和脂溶性类胡萝卜素的位置与大小[15]。将染色后的样品放在共聚焦荧光显微镜上,分别用20 倍目镜和60 倍物镜进行观察拍照。
1.4 数据统计与分析
本实验中采用SPSS 21.0软件进行数据分析处理,方差分析采用ANOVA程序,差异显著性采用Duncan多范围检验方法,P<0.05表示差异显著;采用Origin9.0、Zen软件处理图像。
2 结果与分析
2.1 胡萝卜鲜样与脆片的微观结构变化
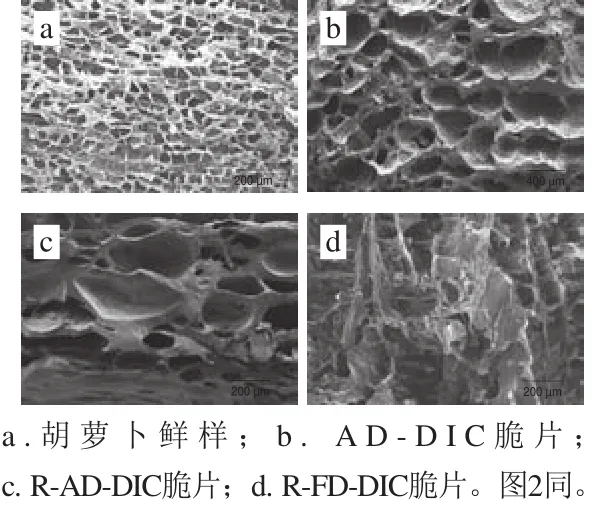
图1 未消化胡萝卜样品的扫描电子显微镜图Fig.1 Scanning electron microscopic images of carrot samples before digestion
咀嚼或机械破碎的难易程度与食物基质的结构(细胞壁、聚集体的紧密程度)密切相关,同时也控制了类胡萝卜素的释放程度,从而影响到产品中类胡萝卜素的生物利用度。由图1a可知,胡萝卜鲜样的结构紧凑致密,孔隙小且数量较多,由于胡萝卜中的细胞小且形状不规则,细胞壁厚且坚固紧密,所以胡萝卜鲜样有较大的硬度[25],使其不易咀嚼,类胡萝卜素不易释放出来,而且在消化过程中,消化酶也不易进入鲜样的细胞内,可能会降低样品的消化率。AD-DIC脆片(图1b)经过热风联合压差闪蒸干燥后,体积较鲜样略微皱缩,但口感比较硬脆,可能由于细胞受到破坏,细胞间隙变大[26],从而使微观结构受到破坏,孔隙数量变少,体积变大,孔隙壁变厚,与鲜样相比,这种微观结构可能较容易释放出类胡萝卜素。再造型胡萝卜复合脆片(图1c和d)是经过质构重组后压差闪蒸联合干燥而成的产品,所以与原有胡萝卜样品的微观结构有很大的差异,尤其是经过真空冷冻联合压差闪蒸干燥的再造型胡萝卜脆片(R-FD-DIC脆片)。由图1c可知,R-AD-DIC脆片外观平整、薄而脆,由于在热风预干燥阶段皱缩较严重,所以微观结构明显塌陷,孔隙数量少、大小不均匀,排列松散,较易咀嚼;由图1d可知,R-FD-DIC脆片由于进行了预冻和真空冷冻预干燥,保持了脆片原始的外观形态,在冷冻干燥期间样品的微观结构基本没有受到破坏,但经过压差闪蒸后,使得脆片的微观结构受到轻微破坏,所以R-FD-DIC脆片的孔隙大小、排列均不规律,容易受到咀嚼力的破坏。
2.2 加工方式和咀嚼程度对胡萝卜样品消化过程中消化液粒径的影响
由表1可知,在不同的消化阶段,4 种胡萝卜产品的消化液平均粒径都分布在7~90 μm之间。因粒径分析时所取样品为消化液上部溶液,因此上述粒径范围不包括消化液底部的大颗粒沉淀。在同一消化阶段中,鲜样和AD-DIC脆片的消化液平均粒径较小,而再造型胡萝卜脆片的消化液平均粒径较大,可能是因为再造型胡萝卜脆片在咀嚼后大部分颗粒溶解在消化液中,黏性增大,增强了絮凝作用[27-28],从而提高了消化液的平均粒径。在不同的消化过程中,鲜样的消化液平均粒径在胃消化阶段明显变小(P<0.05),而在小肠消化阶段变大;AD-DIC脆片消化液的平均粒径呈现出与新鲜胡萝卜样品一样的变化趋势,即消化液粒径经胃消化变小后又在小肠消化阶段显著增加,表明样品中的颗粒在胃消化阶段被消化分解后,其中的悬浮物质在小肠阶段由于絮凝作用又逐渐聚集到一起。与鲜样和胡萝卜脆片不同的是,再造型胡萝卜脆片消化液的平均粒径在胃和小肠阶段都显著增加。再造型胡萝卜脆片在加工过程中经历了蒸煮和打浆破碎等环节,其细胞结构完全破坏,导致淀粉糊化和细胞壁中的果胶等物质大量溶出,进入胃消化阶段,在机械力的作用下淀粉和果胶等大分子可能逐渐聚集形成凝胶[29],这可能是再造型脆片消化液在胃消化阶段粒径增大的原因。此外,由于在胃和小肠消化过程中加入的消化液中含有大量蛋白酶、脂肪酶等物质,它们可能与消化液中的悬浮颗粒发生絮凝作用[30],进一步增大消化液的平均粒径。
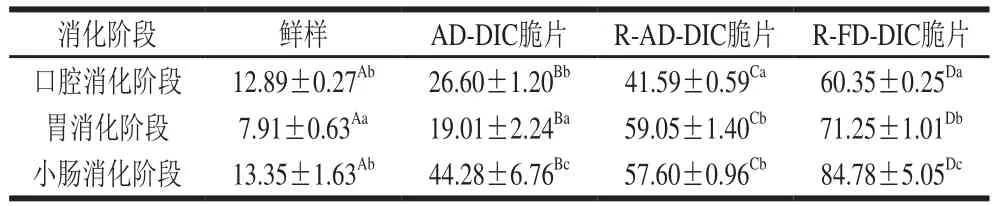
表1 不同胡萝卜样品咀嚼15 次后消化过程中的消化液D32Table1 Average particle size D32 of digestive solutions from different carrot samples chewed 15 timesμm
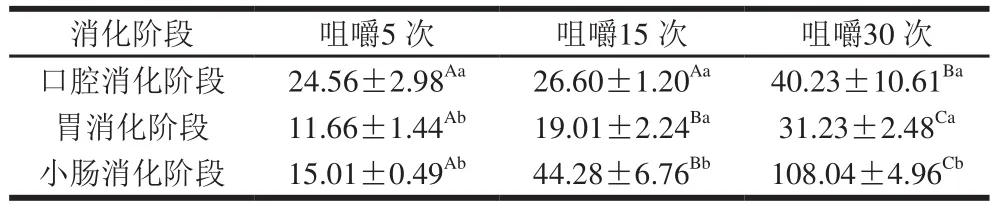
表2 不同咀嚼程度的AD-DIC脆片在消化过程中的消化液平均粒径D32Table2 Average particle size D32of digestive solutions from AD-DIC chips with different mastication degreesμm
由于不同咀嚼程度对再造型胡萝卜脆片消化过程中消化液的粒径分布没有明显影响,所以本研究仅选取了AD-DIC脆片作为研究对象。由表2可知,在口腔阶段,AD-DIC脆片的消化液平均粒径随着咀嚼程度的增加而增大;在胃和小肠阶段,消化液的平均粒径也随着咀嚼程度增高而增大,但是咀嚼程度对平均粒径的影响明显体现在胃和小肠消化阶段,可能是由于随着咀嚼程度的提高,样品的破碎程度越高,分散在消化液中的样品颗粒数量越多,更容易产生絮凝与聚集作用[15],所以消化液粒径增大。

图2 不同样品咀嚼15 次后消化过程中的消化液粒径分布Fig.2 Particle size distribution of digestive solutions from different carrot samples chewed 15 times
由图2a、b可见,鲜样和AD-DIC脆片在口腔阶段消化液的粒径较小,随着消化过程的进行,粒径分布向大粒径方向移动,即在胃和小肠消化阶段粒径变大,这可能是因为经过胃和小肠阶段的振荡、消化酶的作用,消化液中的颗粒逐渐聚集且可能与溶液中的蛋白等大分子物质发生了絮凝作用,所以粒径逐渐变大。由图2c、d可见,对于再造型复合脆片,在口腔、胃和小肠消化过程的粒径分布未发生显著性变化(P>0.05),可能消化液的粒径在胃和小肠阶段存在变大的情况,但是由于只有小部分颗粒凝聚变为大颗粒,所以并没有影响到整体分布。
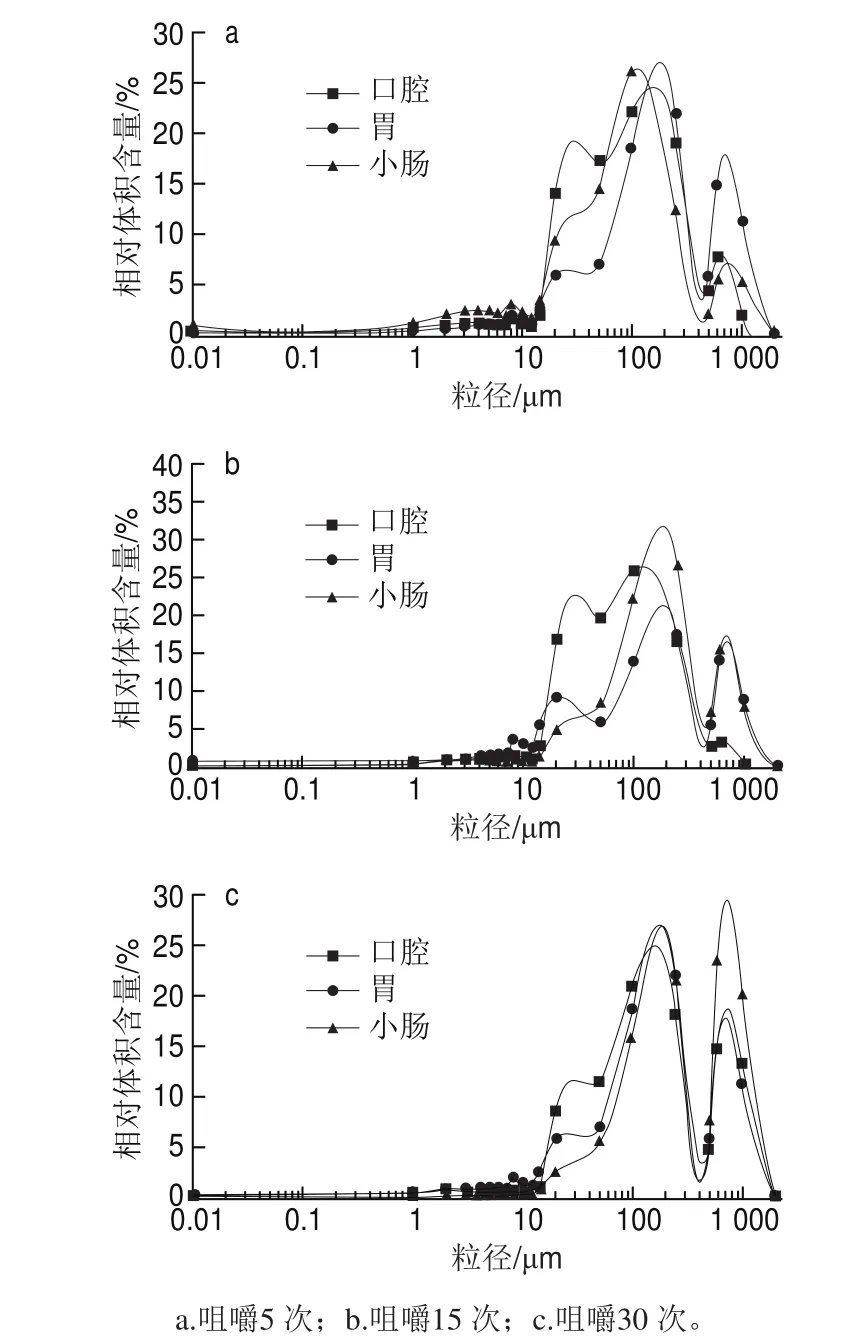
图3 不同咀嚼程度的AD-DIC脆片消化过程中的消化液粒径分布Fig.3 Particle size distribution of digestive solutions from AD-DIC chips with different mastication degrees
由图3可知,咀嚼次数增加,尤其是咀嚼30 次的AD-DIC脆片的粒径在消化过程中明显趋向于变大(右移),可能是样品破碎程度越高,颗粒变小、数量变多,导致絮凝。
2.3 加工方式和咀嚼程度对胡萝卜样品消化过程中消化液微观结构的影响
为了研究消化过程中消化液中样品的消化程度、脂滴状态以及类胡萝卜素的释放程度,采用共聚焦荧光显微镜观察了消化液的微观结构。由图4、5可知,鲜样和胡萝卜脆片在消化过程中消化液的油滴分布状态变化是一致的,即在口腔消化阶段均可观察到较大样品颗粒或呈聚集状态的油脂滴;经过胃消化后,脂滴被分散开成为小脂滴,游离地分散在消化液中并包裹在样品周围;经过小肠阶段胆盐和脂肪酶的作用,脂滴被水解,与类胡萝卜素形成胶束,所以一些大的脂滴消失,只能看到被分解的脂质小颗粒和许多微型胶束。这种变化趋势和Xia Ziyuan等[31]针对不同胡萝卜素状态的生物利用度的研究是一致的。由图4可知,胡萝卜鲜样在小肠消化阶段仍有少量的大脂滴存在,说明油脂消化不彻底,同时也没有较多的类胡萝卜素参与形成胶束,这可能导致类胡萝卜素生物利用率降低;AD-DIC脆片与R-AD-DIC脆片在小肠消化阶段的消化液状态没有显著性差别;与R-AD-DIC脆片比较,R-FD-DIC脆片在口腔和胃消化阶段有大的凝聚团块出现,这种聚合行为将不利于小肠消化阶段形成类胡萝卜素胶束。
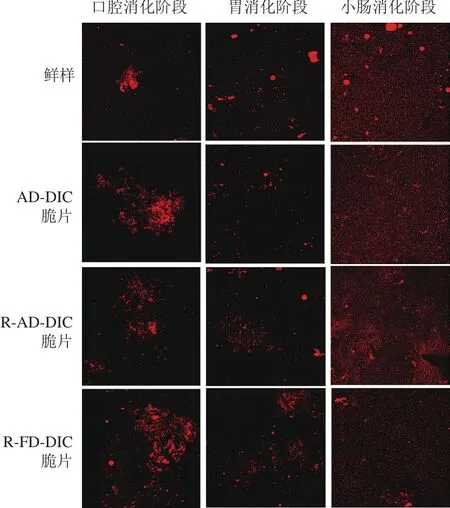
图4 不同胡萝卜样品咀嚼15 次后消化过程中的共聚焦荧光显微镜图Fig.4 Confocal fl uorescent microscopic images of digestive solutions from different carrot samples chewed 15 times
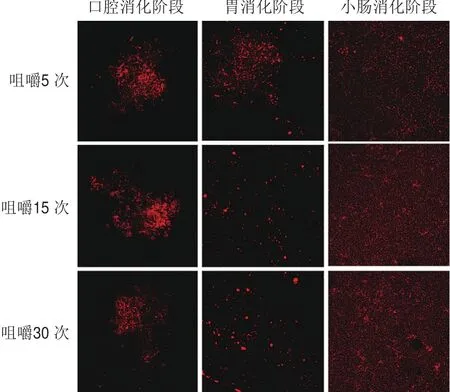
图5 不同咀嚼程度的AD-DIC脆片消化过程中的共聚焦荧光显微镜图Fig.5 Confocal fl uorescent microscopic images of digestive solutions from AD-DIC chips with different mastication degrees
由图5可见,随着咀嚼程度变高AD-DIC脆片在小肠消化阶段的消化状态越好,即油脂分解程度高、微型胶束也较多,可能随着咀嚼程度增高类胡萝卜素的生物利用度也会提高。但是共聚焦荧光显微镜与激光粒度仪所测得的结果略有不同,激光粒度仪显示最大的颗粒聚集体在小肠阶段,而共聚焦荧光显微镜显示最大的颗粒聚集体在口腔阶段,这种现象同样出现在Espinal-Ruiz[23]和Xia Ziyuan[31]等的研究中。可能是由于两种方法的原理不同,激光粒度仪分析过程中的稀释和搅拌过程会使得小颗粒聚集,大颗粒破碎分散,从而使粒径大小趋于平衡[32],尤其是口腔消化阶段所形成的大聚集体可能被破碎而分散,使得激光粒度仪所测得的粒径较小。由于激光粒度仪所测得的粒径主要是取决于仪器的操作条件而不是样品本身的特性[32],所以消化液的微观结构变化主要还是依据共聚焦荧光显微镜所观察到的结果。
2.4 加工方式和咀嚼程度对胡萝卜样品中类胡萝卜素生物利用度的影响
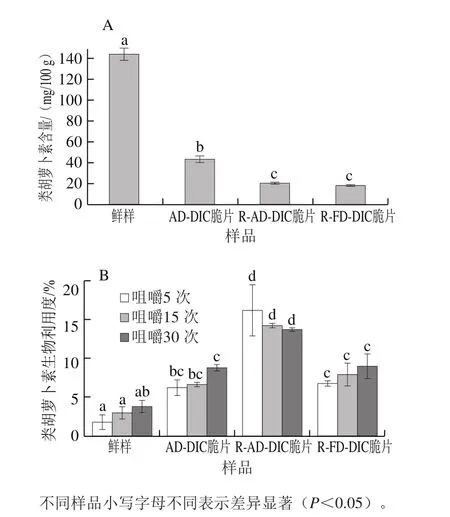
从图6A可知,由于胡萝卜鲜样被打浆机破碎导致细胞破碎释放出类胡萝卜素,鲜样的类胡萝卜素含量(以干基计)最高,大约是胡萝卜脆片含量的3 倍。Mayer-Miebach等[33]研究得出胡萝卜中的类胡萝卜素尤其是胡萝卜素在高温干燥条件下会降解大约20%,因此经过压差闪蒸联合干燥的AD-DIC脆片类胡萝卜素含量降低。再造型胡萝卜复合脆片类胡萝卜素含量最低,其含量是AD-DIC脆片含量的43.3%~56.7%(图6A),原因是再造型脆片是胡萝卜与马铃薯按质量比1∶1复合而成;R-AD-DIC与R-FD-DIC脆片的类胡萝卜素含量无显著性差异,推测是因为其均经过了压差闪蒸干燥,该过程是工艺中导致类胡萝卜素降解的主要操作阶段。
由图6B可知,胡萝卜鲜样的类胡萝卜素生物利用度最低,原因可能是鲜样咀嚼后破碎程度不高。类胡萝卜素被人体吸收利用需要经历从果蔬原料中释放、溶解、经消化形成水溶性的胶束,进而被小肠吸收利用这几个重要阶段。然而,由于类胡萝卜素主要存在于胡萝卜色素母细胞内的有色体中,所以要实现类胡萝卜素的生物利用,首先需要破除有色体膜、细胞壁等天然存在的结构性物理屏障[33]。新鲜胡萝卜样品经咀嚼后,仍有大量类胡萝卜素被有色体、细胞壁或多细胞组织包裹于其中,消化酶不能接触到这部分类胡萝卜素,所以导致生物利用度较低;由于AD-DIC脆片在压差闪蒸过程中细胞和结构受到破坏,所以在咀嚼和消化过程中较易释放出类胡萝卜素,提高了其生物利用度;而R-AD-DIC脆片的生物利用度最高。Thakkar[34]与Lemmens[35]等发现加热与机械破碎程度(粒径大小)显著提高类胡萝卜素的释放以及生物利用度。本研究中,再造型脆片是经过加热、打浆破碎后干燥而成,所以其细胞破碎程度高,易咀嚼,利于消化,从而类胡萝卜素的生物利用度最高;而R-FD-DIC脆片的生物利用度降低,可能是因为脆片的微观结构不均匀以及在小肠消化阶段形成的胶束较少,从而降低了类胡萝卜素的生物利用度。总体上,胡萝卜鲜样与胡萝卜脆片的类胡萝卜素生物利用度随着咀嚼程度增加也呈现升高的趋势,但不同咀嚼程度的再造型胡萝卜复合脆片的类胡萝卜素生物利用度并没有显著性差异(P>0.05)。由此可见,再造型胡萝卜复合脆片无需精细咀嚼即可实现较高的类胡萝卜素生物利用度,这符合现代人们进食节奏快的特点。
3 结 论
胡萝卜鲜样、胡萝卜脆片、再造型复合脆片3 种不同产品形式显著影响其消化液平均粒径,胡萝卜脆片消化过程中的平均粒径会随着咀嚼程度增加而减小,但却促进了消化液中颗粒物质的聚集;胡萝卜鲜样的组织结构紧密,咀嚼后类胡萝卜素不易从细胞有色体中释放出来,形成的胶束较少,生物利用度最低,因此从补充类胡萝卜素角度考虑,推荐选择那些包含破碎工艺的胡萝卜加工制品;胡萝卜脆片虽在压差闪蒸过程中结构受到破坏,但细胞结构依然存在,只有提高咀嚼程度才能有效提高类胡萝卜素的生物利用度;再造型胡萝卜复合脆片加工过程中,经历了组织细胞结构被完全破碎后重组,产品经压差膨化后结构疏松,易受到咀嚼力的破坏,所以类胡萝卜素容易释放出来并在消化中形成较多胶束,生物利用度较高。总地来看,经过热风联合压差闪蒸干燥的再造型胡萝卜复合脆片的类胡萝卜素生物利用度相对较高,这种形式的产品是一种能有效补充类胡萝卜素的果蔬休闲产品。

