3 种方法提取的澳洲坚果蛋白功能性质与构象的关系
陈 豪,钟俊桢*,黄宗兰,熊 洋,钟业俊,刘成梅
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
澳洲坚果(Macadamia integrifolia)属山龙眼科,起源于澳大利亚东部的热带雨林,在二十世纪六七十年代被引入中国,主要在我国南方地区种植。澳洲坚果果仁因香脆可口、风味独特而被应用于食品行业如糖果和烘焙等。坚果仁中油脂质量分数高达70%以上,其中,澳洲坚果中总脂肪酸的70%是单不饱和脂肪酸[1]。目前,在澳洲坚果油的健康益处方面已经有很多研究[2-4],其他研究主要集中在干燥或烘烤过程中还原糖对褐变反应的影响[5-7]。
近年来,一些植物果实(坚果、腰果等)作为一种高营养价值、相对较低成本的优质蛋白来源吸引了研究者们广泛的关注与兴趣[8]。澳洲坚果仁中含有大约9%的蛋白质,富含18 种氨基酸,其中有10 种是必需氨基酸,人体无法自身合成。此外,澳洲坚果也用作油脂提取的原料,并能得到低脂肪的果粕副产物[4]。提取油脂后的果粕中含有大量蛋白质和平衡的氨基酸组分,是很好的植物蛋白资源。Siwaporn等[9]的研究表明,澳洲坚果脱脂粉中含有约30%的蛋白质。可应用于食品工业的植物蛋白应该具备一些理想的功能特性,如溶解性、乳化性、起泡性、凝胶性以及较好的持水持油性等[10-11]。目前,国内外学者已深入研究过一些植物蛋白,如大豆分离蛋白、大米蛋白、花生蛋白、豌豆分离蛋白以及菜籽分离蛋白等。然而,国内外对澳洲坚果蛋白的功能性质的研究却有限。为充分开发和利用澳洲坚果蛋白这种优质植物蛋白资源,研究其功能特性尤为重要。
不同的植物蛋白提取方法得到的蛋白具有一定的理化以及功能特性差异。蛋白的提取方法主要有水相萃取法、有机溶剂浸提法、酶解法等。考虑到本研究处于一个基础研究阶段以及其他方法如有机溶剂提取法中的有机试剂可能有毒、挥发性高、蛋白质易变性等,本课题选取水相萃取法作为澳洲坚果蛋白的提取方法。水相萃取法具有操作简单、方便易行以及萃取水相较安全等优点。最常见的萃取相有稀酸、稀碱以及盐溶液等,主要包括碱提酸沉法、Tris-HCl提取法以及氯化钠提取法等。目前,对于不同植物蛋白的功能性质,研究主要集中在不同提取条件对植物蛋白功能性质的影响上。许多报告表明,蛋白质提取的处理方法会影响蛋白质的组成和功能。Ogunwolu等[12]研究了碱提-等电点沉淀与碱提-甲醇沉淀两种方法提取得到的腰果浓缩蛋白和分离蛋白,并发现腰果蛋白的功能性质(吸水吸油能力、乳化稳定性、发泡性以及凝胶性)得到了改善,均高于脱脂腰果粉。Bora等[13]研究不同pH值对澳洲坚果分离蛋白的提取率和功能性质的影响,结果表明pH值对澳洲坚果蛋白的功能性质影响显著。Karaca等[14]研究等电点沉淀法与盐萃取法制备的油菜籽蛋白与亚麻仔蛋白的乳化性能,并探究其乳化性能与构象之间的关系。在本实验室前期的研究中,工作主要集中在腰果蛋白的提取工艺优化、功能性质研究以及其氨基酸组成分析上[15-16]。此外,Liu Chengmei等[17]研究表明蛋白的功能性质与其构象有显著联系。然而,不同提取方法下澳洲坚果蛋白的功能性质与其构象以及两者之间的关系的研究很少。
因此,基于本课题组前期的一些研究,本实验使用碱提取法、Tris-HCl提取法和氯化钠提取法提取澳洲坚果脱脂粉中的蛋白质分别得到3 种不同的澳洲坚果蛋白,并对其溶解性和乳化性进行对比与研究。此外,本实验采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、粒度分布、内源荧光光谱、表面疏水性、扫描电子显微镜、氨基酸分析对其构象进行表征和研究,以期阐明不同提取方法3 种澳洲坚果蛋白的功能性质和构象之间的关系,为开发和利用澳洲坚果蛋白提供一些理论基础和指导。
1 材料与方法
1.1 材料与试剂
澳洲坚果 江西南昌洪城大市场。在4 ℃保存直至使用。原料及分离蛋白的蛋白含量用微量凯氏定氮仪测定(N×5.3)并得到原料蛋白质质量分数为9.2%。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、8-苯胺基-1-萘磺酸钠、三(羟甲基)氨基甲烷(tris (hydroxymethyl) aminomethane,Tris-HCl) 索莱宝生物科技有限公司;石油醚、苯酚、溴酚蓝 广东汕头西陇科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
微量凯式定氮仪 丹麦Kjeltec公司;UV-1600PC紫外分光光度计 上海美普达仪器有限公司;F-4500荧光分光光度计 日本Hitachi公司;Nicomp 380/ZLS Zeta potential/粒度仪 美国Nicomp公司;Mini-PROTEAN Tetra Cell电泳仪 美国Bio-Rad公司;氨基酸分析仪 德国Sykam公司;扫描电子显微镜 德国Deutschland GmbH公司;LGJ-1-A80冷冻干燥机 北京亚泰科隆仪器技术有限公司;DFY-50磨粉机 中国戴德公司。
1.3 方法
1.3.1 澳洲坚果脱脂粉的制备
将手工剥壳后的澳洲坚果仁用磨粉机碾磨30 s,然后用料液比1∶10(g/mL)的石油醚浸提,在室温连续搅拌22 h,然后通过抽滤将原料和溶剂分离,分离得到的粗脱脂粉再次用石油醚浸提,然后重复上述步骤,脱脂粉中的残留溶剂在通风橱中于室温下挥发1 h除去,得到的澳洲坚果脱脂粉经真空包装后于-4 ℃贮存。
1.3.2 从澳洲坚果脱脂粉中提取分离蛋白
1.3.2.1 碱提酸沉澳洲坚果蛋白(alkali extraction and acid precipitation extracted macademia protein isolate,MAPI)
澳洲坚果脱脂粉与去离子水以1∶50(g/mL)混合,并用1 mol/L NaOH溶液调节pH值至9.0。样品在45 ℃搅拌2 h,然后在室温下以4 000 r/min离心15 min,收集上清液并用1 mol/L HCl溶液调pH值至4.5使蛋白沉淀,以4 000 r/min离心15 min,收集沉淀蛋白,然后回收并再分散到去离子水中,最后,调节分散液pH值至7.0并冻干。
1.3.2.2 三(羟甲基)氨基甲烷提取澳洲坚果蛋白(tris (hydroxymethyl) aminomethane extracted macademia protein isolate,MTPI)
澳洲坚果脱脂粉与0.2 mol/L Tris-HCl(pH 7.5)以1∶50(g/mL)的比例混合,样品在45 ℃搅拌2 h,然后在室温以4 000 r/min离心15 min,然后用传统的MAPI法从获得的上清液中沉淀出蛋白并冻干。
1.3.2.3 氯化钠提取澳洲坚果蛋白(sodium chloride extracted macadamia protein isolate,MSPI)
澳洲坚果脱脂粉与0.14 mol/L NaCl溶液以1∶50(g/mL)的比例混合,样品在45 ℃搅拌4 h,然后在室温下以4 000 r/min离心15 min,收集上清液并用1 mol/L HCl溶液调pH值至4.5使蛋白沉淀,以4 000 r/min离心15 min,收集沉淀蛋白,然后再分散到去离子水中,在蒸馏水中透析24 h并冻干。
1.3.3 蛋白质溶解度测定
溶解在去离子水中的蛋白质分散体(0.1 g/100 mL)经磁力搅拌30 min,然后用0.5 mol/L HCl溶液或0.5 mol/L NaOH溶液调节pH值至2.0、3.5、5.0、6.5、8.0、9.5、11.0,磁力搅拌30 min后,在4 000 r/min离心15 min。经适当稀释后,以牛血清蛋白为标准,采用Bradford[18]法测定上清液中的蛋白质含量。蛋白质溶解度为每100克蛋白质中可溶性蛋白质的克数。所有测定做3 个平行实验。
1.3.4 乳化特性测定
根据Zhao Guanli等[19]的方法稍作修改后测定乳化活性指数(emulsifying activity index,EAI)。将5 mL色拉油和15 mL溶于去离子水中的样品溶液(0.1 g/100 mL)混合,混合液用均质机以9 500 r/min的转速均质1 min制成乳状液。均质后立即用移液枪从容器底部吸取乳状液50 µL,并与5 mL 0.1 g/100 mL的SDS溶液混合,在旋涡混合器中摇晃5 s,然后用UV1600紫外分光光度计在500 nm波长处测定其吸光度。进行3 次平行实验。EAI值公式计算如下:
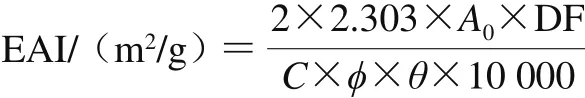
式中:DF为稀释因子(100);C为初始蛋白质量浓度/(g/mL);ϕ为光程(1 cm);θ为形成乳液的油的体积分数(0.25);A0为在0 min时稀释后乳化液的吸光度。
1.3.5 SDS-PAGE分析
SDS-PAGE实验是根据Laemmli[20]的方法用12%分离胶和5%浓缩胶在不连续缓冲系统中进行的。在0.01 mol/L、pH 7.0的磷酸盐缓冲液中的蛋白样品溶液(1 mg/mL)与4×样品缓冲液(含0.2 mol/L Tris-HCl(pH 6.8)、质量分数8% SDS、体积分数4% β-巯基乙醇、体积分数40%甘油和质量分数0.4%溴酚蓝)以1∶3体积比混合,然后混合液在沸水中加热5 min,接着以10 000 r/min离心10 min,每个样品取8 µL上清液加入各加样孔中,同时加入低分子质量Marker(14.4~106 kDa)作为参比。在浓缩胶和分离胶中分别以8 mA和15 mA的恒流电泳,当染料到达分离胶底部时停止电泳。电泳结束后凝胶用溶于乙酸-甲醇-水(46∶227∶227,V/V)溶液中的考马斯亮蓝R-250(0.05%)染色1 h,然后用甲醇-乙酸-水(50∶75∶875,V/V)溶液脱色12 h。
1.3.6 氨基酸分析
根据Sze-Tao等[21]方法蛋白样品用6 mol/L含10 mmol/L 苯酚的HCl溶液用氨基酸分析仪在110 ℃真空条件下水解24 h。
1.3.7 粒度分布测定
根据Liu Chengmei等[17]的方法,样品在样品分散装置中边搅拌边加入去离子水稀释100 倍,粒度分布用Nicomp 380/ZLS Zeta potential/粒度仪测定。基于动态光散射的Nicomp 380测得的粒度和粒度分布能精确到1 nm。
1.3.8 内源荧光测定
根据Liu Yan等[22]的方法修改后用荧光光度计测定蛋白样品的内源荧光发射光谱。冻干的MAPI、MTPI和MSPI样品溶解在磷酸盐缓冲溶液(phosphate buffer saline,PBS)(0.01 mol/L,pH 7.0)中得到蛋白溶液(1 mg/mL),在20 ℃处理1 h,然后混合液在4 000 r/min 离心15 min,以牛血清蛋白为标准,用Bradford法测定上清液中蛋白质的含量。将得到的上清液稀释至0.2 mg/mL,为了尽量减少酪氨酸残基对发射光谱的影响,蛋白质溶液的激发波长为280 nm,发射波长为300~380 nm,狭缝宽度为5.0 nm。
1.3.9 表面疏水性测定
根据Kato等[23]的方法用8-苯胺基-1-萘磺酸钠(sodium 8-anilino-1-naphthalenesulfonate,ANS)作为荧光探针测定样品的H0值。冻干的MAPI、MTPI和MSPI样品溶解在PBS(0.01 mol/L,pH 7.0)中制成蛋白溶液(1 mg/mL),在20 ℃处理1 h,然后混合液在4 000 r/min离心15 min,以牛血清蛋白为标准,用Bradford法测定上清液中蛋白质的含量。将得到的上清液用相同缓冲液将质量浓度依次稀释至0.5~0.02 mg/mL,然后将20 µL ANS(8.0 mmol/L于相同缓冲液中)加入4 mL蛋白样品中,用荧光光度计在室温测定荧光强度。激发波长为338 nm,发射波长为400~600 nm。用线性回归分析计算得到的荧光强度对蛋白浓度的初始斜率表示表面疏水性H0。
1.3.10 扫描电子显微镜观察
根据Liu Chengmei等[17]的方法稍作修改,冻干的MAPI、MTPI和MSPI用双面胶固定在圆形样品台上,然后用扫描电子显微镜观察样品。扫描电子显微镜在低真空模式下工作。
1.4 统计分析
实验结果以 ±s表示,最小显著差异用IBM SPSS Statistics 19.0检验,P<0.05,差异显著。
2 结果与分析
2.1 蛋白溶解度
图1显示了pH值对澳洲坚果蛋白(MAPI、MTPI和MSPI)溶解度的影响,在pH 2.0~11.0的范围内所有样品都表现出了相似的U型曲线的趋势,这和其他坚果蛋白如腰果脱脂蛋白、胡桃木蛋白、巴西果蛋白类似。根据蛋白质的溶解度曲线,MAPI在pH 5.0时溶解度最低(0.89±0.26)%,而MTPI(4.61±2.82)%和MSPI(2.60±1.92)%在pH 6.5时溶解度最低。根据Swanson[24]的研究报道,豌豆和扁豆球蛋白的等电点为pH 4.5,其清蛋白的等电点为pH 6.0。Papalamprou等[25]报道称等电沉淀主要沉淀球蛋白。此外,Liu等[26]发现用盐提取法提取的产物主要为球蛋白和清蛋白的混合物。因此,MAPI可能主要为球蛋白,而MTPI和MSPI可能主要为球蛋白和清蛋白的混合物,这可能导致MAPI与MTPI和MSPI有不同的等电点。

图1 pH值对MAPI、MTPI和MSPI溶解度的影响Fig. 1 Effect of pH on solubility of MAPI, MTPI and MSPI
从图1可以看出,澳洲坚果蛋白在酸性(pH 2.0、3.5)和碱性(pH 11.0)pH值范围内溶解度较高(>80%),然而在pH 5.0~9.5范围内溶解度低于30%。此外,在酸性pH值范围内MSPI的溶解度高于MAPI和MTPI。然而,在碱性pH值范围内,MSPI的溶解度低于MAPI和MTPI。Aluko等[27]表明酸沉淀分离的油菜籽分离蛋白在pH 7.0时的溶解度较低(<6%),而钙沉淀分离(1 mol/L CaCl2)的分离蛋白溶解度较高(约78.8%)。Yoshie-Stark等[28]表明用等电沉淀法得到的菜籽分离蛋白在pH 7.0的溶解度(约25%)明显低于用超滤法得到的分离蛋白(约90%)。综上所述,不同的提取方法会影响蛋白质的溶解度,这可能是由于不同的提取方法会造成蛋白质的组成和结构不同。
2.2 乳化性质
食物蛋白质的乳化性质一般可以通过EAI评定[29]。如表1所示,3 种方法提取得到的蛋白质的EAI具显著性差异(P<0.05),在中性pH值(6.5~7.5)条件下,MSPI的EAI((246.88±34.23) m2/g)高于MAPI((193.25±9.93)m2/g)和MTPI((84.34±12.30)m2/g)。这一结果与Karaca等[14]的研究一致,其研究表明盐提取法制备的油菜籽分离蛋白的EAI高于等电沉淀法制备的蛋白质。Krause等[30]也报道称NaCl提取的亚麻籽分离蛋白的EAI明显高于等电点沉淀蛋白。EAI还受蛋白质溶解度或表面疏水性的影响[31]。此外,根据Liu Chengmei等[17]研究表明蛋白质的乳化性与其粒径大小呈正比,粒径越小,乳化性更低。由后面的粒径分析可知,MTPI比MAPI具有更小的粒径。综上可得,蛋白的乳化性受提取方法,溶解度,表面疏水性以及粒径等多方面因素的影响。由三者EAI的差异可得,提取方法可能是影响EAI的主要因素。尽管MTPI的蛋白含量比MAPI和MSPI低,在pH 6.5~7.5的范围,3 种蛋白样品的溶解度越高,其EAI反而越低。原因可能还是不同的蛋白提取方法造成蛋白质的组成和结构不同。
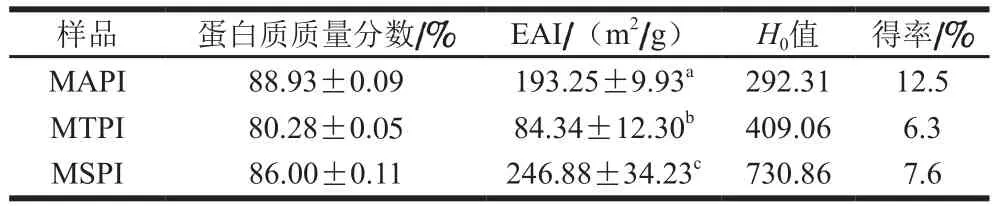
表1 MAPI、MTPI和MSPI的蛋白质含量、乳化性能、H0值和得率Table 1 Protein content, emulsifying properties, H0 values and protein yields of MAPI, MTPI and MSPI
2.3 蛋白得率、蛋白质含量与SDS-PAGE分析
由表1可知,MAPI、MTPI和MSPI的蛋白质得率分别为12.5%、6.3%和7.6%,其蛋白质质量分数分别为(88.93±0.09)%、(80.28±0.050)%和(86±0.11)%。碱提酸沉的蛋白得率和蛋白纯度均高于Tris-HCl提取法和氯化钠提取法,并且蛋白得率越高,蛋白含量也越高。李莹莹等[32]报道了Tris-HCl提取法、盐溶法、磷酸缓冲液提取法以及TCA-丙酮提取法得到的4 种白果蛋白,并且Tris-HCl提取法获得的白果蛋白含量最高。Karaca等[14]研究表明各种植物蛋白得率在20%~29%之间。为进一步探究这3 种蛋白质的组成,用SDS-PAGE研究3 种分离蛋白的多肽条带,如图2所示。对于3 种提取方法,在还原条件下主要有4 个条带(a1~a4),其他次要条带也能从图中观察到。不同提取方法得到的蛋白质的分子质量分布在14.4~50 kDa狭窄范围内。总之,澳洲坚果蛋白大部分是低分子质量蛋白,这与其他坚果蛋白如榛子蛋白[31]、白木通籽蛋白[32]很相似。
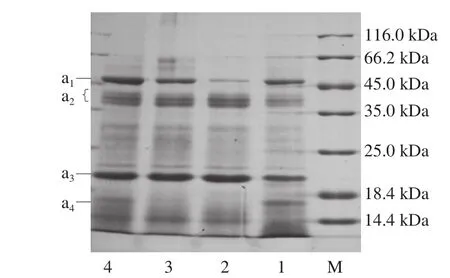
图2 澳洲坚果蛋白原料、MSPI、MTPI和MAPI在还原条件下的电泳图Fig. 2 Reducing SDS-PAGE profiles of macadamia nut,MSPI, MTPI, and MAPI
如图2所示,澳洲坚果原料(泳道1)的条带最多,而在泳道2、3、4中a4(14.4~18.4 kDa)条带缺失,这一结果表明,蛋白质的提取过程造成了a4条带的损失或者a4条带不能成功地从澳洲坚果原料中提取出来。
总之,蛋白提取物具有相似的蛋白条带(泳道2、3、4),但条带宽度和强度不同。在澳洲坚果分离蛋白中明显观察到3个主要的亚基条带,即a1(45.0~50.0 kDa),a2(35.0~45.0 kDa),a3(2 3 k D a)。M S P I(泳道2)中亚基条带a1(45.0~50.0 kDa)的强度明显比MTPI(泳道3)和MAPI(泳道4)浅,这可能是因为不同提取条件下得到的不同条带的蛋白质浓度不同,可能与分离蛋白的功能特性的差异性有密切关系。
2.4 氨基酸分析结果
MAPI、MTPI和MSPI的氨基酸组成见表2。MSPI的总氨基酸含量(92.78%)高于MTPI (87.07%)和MAPI(83.15%)。此外,在MAPI、MTPI和MSPI中,含量最丰富的是谷氨酸(15.70%~19.74%)和精氨酸(13.29%~14.16%)(表2),这与苦瓜籽分离蛋白的结果相似[33]。对于必需氨基酸,MTPI的总必需氨基酸含量(38.79%)高于MAPI(37.21%)和MSPI(35.43%)。3 种分离蛋白的氨基酸组成相似,但氨基酸含量不同。MSPI的苯丙氨酸和赖氨酸含量低于MAPI和MTPI,但其谷氨酸和甘氨酸含量相对较高。蛋白质氨基酸含量的不同可能使MTPI、MAPI和MSPI的功能特性存在差异。

表2 澳洲坚果分离蛋白MAPI、MTPI和MSPI的氨基酸含量组成Table 2 Amino acid compositions of MAPI, MTPI and MSPI%
2.5 表面疏水性与内源荧光发射光谱测定
3 种提取方法得到的澳洲坚果分离蛋白的H0值见表1。MSPI的H0值(730.86)高于MTPI(409.06)和MAPI(292.31),这与Karaca等[14]的研究结果类似,其研究表明盐提取法得到的亚麻籽分离蛋白的H0值高于等电沉淀法,然而,油菜籽分离蛋白的结果却相反。澳洲坚果分离蛋白的H0值高于油菜籽分离蛋白、亚麻籽分离蛋白[14]、鹰嘴豆分离蛋白、蚕豆分离蛋白、扁豆分离蛋白和豌豆分离蛋白(55.2~84.8)[34]。

图3 澳洲坚果分离蛋白内源荧光发射光谱Fig. 3 Intrinsic emission fl uorescence spectra of macadamia protein isolates
从图3可以看出,荧光发射峰的波长没有随提取方法的不同而发生移动,但MSPI的荧光强度明显高于MAPI和MTPI,且MAPI和MTPI的荧光强度相近。这一结果与H0值一致(表1)。在本研究中,与MTPI和MAPI相比,MSPI较高的H0值和荧光强度可以通过其相对较高的EAI和较低的溶解度来解释。
2.6 粒度分布和扫描电子显微镜分析
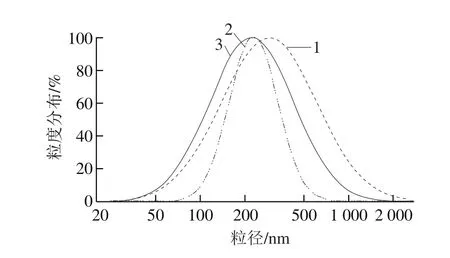
图4 澳洲坚果分离蛋白的平均粒径Fig. 4 Mean particle size distribution of macadamia protein isolates
从图4可以看出,MTPI(曲线2)的粒度分布更集中且分布宽度更窄。MTPI的平均粒径为245.3 nm,粒径范围为50 nm~1 μm。MSPI(曲线3)的平均粒径为273.7 nm。MAPI(曲线1)的分布宽度最宽,为30 nm~2 μm,其平均粒径为381.4 nm。

图5 澳洲坚果分离蛋白MAPI、MTPI、MSPI的扫描电子显微镜图(×16 000)Fig. 5 SEM profiles of MAPI, MTPI and MSPI ( × 16 000)
MAPI(图5A)呈均匀雪花状颗粒,而MTPI(图5B)表现为较大的不均匀块状颗粒。很明显,MSPI(图5C)的特性差异显著,表现为含有不同大小的球状结构的不均匀颗粒。Siwaporn等[9]已经研究了澳洲坚果脱脂粉的微观形貌,结果表明蛋白质和淀粉颗粒嵌入在澳洲坚果脱脂粉内核组织中,且淀粉颗粒呈椭圆形,直径约10 μm。在图5中,最大球状结构直径小于5 μm,这表明MSPI含有球状蛋白。同时,由图4和图5可以看出,MTPI的颗粒尺寸小于MSPI和MAPI。根据Bouaouina等[35]的研究,粒径不同会影响蛋白质的功能特性。此外,三者的微观形貌与内源荧光相一致,可能MSPI更多的球状结构以及不均匀颗粒使色氨酸更多暴露在环境中。
3 结 论
本研究主要集中在澳洲坚果蛋白的功能特性和构象之间的关系研究。氯化钠提取得到的MSPI具有与碱提取得到的MAPI和Tris-HCl提取得到的MTPI不同的功能特性。澳洲坚果分离蛋白在酸性pH值范围(pH 2.0~3.5)和在碱性pH值范围(pH 11)内都具有较高的溶解度(>80%),而在pH 5.0~9.5其溶解度低于30%。与MAPI和MTPI相比,MSPI的溶解度在酸性PH值范围内最高,而在碱性pH值范围内最低。此外,MSPI的EAI((246.88±34.23)m2/g)高于MAPI和MTPI。MAPI、MTPI和MSPI的蛋白含量分别为88.9%、80.3%和86.1%。澳洲坚果分离蛋白亚基的分子质量主要在14.4~50.0 kDa之间。SDS-PAGE和氨基酸分析结果表明3 种分离蛋白具有相似的蛋白条带和氨基酸组成,但它们的条带强度和氨基酸数量不同。此外,与MAPI和MTPI相比,MSPI具有较高的表面疏水性和荧光强度以及较小的粒度。扫描电子显微镜结果表明,MSPI比MAPI和MTPI具有更多的由不同大小的球状结构组成的不均匀颗粒。3 种提取方法引起的蛋白质构象的差异可能会造成它们功能特性的不同。

