BML-111下调c-Met抑制Hela细胞迁移和侵袭的研究①
崔 瑜 樊秦娥 李 晶 校林姣 李春义
(十堰市太和医院(湖北医药学院附属医院),十堰442000)
宫颈癌作为一种常见的恶性肿瘤,在早期并没有任何症状和体征,直到中晚期,患者可因阴道接触性出血等症状就诊,从而严重影响患者的身心健康[1]。人乳头状瘤病毒(Human papillomavirus,HPV)会诱发慢性炎症,最终造成宫颈上皮增殖过量,这就会引起宫颈癌,不过患有该疾病的患者不一定都会变成浸润癌[2,3]。c-Met(cellular-mesenchy-mal to epithelial transition factor)是一种编码肝细胞生长因子受体(Hepatocyte growth factor receptor,HGFR)的原癌基因,在多种恶性肿瘤中高表达并促进肿瘤的侵袭和转移,c-Met的编码产物刺激细胞入侵、增殖、组织血管生成及防止细胞凋亡[4-6]。现代研究表明炎症与趋化因子能提高细胞生长的效率,限制突变细胞的凋亡,对恶性肿瘤的蔓延起到促进作用,因此通过抑制炎症可能为将来治疗宫颈癌提供新的方法[7]。脂氧素(Lipoxins,LXs)是很早以前就被发现的一种内源性抗炎物质, 其中BML-111(Lipoxygenin analogues)为脂氧素的一种,具有性质稳定的特点,可通过抑制NF-κB信号通路途径而发挥对细胞增殖调控的作用,但是对细胞迁移与侵袭的影响还无相关报道[8,9]。因此,本文研究了BML-111下调c-Met抑制Hela细胞迁移和侵袭的影响,现报道如下。
1 材料与方法
1.1研究材料 人宫颈癌Hela 细胞株购自上海中科院细胞典藏馆,胎牛血清为浙江天杭生物科技有限公司产品,DMEM高糖培养基为美国Hyclone公司制造的产品,鼠抗β-Actin为美国Santa Cruz公司产品,荧光二抗(羊抗兔)为武汉博士德公司产品,c-Met 为Genscript公司产品。
1.2方法
1.2.1细胞培养及转染 用含血清浓度15%的高糖培养基DMEM培养 Hela 细胞,细胞放入 37°C、 5%CO2培养箱内培养,当细胞生长至贴壁达80%以上时进行传代1∶3 操作。在转染中,取对数生长期的细胞,用0.25%胰酶消化、传代。将Hela细胞分为3组:空白组、BML-111组、BML-111+Boc-2(c-Met 特异性阻断剂)组。转染前1 d将Hela细胞接种于4孔板中,细胞融合达到50.0%左右进行转染,按脂质体2000TM说明书的步骤进行转染。
1.2.2MTT实验 细胞经胰酶消化后,按每孔104个细胞的量将细胞悬液接种到 96 孔板中,每孔100 μl。培养24 h加入100 μg/L的BML-111、100 μg/L 的BML-111和100 μg/L的Boc-2,一组复孔数量为3个,对照组是没有血清的培养基。培养时间为 24 h,之后将5 μg/L 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)添加到各组当中,再培养4 h,通过酶联免疫检测仪对所有孔的光密度值进行测量,算出细胞存活率。细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。
1.2.3细胞侵袭与转移实验 采用基底胶检测细胞侵袭能力,采用转移小室检测细胞转移能力,溶解基底胶(1∶9 稀释),侵袭与转移小室上层每孔加入50 μl 胶。细胞转染48 h后进行消化,取5×104个细胞进行离心,去上清,将200 μl无血清培养基重悬细胞,在上层小室内添加侵袭与转移小室。下层小室加入完全培养液,培养24 h,进行固定染色。在转移检测中,转移小室不铺基底胶,其余步骤参照基底胶检检测。
1.2.4Western blot 实验 采用Western blot 免疫印迹法检测 NF-κB、c-Met、P53的蛋白水平。细胞刺激完毕后,经裂解液裂解提取全细胞蛋白,计算上样量,保持各组上样蛋白质量的一致。经SDS-PAGE胶分离后,转移至硝酸纤维素膜上,选择 50 g/L脱脂奶粉缓冲封闭液封闭1 h,再将上文提到的蛋白的一抗4℃孵育过夜,洗膜后加入二抗,37℃孵育1 h,洗膜后用增强化学发光试剂洗片曝光。以目的蛋白与β-actin的相对比值代表目的蛋白的表达水平。
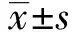
2 结果
2.1细胞存活率对比 BML-111组的细胞存活率(0.32±0.11)显著低于空白组(0.86±0.23,P<0.05),而BML-111+Boc-2组的细胞存活率(0.45±0.22)高于BML-111组(P<0.05)。
2.2Hela细胞迁移与侵袭能力对比 Hela细胞转染48 h 后,BML-111的加入能抑制Hela细胞的迁移与侵袭能力(P<0.05),而Boc-2的加入也能抵抗BML-111的抑制作用(P<0.05),见表1。
2.3NF-κB、c-Met、P53表达对比 我们采用Western blot 技术检测各组间蛋白表达的差异,BML-111的加入能促进P53的表达,抑制NF-κB、c-Met 的表达(P<0.05);而加入Boc-2处理后, NF-κB、c-Met、P53表达较BML-111组对比也有明显差异(P<0.05),见图1。



GroupsMigration abilityInvasive abilityBlank group6.23±1.487.81±1.30BML-111 group1.89±1.111)2)2.11±1.741)2)BML-111+Boc-2 group2.81±1.411)3.81±1.611)
Note:Compared with blank group,1)P<0.05;compared with BML-111+Boc-2 group,2)P<0.05.

图1 三组 Hela 细胞的NF-κB、c-Met、P53蛋白表达量
3 讨论
宫颈癌是女性最常见的妇科肿瘤,占女性肿瘤发病率的前3位之列。目前宫颈癌的治疗主要是采用手术和放化疗综合治疗的方法,但是很难降低患者的预后5年死亡率,为此如何改进治疗方法具有重要意义[10]。当前慢性炎症与肿瘤密切的相关性得到了临床关注,机体受到慢性炎症的刺激后,肿瘤易感性会提高,长时间通过抗炎药治疗,部分肿瘤的发病几率会减小[11]。从机制上分析,感染造成的慢性炎症会导致宫颈上皮和宫颈管内膜的微小溃疡,DNA受损的自由基就会出现,对细胞分化与增殖起到诱导作用,诱发肿瘤的形成[12]。
脂氧素是第一个被发现的内源性抗炎物质,脂氧素在许多感染性疾病中发挥重要的调节作用,可减轻炎性损伤,降低死亡率[13]。基础研究表明脂氧素能够抑制人脐静脉内皮细的血管生成[14]。以往因脂氧素的半衰期较短、容易降解等特点,当前在临床上应用比较多见的为脂氧素类似物BML-111,其能使荷瘤小鼠肿瘤组织中的巨噬细胞和白细胞的浸润受到限制,肝癌发病速度会减缓[15]。还有研究发现脂氧素 A4能通过抑制 G0/G1 期巨噬细胞来抑制 LPS 诱导的细胞增殖,其抑制作用可能依赖于 NF-κB 信号转导通路[16]。本研究表明BML-111添加后,会对Hela细胞的增殖、迁移和侵袭水平产生显著的限制效果(P<0.05),而Boc-2的加入有利于抵抗BML-111的抑制作用(P<0.05),也说明BML-111具有抑癌作用。 脂氧素是花生四烯酸在脂加氧酶的作用下,合成于机体内部的产物,在炎症发病阶段,它利用跨细胞的方式出现[17]。在静息环境中,NF-κB和κB抑制蛋白(IκB)在细胞浆内结合,细胞遭遇炎症、缺氧等刺激之后,IκB磷酸化降解,NF-κB和它的分离、转位机制就会发生,并在细胞核内被激活,然后使它下游各种肿瘤基因的表达水平被提升,如P53[18]。癌细胞可通过受体依赖和非依赖机制触发异常的c-Met信号,c-Met受体编码基因c-Met是一个新的不同于已知癌基因RAS家族的转化基因,c-Met 在上皮起源的细胞内正常表达,但是在乳腺癌、胰腺癌、甲状腺癌、肾细胞癌、卵巢癌等癌组织中过度表达[19]。c-Met的过度表达促使宫颈组织发生上皮内瘤变,能诱发宫颈癌的发生;并且c-Met可激发肿瘤细胞间相互作用、基质黏附、细胞迁移、侵袭和血管生成[20,21]。本研究显示BML-111的加入能促进P53的表达,抑制NF-κB、c-Met的表达(P<0.05);而加入Boc-2处理后, NF-κB、c-Met、P53表达较BML-111组也有明显差异(P<0.05),显示出脂氧素受体激动剂BML-111可以负调节c-Met诱导的反应,降低c-Met的表达,能抑制细胞迁移与侵袭。
总之,BML-111可以对Hela细胞迁移、增殖与侵袭进行有效抑制,其机制可能是通过下调NF-κB、c-Met的表达来实现的。