多重微球流式荧光免疫技术检测抗核抗体谱的评价与临床应用①
尚晓莹 于 腾 孙桂荣 姚 远 张丽君 贺侠琴 刘明军
(青岛大学附属医院检验科,青岛266003)
抗核抗体(Antinuclear antibodies,ANA)的检测对自身免疫病(Autoimmune disease,AID)的诊断、病情评估与治疗监测等具有重要的临床价值。目前ANA的检测方法主要为间接免疫荧光法(Indirect immunofluorescence,IIF);抗核抗体谱的检测方法主要为免疫印迹法(Immunoblot,IB)和ELISA法,均有自动化程度低、仅为定性和半定量检测等局限性。一些自身抗体(如抗dsDNA抗体、抗核小体抗体等)浓度的变化可以反映病情变化或药物疗效情况,而对这些自身抗体浓度变化的监测需要采用定量检测[1-3]。多重微球流式荧光免疫技术(Multiplex bead-based flow fluorescent immunoassay, MBFFI,简称:流式荧光免疫法)是一种以荧光编码微球为核心,集流式细胞、激光分析、高速数字信号处理等多种技术于一体的多指标并行分析技术平台,可一次同时准确定量检测100种不同的生物分子;具有高通量、高灵敏度、高自动化、稳定性好等优点[4]。本研究是通过流式荧光免疫法检测自身免疫病的抗核抗体谱,并与免疫印迹技术、IIF等传统检测方法相比较,对流式荧光免疫法检测抗核抗体谱的结果进行分析和评价。
1 材料与方法
1.1材料
1.1.1标本来源 2017年11月至2018年3月在青岛大学附属医院就诊并临床确诊的自身免疫病患者的血清标本共333例,同时选取排除自身免疫病的其他疾病患者血清44例(其他疾病组)和健康体检者血清59例(对照组)。
1.1.2材料 流式荧光免疫法所用试剂及TESMI F3999全自动加样仪由上海透景生命科技有限公司提供,Luminex®200TM流式点阵仪为美国Luminex公司生产。免疫印迹法试剂及EUROBlotMasterⅡ免疫印迹仪购自德国欧蒙公司。间接免疫荧光法所用抗原基质片(靶抗原为Hep-2细胞与猴肝组织)及试剂购自德国欧蒙公司。
1.2方法
1.2.1标本采集 受检者空腹采静脉血,离心分离血清,于当天以免疫印迹法检测抗核抗体谱及IIF法检测ANA,另分装一份-36℃冰箱保存,流式荧光免疫法检测前复融至室温。
1.2.2抗核抗体谱检测 抗核抗体谱包括的项目有:抗线粒体抗体M2型(AMA-M2),抗着丝粒抗体(anti-Centromere),抗组蛋白抗体(anti-Histone),抗细胞浆组酰-tRNA合成酶抗体(anti-Jo-1),抗核小体抗体(anti-nucleosome,anti-Nucl),抗多肽复合体抗体(anti-PM-Scl),抗核糖体P蛋白抗体(anti-ribosomal P,anti-Rib-P),抗Robert抗原52抗体(anti-Ro52),抗干燥综合征A抗体(anti-SSA),抗干燥综合征B抗体(anti-SSB),抗DNA拓扑异构酶Ⅰ抗体(anti-Scl-70),抗双链DNA抗体(anti-dsDNA),抗核糖核蛋白抗体(anti-RNP),抗Smith抗体(anti-Sm)。流式荧光免疫法检测步骤:血清加载在TESMI F3999全自动加样仪后进行样本处理,后进入Luminex®200TM流式点阵仪检测和数据处理。dsDNA的Cut-off值为18 U/ml,其余指标的Cut-off值为1 AI(AI=抗体指数)。免疫印迹法检测步骤:将膜条放入免疫印迹仪的温育槽中,经过5 min样本缓冲液温育后,加入1∶100稀释的血清,室温温育30 min后清洗,再加入酶结合物,温育30 min后清洗,加入底物液,温育10 min后清洗,风干后放置于扫描仪中,EUROLineScan软件判读阴阳性结果。
1.2.3ANA检测 采用间接免疫荧光法。血清1∶100 稀释,滴加25 μl于抗原基质片上,温育30 min后清洗,再滴加25 μl FITC标记的荧光二抗于抗原基质片上,温育30 min后清洗,封片,荧光显微镜下判读阴阳性结果。
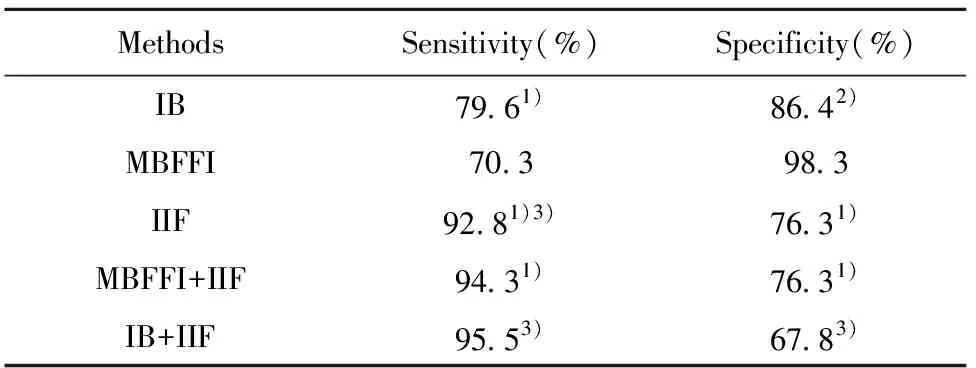
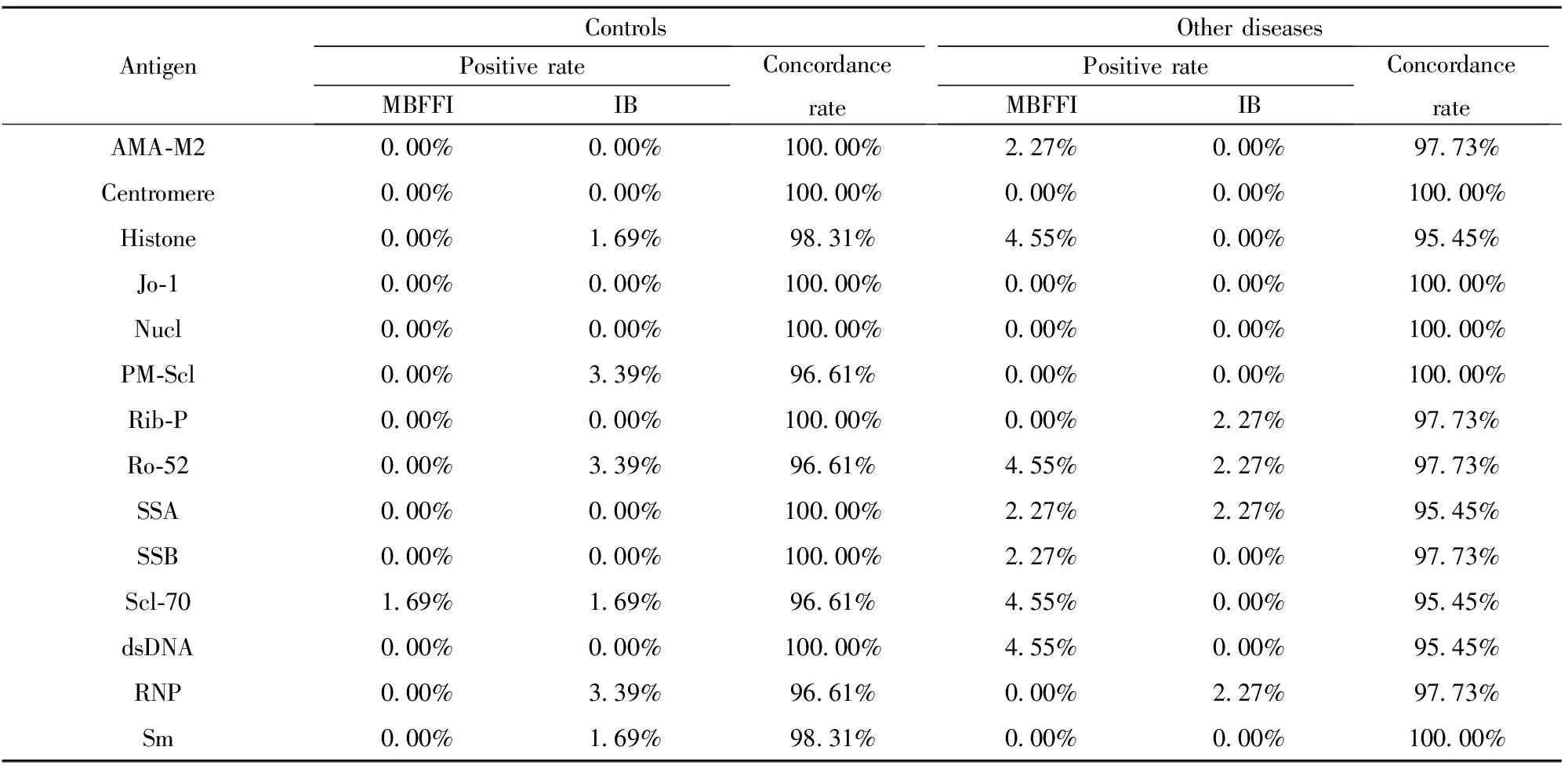
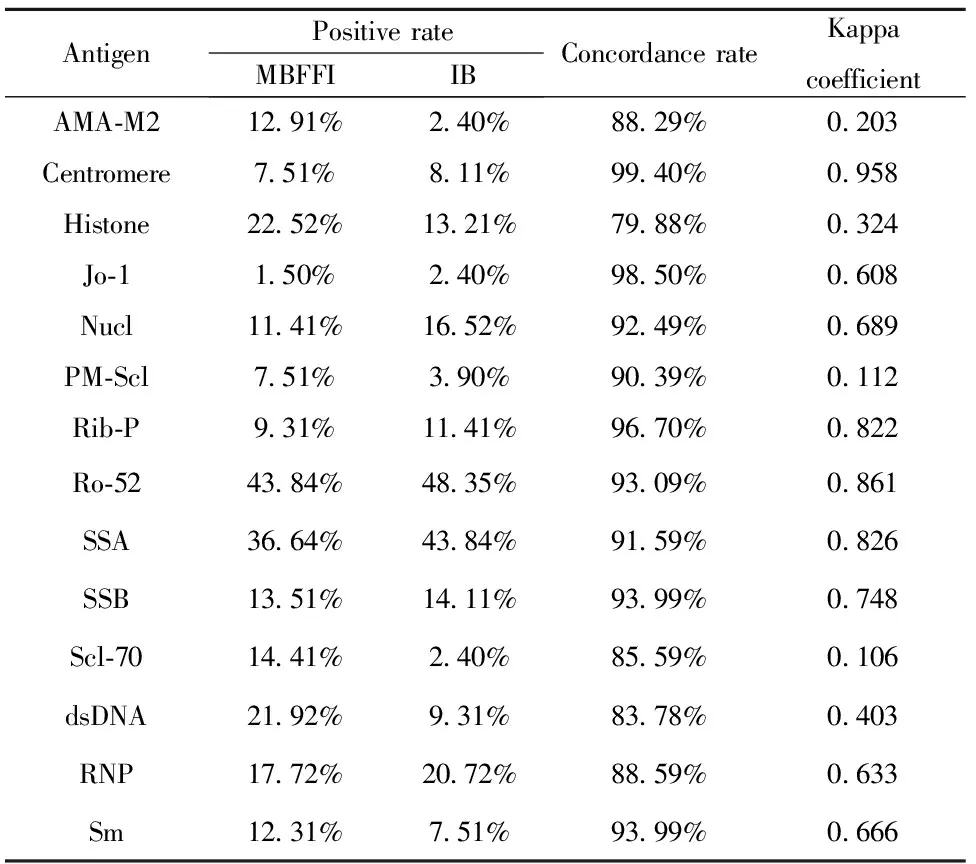
1.3统计学处理 采用SPSS24.0统计学软件进行统计学分析。两种检测技术结果的一致性行Kappa检验,Kappa值≤0.4表明一致性差,0.4 2.1流式荧光免疫法与免疫印迹法检测所有标本的总体一致性比较 以MBFFI或IB法检测抗核抗体谱的各指标中有一项及以上为阳性者,判为此标本的抗核抗体检测阳性;各指标均为阴性,判为此标本的抗核抗体检测阴性,并由此计算MBFFI或IB法检测ANA的灵敏度、特异度[5-7]。用两种方法对总共436例标本进行检测,两种方法的一致率为83.26%,Kappa值=0.655,结果见表1。 2.2流式荧光免疫法与免疫印迹法检测各组各项目的一致性比较 病例组中各项目一致率在79.88%至99.40%之间,Kappa值在0.106至0.958之间,其中抗Centromere一致性最好(Kappa值=0.958),抗Scl-70一致性最差(Kappa值=0.106)。对照组中各项目一致率在96.61%至100.00%之间,其他疾病组中各项目一致率在95.45%至100.00%之间。结果见表2、3。 2.3三种方法诊断自身免疫病的灵敏度、特异度比较 间接免疫荧光法的灵敏度最高,免疫印迹法、间接免疫荧光法分别与流式荧光免疫法比较,灵敏度的差异有统计学意义(P<0.01,P<0.01)。流式荧光免疫法的特异度最高,免疫印迹法、间接免疫荧光法分别与流式荧光免疫法比较,特异度的差异有统计学意义(P<0.05,P<0.01)。流式荧光免疫法与间接免疫荧光法联合检测的灵敏度比流式荧光免疫法单独检测高,差异有统计学意义(P<0.01)。免疫印迹法与间接免疫荧光法联合检测的灵敏度比免疫印迹法单独检测高,差异有统计学意义(P<0.01),结果见表4。流式荧光免疫法、免疫印迹法、流式荧光免疫法与间接免疫荧光法联合检测及免疫印迹法与间接免疫荧光法联合检测的约登指数分别为0.686、0.660、0.706及0.633。 表1所有标本流式荧光免疫法与免疫印迹法检测结果(n) Tab.1ResultsforallsamplesbyMBFFIandimmunoblot(n) IBPositiveNegativeTotalMBFFIPositive22319242Negative54140194Total277159436 表2病例组流式荧光免疫法与免疫印迹法检测各项目比较 Tab.2ComparisonofresultsforeachitembyMBFFIandimmunoblotinAIDpatients AntigenPositive rateMBFFIIBConcordance rateKappacoefficientAMA-M212.91%2.40%88.29%0.203Centromere7.51%8.11%99.40%0.958Histone22.52%13.21%79.88%0.324Jo-11.50%2.40%98.50%0.608Nucl11.41%16.52%92.49%0.689PM-Scl7.51%3.90%90.39%0.112Rib-P9.31%11.41%96.70%0.822Ro-5243.84%48.35%93.09%0.861SSA36.64%43.84%91.59%0.826SSB13.51%14.11%93.99%0.748Scl-7014.41%2.40%85.59%0.106dsDNA21.92%9.31%83.78%0.403RNP17.72%20.72%88.59%0.633Sm12.31%7.51%93.99%0.666 抗核抗体检测对AID的诊断、病情评估和疗效监测具有重要价值,多种抗核抗体检测已列入AID的诊断标准或指南中[8-11],如抗dsDNA抗体、抗Sm抗体已列入SLE的诊断标准[8];抗SSA、SSB抗体已列入干燥综合征的诊断标准[9]。目前抗核抗体及抗核抗体谱的检测方法:IIF、免疫印迹法和ELISA,均有一定的局限性。IIF因为对核型和滴度的鉴定有主观性,使得各实验室之间的结果很难取得一致性,且自动化程度低,仅为定性检测。免疫印迹法及ELISA主要用于特异性抗体的鉴定,但均为定性或半定量检测且自动化程度不高。流式荧光免疫法可弥补上述方法的不足,且可定量检测特异性自身抗体,从而可评估某种特异性自身抗体对AID病情变化、疗效监测的价值。本研究中,流式荧光免疫法与免疫印迹法总体一致性一般。病例组中大部分项目两种检测方法的一致性较高(14项中9项的Kappa值在0.6以上,5项在0.7以上)。一致性最好的为抗Centromere,一致性最差的为抗Scl-70。抗Scl-70被认为是系统性硬化病的标记性抗体[12]。本研究没有具体统计各病种的抗Scl-70阳性率,可能系统性硬化病两种检测方法的阳性率差异大致相同,而其他自身免疫病的两种检测方法的阳性率差异较大导致的一致率差。AMA-M2是原发性胆汁性肝硬化的血清诊断标志抗体,其一致性差的可能原因同抗Scl-70[13]。抗PM-Scl的一致性亦较差,可能两种方法检测此项的阳性率均很低所致。对照组及其他疾病组两种方法一致性很高且阳性率很低。 表4流式荧光免疫法、免疫印迹法及间接免疫荧光法灵敏度、特异度比较 Tab.4ComparisonofsensitivityandspecificitybetweenMBFFI,IBandIIF MethodsSensitivity(%)Specificity(%)IB79.61)86.42)MBFFI70.398.3IIF92.81)3)76.31)MBFFI+IIF94.31)76.31)IB+IIF95.53)67.83) Note:Compared with MBFFI,1)P<0.01,2)P<0.05;compared with IB,3)P<0.01. 表3对照组及其他疾病组流式荧光免疫法与免疫印迹法检测各项目比较 Tab.3ComparisonofresultsforeachitembyMBFFIandimmunoblotincontrolsandotherdiseases AntigenControlsPositive rateMBFFIIBConcordancerateOther diseasesPositive rateMBFFIIBConcordancerateAMA-M20.00%0.00%100.00%2.27%0.00%97.73%Centromere0.00%0.00%100.00%0.00%0.00%100.00%Histone0.00%1.69%98.31%4.55%0.00%95.45%Jo-10.00%0.00%100.00%0.00%0.00%100.00%Nucl0.00%0.00%100.00%0.00%0.00%100.00%PM-Scl0.00%3.39%96.61%0.00%0.00%100.00%Rib-P0.00%0.00%100.00%0.00%2.27%97.73%Ro-520.00%3.39%96.61%4.55%2.27%97.73%SSA0.00%0.00%100.00%2.27%2.27%95.45%SSB0.00%0.00%100.00%2.27%0.00%97.73%Scl-701.69%1.69%96.61%4.55%0.00%95.45%dsDNA0.00%0.00%100.00%4.55%0.00%95.45%RNP0.00%3.39%96.61%0.00%2.27%97.73%Sm0.00%1.69%98.31%0.00%0.00%100.00% IIF检测ANA的荧光核型具有一定的提示作用,但一种自身抗体可出现不同的荧光核型,不同的自身抗体也可出现相同的荧光核型,不能仅从荧光核型来推断特异性自身抗体种类[3]。免疫印迹法所用的抗原必须是纯化的抗原,才能保证被测定抗体的准确性和特异性,但目前许多自身抗体的确切抗原不明确且不易被纯化,仅有少部分抗原有纯化的产品能用于特异性检测[14]。专家共识建议:临床应用中可先用IIF法检测ANA,若为阳性,需进一步检测特异性自身抗体[3]。本研究显示,流式荧光免疫法的诊断灵敏度虽然低于免疫印迹法与IIF法,但特异度高于后两者,而IIF法检测ANA的灵敏度高于其余两方法。本研究中流式荧光免疫法与IIF法不一致的结果中5.88%为流式荧光免疫法阳性且IIF法阴性,与Nifli等[7]的研究不一致,其为77.04%。原因是本研究所用流式荧光免疫法的试剂不再添加Hep-2抗原成分,Hep-2为IIF靶抗原,从而降低了灵敏度但提高了特异度。流式荧光免疫法与IIF法联合检测的灵敏度比流式荧光免疫法单独检测高。这恰好提示:IIF检测ANA作为初筛试验目前仍是最好的,而流式荧光免疫法可替代免疫印迹法检测ANA作为确认试验。 综上所述,流式荧光免疫法检测抗核抗体谱与传统的免疫印迹法相比,一致性尚可,特异度更高,与IIF组合应用更符合临床需求。且流式荧光免疫法自动化程度更高,检测速度更快,对某些特异性自身抗体可定量检测从而监测病情变化。流式荧光免疫法可替代免疫印迹法成为新一代的特异性自身抗体确认试验检测方法。2 结果

3 讨论