介孔二氧化硅在肿瘤治疗领域的研究进展
姚琳通 刘娅婷 刘雅静 陈真真
(郑州大学生命科学学院,郑州 450001)
纳米技术应用于肿瘤在很大程度上归功于其药物递送、诊断和成像、开发合成疫苗以及一些纳米材料本身的治疗性质[1-5]。随着癌症纳米医学领域的巨大进步,纳米其中的一些功能,如增强循环和降低毒性,已经在使用,其他一些功能在临床开发中同样表现出巨大的潜力,预期在不久的将来会有明确的结果。目前研究的大多数纳米载体(如脂质体[6-8]、聚合物胶束[9-11]和树枝状聚合物[12-14]等)已经在癌症治疗领域表现出很好的应用前景。介孔二氧化硅纳米粒子(Mesoporaus silica nanoparticles,MSNs)通过其外表面的功能化修饰,防止药物的过早释放,响应于外部或内部刺激(如pH、离子、酶、温度、光和磁场)确保在所需位点释放较高药物浓度,这使其成为一个强大的技术。
1 介孔二氧化硅
自20世纪90年代初发现介孔二氧化硅,近20年来,介孔二氧化硅材料的发展爆炸式增长,最广为人知的是硅基纳米材料。MSNs是基于改进Stöber合成法合成的,如使用正硅酸乙酯(Tetraethyl orthosilicate,TEOS)作为硅胶缩合前体,不同的添加剂作为模板,如十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide,CTAB),聚合物,胶束形成剂或其它掺杂剂[15]。简而言之,在碱性条件下将表面活性剂在水与醇的混合物中搅拌,并在搅拌条件下加入TEOS或其它硅酸盐。二氧化硅源、模板剂和搅拌条件的浓度和组成决定了粒径、孔径和形状。当表面活性剂浓度高于临界胶束浓度时,CTAB自聚集成胶束,二氧化硅前体在表面凝聚。二氧化硅结构形成在胶束表面周围。然后,必须将表面活性剂完全除去,以获得生物相容性介孔二氧化硅纳米粒子以用于进一步修饰[16]。另一种方法是由Zhao等[17]首先介绍的,他们使用三嵌段共聚物作为孔径高达30 nm的有序六角形介孔二氧化硅结构的模板。MSNs的共同孔径范围在2-5 nm之间,但是通过加入溶胀剂如三甲苯,可以产生23 nm的孔径[18]。另外,Wu等[19]研究了中空结构的MSNs作为药物载体,采用了基于稳定性差异的选择性键断裂方法。简而言之,该方法依赖于Si-C键弱于Si-O键并且可以通过水热处理而降解的事实。通过应用不同的温度,孔径逐渐增加到24 nm。粒径也可以实现更大的变化,取决于表面改性。虽然一些二氧化硅纳米粒子的直径为100-120 nm,其他纳米粒子大于200 nm,但孔径相似(分别为2.5 nm或3.0 nm)[20-22]。不同类型的介孔二氧化硅,包括MCM-41/48,SBA-15,TUD-1及其衍生物,在催化、原子筛分、光学、分离和吸附等多个领域得到了广泛的应用[23-26]。MSNs最有潜力的应用之一是在癌症治疗中的药物递送[27-28],作为一个成功的药物传输系统(Drug delivery system,DDS),必须满足一些先决条件,包括良好的生物相容性和无毒性;高载药量;在到达目标位点之前保护负载物并防止过早泄漏的能力;控制药物释放;细胞和组织靶向[29]。设计不同的基于MSNs的药物载体用于癌症细胞和组织的控制药物递送已经是近年来特别活跃的研究领域。
2 介孔二氧化硅的应用研究
作为成功的药物输送系统(DDS),Seminal和同事们为MSNs进行了有效的DDS的精髓工作[30]。Lane等[31]提出了“阀门”的概念,用阀门覆盖介孔,客体分子被封闭在MSNs的介孔里。通过各种技术,包括静电结合,物理吸附或共价偶联,官能化的MSNs可以被用来靶向特定的细胞或组织,通过将肽,适体,抗体或基因修饰到它们的表面上,增强包封药物的治疗效果并减少毒副作用(图1)。
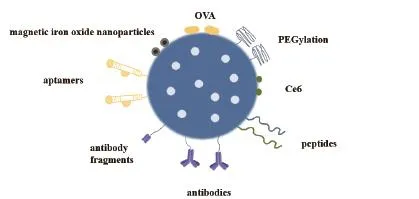
图1 不同分子修饰介孔二氧化硅用于纳米递送系统
2.1 多肽修饰介孔二氧化硅纳米粒子
2.1.1 靶向肽 精氨酸-甘氨酸-天冬氨酸(Arginine-glycine-asparticacid,RGD)肽,一种特别有效的靶向肽,可以被在各种人癌细胞中过表达的αvβ3整联蛋白受体识别[32-34]。因此,包含RGD序列的多肽已经被认为是纳米载体的理想靶向部分,不仅是MSNs,而且还包括脂质体,胶束,其他无机或有机纳米粒子。环状RGD可以比线性RGD更强地结合受体,因为线性RGD在溶液中呈现大量的构象,这会导致结合强度的下降[35]。许多研究小组已经证明将RGD多肽引入MSNs可以实现特定的内在化,通过受体的内吞作用增加纳米颗粒的摄取量,导致治疗效果增强。例如,加载光敏剂(PdTPP)用于光动力疗法[36],抗肿瘤药物用于化疗[37-38]。核定位信号(Nuclear localization signal,NLS)是通过核孔复合物(Nuclear pore complex,NPC)将药物运输到细胞核中的策略[39]。作为最常见的NLS多肽之一,TAT多肽通过结合受体,随后靶向NPC,最终进入细胞核。Pan和他的同事们构建了核定向MSNs,用TAT多肽修饰并负载DOX作为抗癌药物(DOX@ MSNs-TAT)[40],并且发现直径为50 nm以下的DOX @ MSNs-TAT可以进入HeLa细胞核并将药物输送到核质中,引发更高的细胞毒性。随后的研究表明,该DDS可有效克服多药耐药,增加多药耐药MCF-7 /ADR 细胞凋亡[41]。
2.1.2 刺激响应多肽 生物反应性是多肽最具吸引力的特性,已经引起了全球科学家的广泛关注。具有特定序列的多肽可以被特异性的酶识别切割。这种高选择性将成为设计酶响应性MSNs的关键所在,可以用作诊断剂、显像剂和刺激响应性药物递送系统等。2010年,Thornton等[42]完成了双酶响应多肽修饰二氧化硅纳米颗粒的开创性工作。基质金属蛋白酶(Matrix metalloproteinase,MMPs)具有降解细胞外基质的特性,并与肿瘤进展、血管生成或转移相关。MMP响应性肽可被有效地切割,且大部分切割位点是甘氨酸(G)和亮氨酸(L)之间的肽键[43]。因此,通过使用多肽底物作为纳米颗粒与其他功能单元之间的接头分子来设计酶响应性药物递送系统是有前景的策略。pH值在组织和细胞水平上有所不同。例如,由于厌氧(糖酵解)呼吸导致乳酸的积累,肿瘤组织(pH≈6.8)或炎症组织(pH5.4-7.2)的细胞外pH一般低于正常组织(pH7.2-7.4)[44]。胞吞作用后,由于空泡质子ATP酶介导的质子通道,发生快速内体酸化导致内涵体和溶酶体的pH值迅速下降至pH <6.0[45]。令人惊喜的是,科学家们发现低pH插入肽(pHLIP),它对于轻微的pH变化更为敏感[46-48]。Zhao[45]及其同事通过将双重作用pHLIPss(pH敏感性肽和阀门)连接到MSNs表面来设计pH驱动靶向和氧化还原响应性药物递送纳米载体。pHLIPss-MSNs在中性pH下与细胞膜松散连接。当暴露于pH 6.5时,pHLIPss将快速插入膜中,然后通过形成螺旋结构将纳米颗粒转移到细胞质中。由于细胞内高浓度的谷胱甘肽(Glutathione,GSH),pHLIPss中的二硫键将被切割,阻断剂将从MSNs表面离开,导致DOX释放并引发细胞死亡。该系统在药敏细胞(MCF-7细胞)和耐药肿瘤细胞(MCF-7 / ADR细胞)中都是有效的。温度是改变多肽二级结构的另一个因素。用作MSNs的纳米阀的热响应卷曲螺旋多肽就是很好的例子。用半胱氨酸修饰的肽“E”[C(EIAALEK)3]和互补多肽“K-PEG”[(KIAALKE)3-PEG]修饰 MSNs通过形成卷曲螺旋基序封闭介孔,当温度达到80℃时,卷曲螺旋基序松散,负载药物被释放[49]。但是它不适合在体内进一步应用。原因是上述肽的反转温度很高,与疾病组织(40-42℃)和健康组织(37℃)之间的温度差异不匹配[50]。它们作为生物材料在实际应用还有很长的路要走。
2.1.3 多功能嵌合多肽 由于复杂的肿瘤微环境,单功能多肽缺乏实际应用,相反,设计的多功能嵌合肽,整合了几种具有不同生物活性和生物反应性的肽片段,更加灵活有效。基于介孔二氧化硅纳米粒子(MSN)的多功能包膜纳米器件被精心设计用于药物和治疗肽的亚细胞共递送至肿瘤细胞。Luo等[51]以介孔二氧化硅MCM-41纳米粒子加载抗肿瘤药物拓扑替康(Topotecan,TPT)为核心。用含三苯基磷(Triphenylphosphine,TPP)和抗生素肽(KLAKLAK)2的靶向线粒体治疗剂(Tpep)通过二硫键修饰纳米颗粒表面,随后通过静电相互作用包载电荷逆转聚(乙二醇)- 嵌段-2,3-二甲基马来酸酐改性的聚(L-赖氨酸)[(PEG-PLL(DMA)]。在酸性肿瘤微环境下,由于DMA嵌段的降解,可以去除外屏蔽层,并且通过形成阳离子纳米颗粒显著增强了细胞的摄取。胞吞作用后,细胞内的GSH裂解二硫键,药物制剂(Tpep和TPT)可从纳米颗粒中释放,并随后分别诱导肿瘤细胞线粒体和细胞核的特异性损伤,具有显著的协同抗肿瘤作用。Cheng等[52]设计了一个简单而强大的制定高度可控的药物递送系统用于协同癌症治疗。MSNs作为纳米平台封装抗癌药物DOX,通过二硫键结合靶向肿瘤细胞膜穿透肽(TCPP)和线粒体的治疗肽(TPP)密封表面介孔,体外结果表明,这些生物活性多肽修饰的MSNs可以靶向癌细胞,穿透细胞膜并响应细胞质中高浓度的GSH以快速释放负载的抗癌药物DOX和线粒体靶向肽TPP,表现出显著的协同抗癌作用。Xiao等[53]开发了包含非共价官能化MSNs和含有RGD配体的氧化还原响应介孔二氧化硅纳米颗粒(RRMSNs)作为药物纳米载体。将具有硫醇末端基团的烷基链硬脂酸(C18)通过二硫键固定在MSNs的表面上,然后MSNs的十八烷基和AP烷基链之间的疏水相互作用自组装为多肽(AP)C18-DSDSDSDSGGDS。体外药物释放实验表明,在没有谷胱甘肽(GSH)或二硫苏糖醇(Dithiothreitol,DTT)的情况下,抗癌药物(Doxorubicin,DOX)几乎不会被渗漏。随着DTT或GSH的添加,负载的药物由于二硫键的裂解而迅速释放。
2.2 抗体或抗体片段
整个抗体或抗体片段功能化的介孔二氧化硅作为药物递送载体用于肿瘤靶向也是很好的应用前景。例如,西妥昔单抗(靶向EGF受体),曲妥珠单抗(靶向HER2/ neu受体)和贝伐单抗(靶向VEGF受体)或具有相似靶标的相关抗体已经批准用于癌症治疗。Durfee开发了一种名为“原始细胞”的药物纳米载体,该纳米载体以用于载药的MSNs为核心和用于表面改性的门阀和平台的脂质双层组成,负载的上皮生长因子受体(EGFR)抗体在体外和体内都可以有效地靶向白血病细胞[54]。利妥昔单抗是靶向B细胞上的CD20抗原的嵌合单克隆抗体,并且被批准用于B细胞非霍奇金淋巴瘤治疗[55],Zhou等[56]将利妥昔单抗偶联到MSNs,并在体外和体内评估了药物递送载体,在小鼠异种移植淋巴瘤模型中,由利妥昔单抗靶向并负载阿霉素的MSNs可以明显的引起肿瘤体积减小,并且与用游离DOX处理的小鼠相比,小鼠体质保持更好。Chen等[57-58]已经应用靶向肿瘤血管系统的抗CD105抗体(TRC105)于鼠乳腺癌模型中。抗体结合的MSNs的肿瘤摄取明显大于没有靶向性的纳米粒子,但是在注射24 h后在肝脏仍有积聚。该课题组在小鼠脉管系统模型中,使用TRC105抗体片段(Fab)靶向双标记MSNs用于肿瘤的体内正电子发射断层成像(PET)成像/近红外荧光染料(NIRF)成像。急性白血病由白血病干细胞(LSCs)启动和维持,因此开发针对LSCs的创新性治疗方法具有重要意义。Mandal[59]设计琥珀酸酐功能化,抗B220抗体标记,并且加载蒽环霉素柔红霉素的介孔二氧化硅纳米颗粒(MSNs)。在体外,与B220阴性AML LSCs相比,介孔二氧化硅纳米颗粒可以被有效渗入鼠B220阳性AML LSC中,并优先杀死这些细胞。此外,移植前用MSNs短期治疗AML LSCs显著延迟了受体小鼠的白血病发展。这些数据表明,通过使用功能化的和抗原定向的MSN作为抗白血病药物的载体,可以改善靶向AML LSC。
2.3 核酸适体
除了小分子和多肽以外,适体可用于肿瘤细胞靶向。适体是合成的单链DNA或RNA寡核苷酸,表现出对不同靶点的高亲和力和特异性。它们是聚阴离子的,比小肽大,但比抗体小[60]。Babaei[61]及其同事采用了一种与上皮细胞黏附分子(EpCAM)结合的适配体,用于体外和体内靶向肝癌细胞。他们在MSNs中包裹5-氟尿嘧啶,用柠檬酸钠修饰的金纳米粒子作为阀门,将其PEG化并与EpCAM适体结合制备新型纳米颗粒(EpCAM-PEG-AU@Si-5-FU)。与没有靶向性PEG-AU@Si-5-FU纳米颗粒相比,EpCAM-PEG-AU@Si-5-FU纳米颗粒在2D和3D 培养的HepG2细胞中引起更强的细胞活力降低。此外,在体内,该系统作为一个超分子装置进行了测试,并且在罗丹明6G负载的MSNs注射体内成像之后在肿瘤部位观察到大量积累[61]。适体靶向的另一个受体是在癌细胞上表达的核仁素。Tang等[62]开发了一种新型的适体靶向光敏药物释放系统,通过在石墨烯包裹的负载阿霉素(Dox)的介孔二氧化硅纳米粒子表面上非共价组装Cy5.5-AS1411适体缀合物(MSNs-Dox @ GO-Apt)用于光刺激的药物释放以及靶向适体的癌症治疗。然而,在体外,有无靶向的负载阿霉素的MSNs对乳腺癌细胞的细胞活力的影响没有区别。在大多数基于适配子的刺激响应介孔二氧化硅纳米粒子(MSN)系统中,适配体在MSN上通过静电相互作用进行修饰,但是在系统中一定时间后可能存在泄漏,因此稳定性不好。最近研究实现首次通过点击化学反应使MSN的孔径被适体封闭,然后用于开发荧光生物传感器。所提出的生物传感器已成功应用于高选择性血清样品中的凝血酶检测。通过改变所采用的适体,可以应用相同的策略来开发用于不同目标的生物传感器[63]。
2.4 克服多药耐药性
克服多药耐药的各种蛋白质如P-糖蛋白(P-gp/ MDR1),乳腺癌耐药蛋白(BCRP),MDR蛋白1(MRP1)或抗凋亡蛋白在各种癌症类型中高度过表达,使不同种类的药物(如阿霉素、紫杉醇和表阿霉素等)流失,导致其在细胞内浓度降低[64-65]。在这个方面,基于纳米技术的体系已被用来克服通过内体输送药物的MDR,提供了更强的细胞内递送,是作为治疗癌症的有希望的方案[66]。在所研究的各种纳米载体中,MSNs在以多种方式提高药物在MDR细胞中的治疗方面显示出巨大的潜力[67],如调整它们的壳体孔径,引入刺激响应功能,递送多种治疗剂和MDR相关蛋白表达的基因[68-69]。CD44在多药耐药性人乳腺癌细胞上过表达。CD44单克隆抗体通过抑制增殖并调节多药耐药细胞中P-糖蛋白介导的药物效应活性显示出抗癌潜力。Wang等[70]设计负载阿霉素的CD44单克隆抗体功能化介孔二氧化硅纳米粒子增强了对人乳腺癌耐药癌MCF-7细胞毒性并且与CD44抗体相比增强了P-糖蛋白的下调。CD44修饰的介孔二氧化硅纳米粒子提供了有活性的靶点,这促进了耐药细胞对DOX更多的细胞摄取,抗性乳腺癌异种移植物的动物研究表明,CD44工程药物递送系统显著诱导细胞凋亡并抑制肿瘤生长。Jia等[71]设计制备pH响应性的负载抗肿瘤药物紫杉醇(PTX)和逆转多药耐药的汉防己甲素(TET)的多功能介孔二氧化硅纳米粒子(PTX / TETCTAB@ MSN),实现克服MCF-7 / ADR细胞的多药耐药性。细胞摄取的研究结果表明TET可显著增加纳米粒子的细胞内积聚。此外,PTX/TET-CTAB @ MSN比仅递送PTX(PTX-CTAB @ MSN)或游离PTX更有效地抑制肿瘤细胞生长。纳米颗粒负载药物PTX/TET摩尔比为4.4∶1完全逆转了MCF-7/ADR细胞对PTX的耐药性,并且耐药逆转指数为72.3,这种纳米载体可能在多种药物联合递送以克服MDR的临床意义上具有重要的潜力。
2.5 治疗诊断学应用
治疗诊断学已经成为纳米医学领域的一个新领域,它将诊断和治疗策略同时结合在一个系统中。这个独特的平台提供了更具体和个性化的治疗[72]。Yang等[73]在这项工作中,通过自组装将WS2纳米片的表面预吸附氧化铁(IO)纳米颗粒,再涂覆聚乙二醇(PEG)修饰的介孔二氧化硅壳。制备的WS2-IOMS-PEG纳米粒子表现出许多固有物理性质,包括高近红外(NIR)光和X射线吸收,以及强烈的超顺磁性。同时,WS2-IO @ MS-PEG中的介孔二氧化硅壳体可装载化疗药物阿霉素(DOX),其后细胞内释放可由NIR诱导的光热加热引发,用于增强癌细胞杀伤。通过三模式荧光,磁共振(MR)和X射线计算机断层摄影(CT)成像所显示的,在荷瘤小鼠中观察到WS2-IO @ MS-PEG / DOX有效的肿瘤归巢。然后用WS2-IOMS-PEG / DOX进行体内联合的光热和化学疗法,实现了明显的协同疗效,优于各种单疗法。Su等[74]报道了新型多功能MSNs支持的红细胞(RBC)模拟治疗诊断纳米颗粒,具有长时间血液循环,深红色光活化肿瘤成像和药物释放。RBC膜包裹同时加载抗癌药物Dox(39.1%,质量分数)和近红外光敏剂Ce6(21.1%,质量分数)的MSNs,实现高负载能力。红细胞膜包衣防止药物泄漏,大大提高了MSNs的胶体稳定性。在单一系统中综合光动力治疗和化疗显著抑制了4T1乳腺癌细胞的生长,为MSNs的优化和高效的抗癌药物输送提供了新的策略。通过克服耐药性并随后加强治疗,光动力学疗法(PDT)和化学疗法的联合疗法有希望用于癌症治疗。然而,主要的挑战是如何建立一个先进的纳米平台,可以有效地引导到肿瘤部位,然后同时并准确地稳定释放化疗药物和光敏剂。Tang等[75]成功构建了新型 Fe3O4@ mSiO2(DOX)@ HSA(Ce6)纳米平台,可以作为一个有效的具有磁性指导高度特异靶向和保留的协同抗肿瘤纳米平台。阿霉素(DOX)分子被装载到具有高负载能力的介孔二氧化硅中,且介孔通道被聚多巴胺(PDA)涂层阻塞。人血清白蛋白(HSA)缀合到外表面,增加生物相容性和血液循环时间,同时可以用于加载光敏剂Ce6。在酸性条件下持续释放DOX和由红光诱导的PDT对神经胶质瘤细胞发挥协同抑制作用。实验证明,pH响应性Fe3O4@ mSiO2(DOX)@ HSA(Ce6)纳米平台通过磁性靶向被引导到肿瘤区域,并且纳米平台有效地抑制胶质瘤肿瘤生长,这意味着该系统是非常有前途的光动力/化疗组合纳米平台,对癌症治疗具有协同效应。
2.6 免疫治疗
树突状细胞(DC)是最重要的抗原呈递细胞(APC),被认为是免疫的起始者,是癌症免疫治疗有前景的靶向细胞[76]。DC可通过主要组织相容性复合体(MHC)I / II分子的抗原呈递诱导CD4+T辅助淋巴细胞和CD8+细胞毒性T淋巴细胞(CTL)的产生和活化,这已成为许多肽疫苗临床试验的理论基础。目前正在开发基于肿瘤抗原肽的预防性和治疗性疫苗,具有许多优点,包括高纯度,诱导的抗肿瘤免疫应答的安全性和特异性[77-78]。然而,限于特定MHC类型的肽,特别是那些单表位多肽可能不足以诱导强烈的免疫应答,并且其临床应用很少成功。与游离蛋白质或肽的巨胞饮作用相比,包裹在纳米颗粒(NP)中的抗原通过吞噬作用内化并且更有效地在MHC I / II类分子上交叉呈递以提高免疫原性[79]。因此,纳米颗粒疫苗递送系统通过诱导强效的CTL细胞免疫应答显著提高常规疫苗制剂的功效。Kupferschmidt等[80]研究了介孔二氧化硅颗粒的辅助作用及其修饰已存在的过敏性Th2样免疫应答的能力。作者在抗原特异性卵清蛋白(OVA)体系中研究了介孔二氧化硅颗粒(SBA-15)在体内和体外的佐剂效应。评估负载OVA的SBA-15颗粒(SBA-15-OVA)在鼠过敏模型中的免疫应答能力。同单独的OVA相比,SBA-15-OVA显著增强OVA特异性脾脏细胞增殖,与仅注射SBA-15或OVA的小鼠相比,在来自SBA-15-OVA免疫小鼠的离体OVA刺激的脾细胞中观察到显著高表达的IFN-γ。与明矾OVA处理组相比,用SBA-15-OVA处理OVA致敏的小鼠,显著降低了OVA特异性的IgE血清水平和更高的IgG表达。Heidegger等[81]评估了多功能MSN在新鲜分离的原代小鼠的免疫细胞中的生物相容性和功能性。功能化的二氧化硅纳米粒子被迅速和有效地吸收到特定的抗原呈递细胞,如树突状细胞的内体区室。二氧化硅纳米粒子显示出有利的毒性分布,并且在相关浓度下不影响来自脾脏的原代免疫细胞的存活力。通过检测原代细胞的表面标志物的表达和抗炎细胞因子如白细胞介素-6,-12和-1β的释放,证实裸露的MSN仅引起非常低的免疫应答。相反,当用pH响应性聚合物封端的表面官能化的MSN加载免疫活化药物Toll样受体7激动剂R848,可以引起强烈的免疫应答。证明了MSN作为一种有效的药物传递载体,对原始免疫细胞既无毒又不引起炎症反应,满足在生物医学应用中使用这些颗粒的先决条件。
3 展望
20世纪中期以来,介孔二氧化硅已经被应用于药物输送,并且与生物技术的结合获得了丰硕的成果。高载药量和灵活的表面修饰使介孔二氧化硅成为理想的纳米载体。介孔二氧化硅的另一个巨大的优势是其可生物降解性和体内高生物相容性。但是,介孔二氧化硅作为新型生物材料,仍然有很多问题亟待解决:(1)EPR效应[82-84]已经成为纳米递送至实体瘤的基础,但是,即使在相同患者或者肿瘤类型中,EPR随时间在患者和肿瘤类型之间是显著变化的,而目前有关EPR在纳米治疗功效方面的研究还不是很清楚。(2)为了评估体内纳米材料性能(如药代动力学、生物分布、功效和安全性),动物模型的使用是强制性的。然而,没有任何一种模型可以完全复制人类恶性肿瘤的所有方面,并且EPR通常在动物模型中比在癌症患者中更一致。因此,开发模拟人类肿瘤的异质性和解剖组织学的动物模型对于纳米治疗是非常重要的[85]。(3)纳米材料进入生物环境,其表面会很快被不同的生物分子(特别是蛋白质)覆盖形成蛋白质冠,这将会显著降低纳米材料在复杂生物环境中的靶向能力[86-87],并且有关体内纳米材料与蛋白质的相互作用在药代动力学,生物分布和治疗能力方面的研究也不是很清晰[85]。值得关注的是,最近有关中空二氧化锰(H-MnO2)纳米载体[88],非病毒纳米载体[89],刺激响应纳米胶束[90],智能仿生药物递送纳米载体[91-93]都取得了很好的抗肿瘤效果,为纳米载体应用于癌症治疗提供了更多的选择。相信经过多领域科研人员的不断努力,会加速这些纳米系统从实验室应用到临床的进程。

