养殖中华乌塘鳢致病性弧菌的分离鉴定
沈 斌 ,魏 可,殷小龙,杨 潇,卢德政,巩 壮,张建设
(1.国家海洋设施养殖工程技术研究中心,浙江舟山 3 160222;2.浙江省舟山市水产研究所,浙江舟山 316000)
中华乌塘鳢Bostrychus sinensis 隶属于鲈形目Perciformes、塘鳢科Eleotridae、乌塘鳢属Bostrychus,系河口咸淡水暖水性小型鱼类,具有生命力强、生长快、喜穴居等特点[1]。广泛分布于印度洋北部沿岸至太平洋中部的热带、亚热带海区,在中国、日本、菲律宾等国家均有分布,我国主要产于南海、台湾海峡和东海,包括江苏、浙江、福建、广东、广西等省的沿海水域[2]。中华乌塘鳢耐盐度范围0~35,耐温范围为6~35℃,耐pH 范围为6.5~9.0;适宜生长的水环境条件:水温25~30℃,盐度10~25,pH 7.5~8.5[3]。生理学研究表明,中华乌塘鳢耐干露能力强,干露20 h 不死亡[4],非常适合活体运输远销。中华乌塘鳢肉味鲜美,营养丰富,具有加速伤口愈合的功效,是名贵的食用鱼之一,并作为名贵海产滋补鱼类而畅销深圳、港澳等地[1]。自陈兴乾等[5]报道中华乌塘鳢人工育苗成功以来,国内专家学者们在中华乌塘鳢种苗繁育及人工养殖技术方面开展了一系列的研究[6-12]。近年来,广西、广东、福建等沿海地区掀起了一股养殖中华乌塘鳢的热潮,使其成为重要的人工养殖对象[3]。随着养殖面积的不断增加,包括肠炎病、赤皮病、弧菌病、寄生虫病等各种养殖疾病也相继出现[13-14],对中华乌塘鳢养殖业造成较大的经济损失。因此,开展中华乌塘鳢养殖病害方面的研究,对于促进养殖业的可持续健康发展具有重要的意义。
2017年8月,台州某养殖场的中华乌塘鳢出现皮肤溃疡病。本研究从患病中华乌塘鳢体内分离出1株优势菌,通过回归感染、组织病理切片、生理生化及分子生物学鉴定、药敏试验等手段,对患病中华乌塘鳢开展病原学等方面的研究,为该病的诊断和防治提供参考。
1 材料与方法
1.1 材料
1.1.1 患病中华乌塘鳢
2017年8月,从浙江台州某养殖场采集濒死的5 尾患病中华乌塘鳢(体重约45 g,体长约13 cm)。将患病鱼置于冰盒中保存,4 h 内运至实验室。
1.1.2 健康中华乌塘鳢
人工感染所用的健康中华乌塘鳢购自浙江台州三门县某养殖场(体重约50 g,体长约14 cm)。采用尼龙袋充氧、泡沫箱加冰的方式将中华乌塘鳢运输至实验室,经10 mg·L-1高锰酸钾浸泡消毒5 min 处理后,暂养于60 cm×40 cm×60 cm 的玻璃水族箱中,每缸10 尾,海水温度25℃,盐度15,pH 8.5。每天换水1次,投饵(新鲜虾仁)1 次,暂养适应1 周后用于后续实验。
1.2 病原菌分离
取患病中华乌塘鳢,无菌条件下采集溃疡部位肌肉组织以及肝脏、脾脏等器官,用无菌1×PBS(pH7.2~7.4,北京索莱宝科技有限公司)冲洗组织块,剪碎后划线接种于TSA(胰蛋白胨大豆琼脂,青岛海博生物技术有限公司)平板上,28℃恒温培养24 h,挑取优势菌落进行分离纯化,连续纯化培养3 代。将纯化得到的优势菌接种于TSB(胰蛋白胨大豆肉汤,青岛海博生物技术有限公司)液体培养基扩增,28℃180 r·min-1培养10~12 h。按照菌液:甘油=1:1 的比例,将菌液保存于无菌的50%甘油中,置于-80℃超低温冰箱保种,菌株编号TZ-01。
1.3 人工感染实验
将培养12 h 的细菌培养物用无菌1×PBS 制成菌悬液,结合活菌计数法和血球计数板计数法,将菌悬液浓度调整为1×109CFU·mL-1,1×107CFU·mL-1和1×105CFU·mL-1备用。选择无外伤、活动摄食正常的中华乌塘鳢(体重约50 g)作为供试鱼。各实验组每尾鱼胸腔注射0.2 mL 菌悬液,对照组每尾注射0.2 mL 1×PBS,实验期间不投喂饵料。人工感染后连续观察14 d,记录发病和死亡情况。在无菌条件下,用75%酒精棉球对死亡鱼体进行体表消毒,利用无菌器械进行解剖,并按照步骤1.2 的方法开展病原菌的再分离。
1.4 病原菌形态与理化特性检测
将纯化后的细菌(TZ-01)分别涂布至TSA 和TCBS(青岛海博生物技术有限公司)培养基上,28℃培养24 h 观察菌落颜色和特征。利用革兰氏染色试剂盒(北京索莱宝科技有限公司)对细菌进行革兰氏染色,光学显微镜观察。利用法国生物梅里埃公司API-20E 自动鉴定系统中的ONPG、ADH、ODC、CIT、H2S、URE、TDA、VP、GEL、IND、GLU、MAN、INO、SOR、RHA、SAC、MEL、AMY 和ARA 试剂条,按照说明书所述方法进行鉴定。从人工感染发病中华乌塘鳢体内分离得到的优势菌株同样采用上述方法进行生理生化鉴定。
1.5 16S rDNA 序列测定和分析
1.5.1 模板制备
挑取单一菌落于50 μL 无菌去离子水中,100℃水浴5 min,12 000 r·min-1离心20 min,取上清作为PCR 反应的模板。
1.5.2 PCR 扩增和测序
采用细菌16S rDNA 通用引物(正向引物为27F:5’-AGA GTT TGA TCC TGG CTC AG-3’;反向引物为1492R:5’-TAC GGC TAC CTT GTT ACG ACT T-3’),对菌株TZ-01 的16S rDNA 片段进行扩增。PCR扩增条件为:94℃预变性10 min;94℃变性40 s,55℃复性30 s,72℃延伸90 s,35 个循环;最后72℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测后,交由上海美吉生物医药科技有限公司进行测序。
1.5.3 序列分析及系统发育树构建
将测序得到的病原菌16S rDNA 序列,在GenBank 数据库中进行DNA 序列的Blast 比对。下载已发表的相关弧菌属细菌的16S rDNA 序列,利用MEGA7 软件[15]进行序列比对和系统发育树构建分析。采用邻接法(Neighbor-Joining method,NJ),选取P-distance 模型,进行系统发育树构建。通过自展分析(bootstrapping)进行系统发育树分支可信度检验,自展数据集设定为5 000 次。
1.6 药敏试验
将培养24 h 的细菌制备成1×108CFU·mL-1菌悬液,取50 μL 均匀涂布于TSA 培养基平板上,用无菌镊子将抗生素纸片(杭州微生物试剂有限公司)贴于平板中央,每个平板1 片,28℃恒温培养24 h,用游标卡尺测量抑菌圈直径。抑菌圈直径(Ф)>16 mm 判为高度敏感(用“+++”表示);10 mm<Ф≤15 mm 判为中度敏感(用“++”表示);7 mm<Ф≤10 mm 判为低度敏感(用“+”表示);Ф≤7 mm 判为耐药(用“-”表示)。
1.7 主要器官的组织病理观察
采集自然发病中华乌塘鳢的肝脏和脾脏,用4%多聚甲醛溶液固定,常规石蜡包埋切片,苏木精-伊红(H.E.)染色,中性树胶封片,用尼康(Nikon)90i 显微镜进行观察、拍照。
2 结果
2.1 症状
患病中华乌塘鳢主要表现为:游动缓慢、摄食能力下降,经常浮出水面并散布在养殖池周围;体表出现出血斑点,鱼鳍基部充血、背部肌肉溃烂等;解剖发现病鱼肝脏病变呈土黄色,脾脏充血肿大,肠道后端有黄色粘液。
2.2 病原菌
从患病中华乌塘鳢的体表溃疡部位、肝脏、脾脏等内脏中分离到一株优势菌株,命名为TZ-01。菌株TZ-01 在TSA 培养基上培养24 h,形成淡黄色圆形菌落,隆起,表面光滑湿润(图1A);在TCBS 培养基上形成圆形菌落,微隆起,呈蓝色或蓝绿色(图1B)。革兰氏染色呈阴性(图1C),短杆状。

图1 菌株TZ-01 的菌落特征和革兰氏染色Fig.1 Colonies characteristics and Gram stain of the Strain TZ-01
2.3 人工感染实验
菌株TZ-01 人工感染后的中华乌塘鳢症状与自然发病的症状相似。高浓度菌悬液(1×109CFU·mL-1)注射感染1~2 d 后,中华乌塘鳢开始大量死亡,至第5 d 全部死亡,死亡率100%;中浓度菌悬液(1×107CFU·mL-1)注射感染3~4 d 后,开始出现死亡,至第14 d 共死亡4 尾,死亡率40%;低浓度菌悬液(1×105CFU·mL-1)注射感染后,出现活动、摄食减少等不良反应,但14 d 内无死亡。对照组未出现死亡个体。人工感染发病的中华乌塘鳢同样出现体表充血、鳍条充血、肝脾肿大等症状。从人工感染发病死亡的中华乌塘鳢病灶部位分离到优势菌株,经生理生化鉴定与TZ-01 菌相同,再次感染中华乌塘鳢后同样出现与自然发病类似的症状。表明TZ-01 菌即为此次养殖中华乌塘鳢皮肤溃疡病的病原菌。
2.4 生理生化鉴定结果
API-20E 系统鉴定结果如表1 所示。菌株TZ-01 的主要特性为:革兰氏阴性菌,短杆状,在TCBS 培养基上形成蓝绿色圆形菌落;发酵型,氧化酶、赖氨酸脱羧酶、鸟氨酸脱羧酶为阳性,β-半乳糖苷酶、精氨酸双水解酶、苯丙氨酸脱氨酶为阴性;柠檬酸盐、尿素、VP 为阴性,不产H2S;明胶酶和吲哚为阳性;利用葡萄糖、甘露醇和阿拉伯糖产酸,不利用肌醇、山梨醇、鼠李糖、蔗糖、蜜二糖和苦杏仁苷。根据上述结果,参考《伯杰氏细菌鉴定手册》(第八版)[16]及相关文献[17-19]报道,判定菌株TZ-01 与副溶血弧菌Vibrio parahaemolyticus 的各项生理生化特征一致。
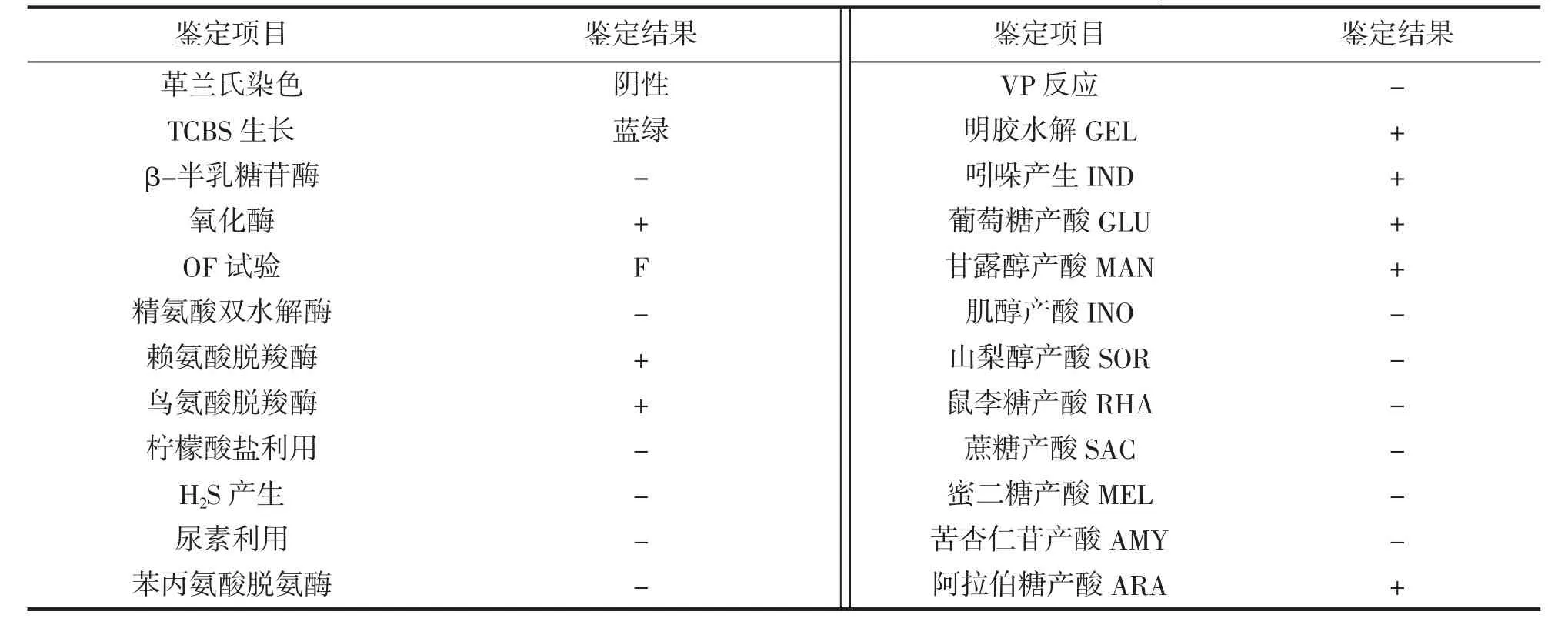
表1 菌株TZ-01的API-20E生化鉴定结果Tab.1 Results of biochemical identification of the strain TZ-01 by API-20E
2.5 16S rDNA 序列分析
利用通用引物27F 和1492R,从菌株TZ-01 的基因组DNA 中扩增得到长度约1 400 bp 的PCR 产物(图2),测序得到菌株TZ-01 的16S rDNA 序列长度为1 381 bp(GenBank 登录号为MK341129)。在GenBank 数据库中进行DNA 序列的Blast 比对发现,菌株TZ-01 与副溶血弧菌的16S rDNA 序列相似度最高,达到99%。从NCBI 数据库选取10 种弧菌的16S rDNA 序列,利用MEGA 7 软件构建Neighbor-Joining(NJ)系统发育树。结果表明,菌株TZ-01 首先与副溶血弧菌发生聚类,置信度为97%(图3),说明菌株TZ-01 与副溶血弧菌的亲缘关系最近。结合生理生化鉴定的结果,可以将菌株TZ-01 鉴定为副溶血弧菌。

图2 菌株TZ-01 的16S rDNAPCR 产物琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of 16S rDNA PCR products of the strain TZ-01

图3 基于16S rDNA 序列的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequences
2.6 药敏试验结果
药敏试验结果如表2 所示。在所试验的20 种药物中,菌株TZ-01 对米诺环素、多西环素、四环素、头孢哌酮、头孢曲松、头孢他啶和头孢呋辛等7 种抗生素高度敏感;对头孢拉定、哌拉西林、氨苄西林、苯唑西林和青霉素等5 种抗生素不敏感。
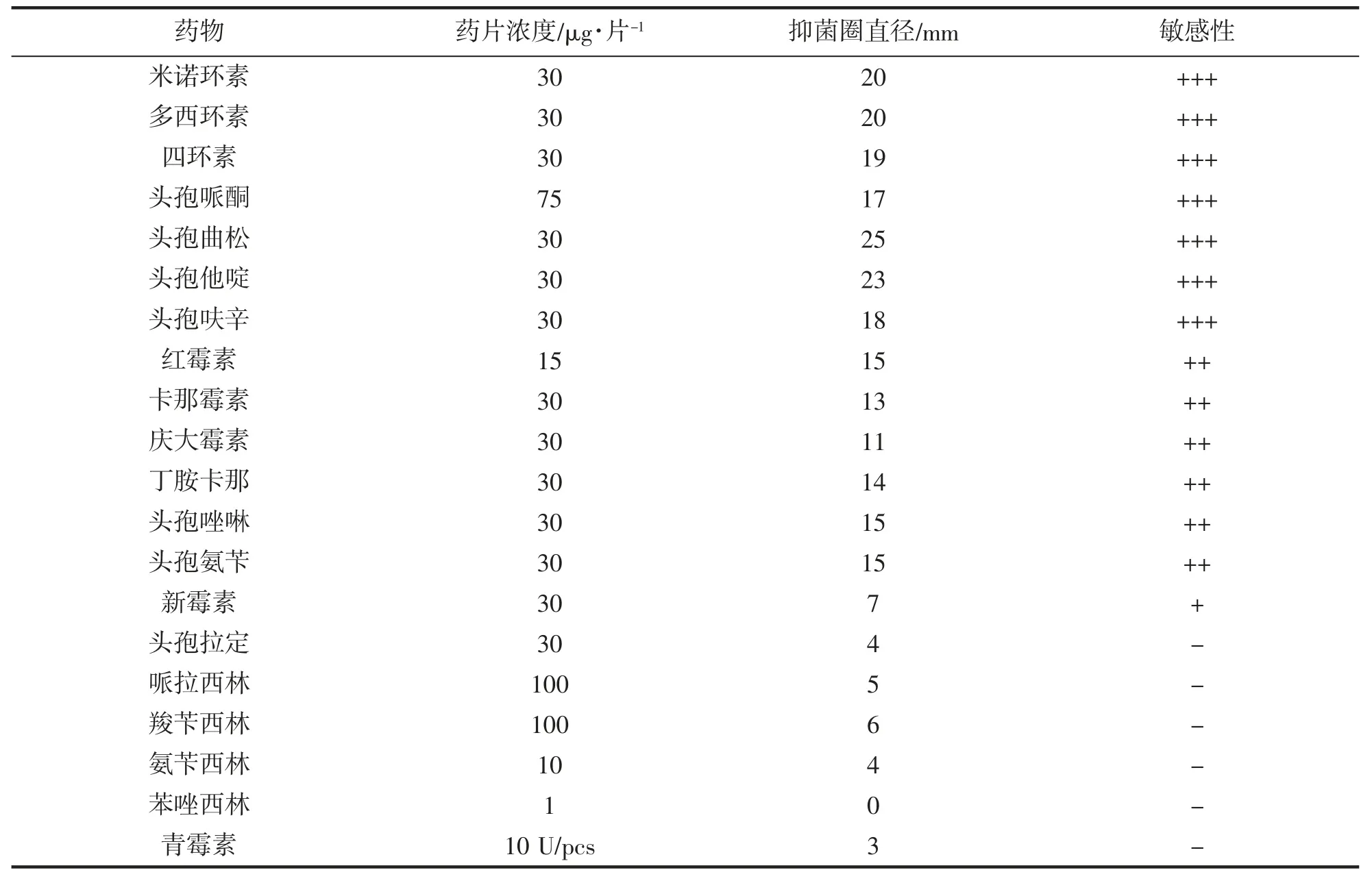
表2 药敏试验结果Tab.2 The results of the drugs sensitivity test
2.7 主要器官的组织病理观察
经组织切片观察发现,患病中华乌塘鳢的肝脏和脾脏器官均发生了不同程度的损伤。病鱼肝组织严重变性坏死,肝细胞排列紊乱,细胞界限模糊不清;部分肝细胞解体,肝细胞肥大,呈现脂肪变性、空泡化(图4A)。病鱼脾脏组织同样出现不同程度的变性坏死,脾窦和脾索不清晰,内有大量的含铁血黄素沉积;部分脾脏细胞解体,细胞核溶解(图4B)。

图4 患病中华乌塘鳢病理组织切片Fig.4 Pathological sections of diseased Chinese black sleeper
3 讨论
本研究从患皮肤溃疡病的养殖中华乌塘鳢体表病灶及内脏分离到一株优势菌TZ-01,经人工感染实验证实该菌是引发养殖中华乌塘鳢皮肤溃疡病的病原之一。综合细菌形态观察、生理生化特性测定以及系统发育分析的结果,鉴定菌株TZ-01 为副溶血弧菌。
弧菌广泛分布于半咸水、河口、海洋的水体、沉积物中以及海洋生物的体表和肠道中,是海水、原生动物、鱼类等海洋生物的正常优势菌群[20]。由弧菌属细菌感染引起的弧菌病,给海水养殖鱼类、贝类及甲壳类等经济动物的养殖业造成巨大的经济损失[21]。其中,副溶血弧菌是引起多种海水鱼类弧菌病的主要病原菌之一。据报道,副溶血弧菌可以感染包括大黄鱼Larimichthys crocea[17]、石斑鱼Epinephelus[22]、凡纳滨对虾Litopenaeus vannamei[23-24]、贝类等[25]多种经济水产养殖动物并引起大量死亡,从而造成严重的经济损失。陈心等[26]从福建东山养殖场的患病中华乌塘鳢体内分离到了2 种病原菌(分别命名为090625 和070925),经鉴定分别为哈维氏弧菌V.harveyi 和副溶血弧菌。该团队利用褐菖鮋Sebastiscus marmoratus 和大黄鱼分别开展回归感染和攻毒实验,结果表明这两种病原菌均能感染上述2 种试验鱼并引起典型的弧菌感染症状[26]。这些研究结果表明,副溶血弧菌是引起养殖中华乌塘鳢弧菌感染的常见致病菌之一。
人工感染实验发现,高浓度和中浓度的副溶血弧菌注射感染能引起中华乌塘鳢大量死亡,而低浓度注射感染虽会引起不良反应,但并未引起鱼体死亡。该结果表明,副溶血弧菌感染并导致中华乌塘鳢死亡具有剂量依赖性的特点。作为条件致病菌,弧菌引起养殖水产动物发病通常与养殖环境中的弧菌数量有关[21]。当养殖环境恶化时,水体中正常的弧菌菌群发生大量繁殖,进而引起养殖水产动物爆发弧菌性疾病。目前中华乌塘鳢的养殖仍然依靠小杂鱼、虾等天然饵料[3],饵料残留、排泄物积累等容易引起养殖水体恶化,进而导致副溶血弧菌等条件致病菌大量繁殖。此外,中华乌塘鳢属于凶猛的肉食性鱼类,容易出现互相残杀现象[3],极易导致体表出现创伤,从而加剧养殖中华乌塘鳢通过体表伤口感染致病菌的几率。因此,在中华乌塘鳢养殖过程中,应注意控制养殖密度、适时适量投喂饵料,避免水质败坏,并及时进行分级培育。
自然发病和副溶血弧菌人工感染发病的中华乌塘鳢均表现出体表出血、肌肉溃烂等症状,这与大黄鱼[17,26]、褐菖鮋[26]、大菱鲆Scophthalmus maximus[19]等鱼类感染副溶血弧菌的症状相一致。组织病理学观察发现,副溶血弧菌感染会严重损伤中华乌塘鳢的内脏器官。对感染副溶血弧菌的三斑鲹进行组织病理学观察发现,病鱼的肠道黏膜脱离、坏死,肝脏发生脂肪变性[27]。感染哈维氏弧菌后,大黄鱼的头肾、脾脏、肝脏等内脏器官均出现不同程度的变性以及坏死[28-29]。溶藻弧菌V.alginolyticus 感染同样会对斜带石斑鱼E.coioides 的肝脏、肾脏等主要器官造成严重病理损伤[30]。肝脏和脾脏是重要的免疫器官,在硬骨鱼类天然免疫中发挥重要的作用[31]。因此,由肝脏和脾脏严重坏死引起的鱼体免疫力下降,以及内脏功能衰竭很有可能是造成感染副溶血弧菌中华乌塘鳢出现死亡的重要原因之一。
药敏试验表明,TZ-01 菌株对米诺环素、多西环素等7 种抗生素高度敏感;对头孢拉定、哌拉西林、等5 种抗生素不敏感。对从患病大菱鲆体内分离到的副溶血弧菌开展药敏试验发现,该菌株对庆大霉素、红霉素、链霉素和呋喃妥因敏感,但是对青霉素、环丙沙星和四环素不敏感[24]。对从患病凡纳滨对虾体内分离到的副溶血弧菌开展研究发现,该致病菌株对氧哌嗪青霉素高度敏感,但是对麦迪霉素、恩诺沙星、土霉素产生较强的抗药性[32]。这些药敏试验研究的结果,可以为副溶血弧菌引起的水产动物疾病防治提供用药参考。

