丹参注射液对糖尿病大鼠肾小管TLR4蛋白表达的影响
徐仲儒, 阮 旭, 杨 晔,2, 尹登科,2,3∗
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽省中医药科学院药物制剂研究所,安徽 合肥 230012;3.中药复方安徽省重点实验室,安徽合肥 230012)
随着生活水平不断提升,糖尿病作为代谢紊乱性疾病逐渐成为人类健康的严重威胁,它是一种多因素、多靶点的顽疾,发病率随年龄增长而迅速升高。在临床治疗过程中通常只能采用保守疗法对病情加以缓解,针对诊断出的临床病症进行全面治疗是首要方案。糖尿病肾病是糖尿病主要并发症,也是造成终末期肾衰竭的罪魁祸首之一,如不及时治疗则会逐步恶化,并危及患者生命。
Toll样受体4(TLR4)信号通路是机体固有免疫的主要构成之一,可通过激活NF-κB信号通路导致下游炎症因子释放、炎症细胞浸润,以及相关炎症因子再释放导致信号放大等[1],其中TLR4/NF-κB信号通路是以脂多糖等为配体的固有免疫信号传导途径。研究表明糖尿病状态下胰岛素抵抗与该信号通路存在相关性[2],同时肾小球滤过功能下降、肾小管重吸收能力不足可能也是由于炎症反应所致[3],故对糖尿病状态下固有免疫异常状态的调节与稳定是糖尿病整体治疗的一个重要思路[4-5]。
丹参作为传统活血化瘀中药,在临床上广泛用于治疗糖尿病肾病,并取得了较好的效果[6]。近期研究表明,丹参中的脂溶性成分丹参酮可下调单核巨噬细胞TLR4/NF-κB信号通路,从而起到降低炎症反应的作用[7];水溶性成分丹酚酸B也可减轻缺血性中风模型的炎症反应[8]。课题组前期发现,丹参注射液可改善糖尿病大鼠肾小管结构变化,恢复肾小管功能[9],对AngⅡ诱导的大鼠肾小管上皮细胞 (NRK-52E)有显著保护作用,推测可能是通过调节PI3K/Akt信号通路所致[10]。本实验考察丹参注射液对糖尿病状态下肾小管TLR4表达的影响,从固有免疫与炎症角度阐述该制剂对糖尿病肾病的改善作用。
1 材料
大鼠肾小管上皮细胞 (NRK-52E,中国科学院生物化学与细胞生物学研究所)。SD大鼠 (体质量180~220 g)购自安徽中医药大学实验动物中心,动物合格证号SCXK(皖)2017-001。丹参注射液 (生药量1.5 g/mL,批号1705083,正大青春宝药业有限公司);盐酸二甲双胍片 (批号48180104,上海上药信谊药厂有限公司)。高糖高脂饲料 (安徽中医药大学动物中心);链脲佐菌素(美国Sigma公司,产品编号LS0130);四甲基偶氮唑盐 (北京索莱宝科技有限公司,批号1212U054);TLR4兔抗鼠多克隆抗体 (批号8730k26)、HRP山羊抗兔抗体 (批号 2847b43)(美国Affinity公司);β-actin鼠源单克隆抗体 (批号ATQAP1801)、HRP山羊抗鼠抗体 (批号ATQMA2701,美国Abbkine公司);SDS-PAGE凝胶试剂盒 (上海碧云天生物技术有限公司,产品编号P0012 A);ECL超敏试剂盒 (美国 Thermo Scientific公司,批号RF232184 A);苏木素 (广州市欣源贸易有限公司,批号20180224);伊红 (北京索莱宝科技有限公司,批号20171123);PV6000(北京中杉金桥生物技术有限公司,批号17G87D11)。SCW-CJ-2FD型洁净工作台 (苏州宏瑞净化科技有限公司);SPECTRA MAX-190型酶标仪 (美国MDC公司);倒置生物显微镜 (德国Leica公司);DYCZ-24DN型垂直电泳仪 (北京六一仪器厂);Amersham Imager 600型成像仪 (美国GE公司)。
2 方法
2.1 建模、分组与给药 40只大鼠随机分成4组,每组10只,普通饲料适应性喂养1周后,取其中30只每天喂养高糖高脂饲料,持续2周,再腹腔注射链脲佐菌素 (50 mg/kg),而普通饲料喂养的大鼠腹腔注射等剂量生理盐水,然后继续用相应饲料喂养,1周后,每天测定大鼠血糖,大于16.7 mol/L时视为造模成功。对造模成功的大鼠重新随机分为正常组、模型组、二甲双胍组、丹参注射液组,其中后3组继续用高糖高脂饲料喂养,而正常组用普通饲料喂养,每天按时对丹参注射液组大鼠腹腔注射丹参注射液 (2 mL/kg),二甲双胍组大鼠灌胃二甲双胍溶液 (150 mg/kg),模型组、正常组大鼠腹腔注射等剂量生理盐水 (2 mL/kg)。给药6周后处死大鼠,取肾脏置于中性福尔马林溶液中固定,对组织进行石蜡包埋、切片。
2.2 HE染色 将大鼠肾组织石蜡切片放入二甲苯中脱蜡后在梯度乙醇中水化,先用苏木素对细胞核染色5 min,1%盐酸乙醇分化30 s后温水返蓝,再用伊红复染30 s,梯度乙醇脱水,二甲苯透明后中性树胶封片。
2.3 免疫组化染色 将大鼠肾组织石蜡切片置于二甲苯中脱蜡,梯度乙醇水化,PBS漂洗3次,121℃下柠檬酸钠缓冲液中浸泡2 min以修复表面抗原,室温下自然冷却后清洗3次,过氧化物酶阻断剂室温下孵育10 min,漂洗3遍,37℃下山羊血清孵育20 min,倾去血清后滴加PV6000一抗,4℃下孵育过夜,TBST漂洗3次,滴加HRP二抗,37℃下孵育20 min,漂洗3次后滴加DAB显色液显色5 min,洗去DAB显色液,苏木素复染,盐酸乙醇分化,冲洗返蓝。脱水透化后,中性树胶封片,显微镜下观察。
2.4 高糖环境下NRK-52E细胞增殖检测 将对数生长期的细胞用胰酶消化,细胞计数板计数,按照5×104/mL细胞密度接种于96孔板中,37℃培养箱中培养至85%面积,更换无血清培养基同步化24 h,再更换含葡萄糖5.5、10、20、30、40、50、60、70、80 mmol/L的无血清培养基。干预 24 h后, 加入 20 μL MTT 溶液 (5 mg/mL) 孵育 4 h,吸去上清液,加入 150 μL二甲基亚砜后振摇10 min,在490 nm波长处检测吸光度。
2.5 高糖环境下NRK-52E细胞TLR4蛋白表达检测 将对数生长期的细胞用胰酶消化,按照5×105/mL细胞密度配制细胞悬液,加到6孔板中,待细胞长至单层85%面积后,更换无血清培养基同步化 24 h,再分别更换含葡萄糖 5.5、25、80 mmol/L的DMEM培养基,干预24 h后清洗细胞表面,每孔加50 μL裂解液,冰上裂解30 min,刮下细胞,4℃、12 000 r/min离心10 min,蛋白样品以4∶1体积加入上样缓冲液,煮沸5 min后在-20℃下长期保存。SDS-PAGE电泳采用5%浓缩胶和12%分离胶,按每孔30 μg蛋白量上样,浓缩胶电压70 V,分离胶电压更换为110 V,凝胶以200 mA电流转膜2 h,转膜结束后5%脱脂奶粉在37℃下封闭1 h,TBST漂洗3次,TLR4多克隆抗体 (兔源) (1∶800)、β-actin单克隆抗体 (鼠源)(1∶1 000)在4℃下孵育过夜,TBST漂洗3次,HRP标记的二抗在37℃下孵育1 h,漂洗3次后ECL显色液曝光,结果用Image J软件解析,得到灰度值。
2.6 丹参注射液对NRK-52E细胞的影响考察 将对数生长期的细胞用胰酶消化,按照1×104/孔细胞密度铺入96孔板,放入培养箱中培养至单层细胞85%面积,更换无血清培养基同步化24 h,随后正常组更换正常无血清培养基,模型组更换高糖无血清培养基,丹参注射液组更换丹参高糖无血清培养基 (相当于 30、 3、 0.3、 0.03 mg/mL原药材),培养24 h后加入MTT溶液孵育4 h,然后吸去上清,加入150 μL二甲基亚砜振摇均匀,在490 nm波长处检测吸光度。
2.7 丹参注射液对高糖环境下NRK-52E细胞TLR4蛋白表达的影响考察 将对数生长期的细胞用胰酶消化,均匀铺于6孔板中,待长至单层85%面积后更换无血清低糖培养基同步化24 h,同步化结束后正常组更换正常无血清培养基,模型组更换高糖无血清培养基,丹参注射液组分别更换30、3、0.3、0.03 mg/mL丹参高糖无血清培养基,干预24 h后提取蛋白质进行检测,方法同“2.5” 项。
2.8 统计学分析 通过SPSS 23.0软件进行处理,组间比较采用单因素方差分析。以P<0.05表示存在显著差异。
3 结果
3.1 丹参注射液对大鼠肾小管的保护作用 图1显示,正常组大鼠肾小管和肾小球形态清晰;模型组大鼠肾脏出现一定程度的肾小管胞外基质堆积和炎症细胞浸润;二甲双胍组、丹参注射液组上述症状较轻。

图1 大鼠肾组织HE染色 (×200)Fig.1 HE staining of rat renal tissue (×200)
3.2 丹参注射液对大鼠肾小管TLR4蛋白表达的影响 图2显示,与正常组比较,模型组TLR4蛋白表达显著升高 (P<0.01);与模型组比较,丹参注射液组其蛋白表达显著下降 (P<0.01),并与正常组比较无显著差异 (P>0.05)。
3.3 葡萄糖对NRK-52E细胞增殖和TLR4蛋白表达的影响 图3显示,作用24 h后随着葡萄糖浓度逐渐升高,细胞增殖率先升后降,并在其浓度超过 50 mmol/L 时更显著 (P<0.05)。
图4显示,葡萄糖浓度为25、80 mmol/L时,TLR4蛋白表达显著升高 (P<0.05, P<0.01)。
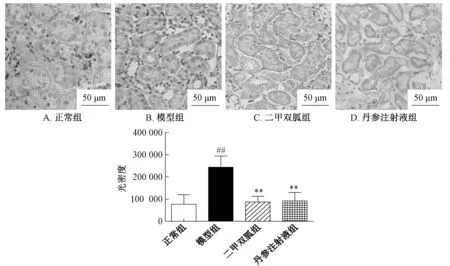
图2 丹参注射液对TLR4蛋白表达的影响 (×200)Fig.2 Effect of Danshen Injection on TLR4 protein expression (×200)

图3 葡萄糖对NRK-52E细胞增殖的影响Fig.3 Effect of glucose on NRK-52E cell proliferation

图4 葡萄糖对TLR4蛋白表达的影响Fig.4 Effect of glucose on TLR4 protein expression
3.4 丹参注射液对高糖环境下NRK-52E细胞增殖的影响 图5显示,与正常组比较,模型组细胞增殖被显著抑制 (P<0.05);与模型组比较,丹参注射液组 (30 mg/mL)可显著减弱这种抑制作用(P<0.05)。

图5 丹参注射液对高糖环境下NRK-52E细胞增殖的影响Fig.5 Effect of Danshen Injection on NRK-52E cell proliferation under high-glucose environment
3.5 丹参注射液对高糖环境下TLR4蛋白表达的影响 图6显示,与正常组比较,模型组TLR4蛋白显著上调 (P<0.01);与模型组比较,丹参注射液组其表达显著降低 (P<0.05,P<0.01),并呈剂量依赖性。
4 讨论

图6 丹参注射液对高糖环境下TLR4蛋白表达的影响Fig.6 EffectofDanshen Injection on TLR4 protein expression under high-glucose environment
Toll样受体作为激活固有免疫的重要信号通路,在受到配体刺激的情况下可传递炎症信号,并导致炎症细胞浸润及炎症因子释放[11]。本实验探讨丹参注射液对糖尿病大鼠肾脏的保护作用及对肾组织Toll样受体4(TLR4)蛋白表达的影响,发现丹参注射液在体内可有效降低大鼠TLR4蛋白表达,并对肾组织起到一定程度的保护作用;在体外可削弱高糖诱导大鼠肾小管上皮细胞 (NRK-52E)TLR4蛋白表达,并在一定范围内存在剂量依赖性。由此可知,丹参注射液可有效降低TLR4蛋白表达,可能是通过下调TLR4/NF-κB信号通路来降低其下游相关信号分子表达,从而起到保护糖尿病状态下大鼠肾小管的作用[12]。
现代糖尿病肾病的机制研究主要是针对多元醇代谢通路激活、氧化应激[13]、糖基化终末代谢产物堆积[14]、 炎症反应[15-16]等, 其中糖尿病肾病状态下炎症反应发生的重要原因之一可能是高糖环境下生成的糖基化终末产物 (AGEs)等配体激活NF-κB信号通路[17],造成炎症因子释放及炎症细胞浸润,另外有实验发现,糖尿病状态下TLR4信号通路激活与热休克蛋白70、高迁移率族蛋白B1存在正相关[18-19]。研究显示,体内胰岛素抵抗可能与TLR4信号通路上调有关,推测可能是由于Toll样受体激活后所释放的炎症因子和趋化蛋白等信号分子诱导所致[20-21], 同时 TLR4/NF-κB 信号通路可能作为上游信号通路来诱发肾组织氧化应激,从而造成糖尿病肾病氧化损伤[22],表明它在糖尿病肾病发病过程中起到重要作用,并与多种发病因素密切相关。
糖尿病在古籍中被记载为消渴症,中医临床诊断其以气虚血虚为始,因虚致瘀而后致病[23]。丹参在中医治疗糖尿病过程中作为治疗血瘀的良药,被广泛用于各种复方中,有实验证明其中的脂溶性成分丹参酮ⅡA[24]、 水溶性成分丹参素[25]及丹参多糖[26]等具有下调炎症相关信号通路的作用;相关临床研究也表明,丹参辅助治疗糖尿病肾病可有效地降低患者蛋白尿水平,相比单用西药有着更理想的疗效[27]。本研究通过阐明丹参注射液治疗糖尿病肾病的作用机制,可为中药临床用药及使用禁忌方面提供一定借鉴。

