白藜芦醇对APP/PS1双转基因小鼠学习记忆能力的改善作用
殷 紫, 张二飞, 韩永红, 徐秉忠
(1.江苏护理职业学院药学与中药学院,江苏淮安223001;2.江苏食品药品职业技术学院制药工程学院,江苏 淮安 223001)
阿尔茨海默病俗称老年痴呆症,是一种起病阴袭的渐进性神经退行性疾病,多发病于65岁以上的老年人,以渐进性发生的学习记忆障碍、语言障碍、行为障碍等为主要临床表现[1-3]。中国阿尔茨海默病协会最近调查显示,我国老年人群中患病人数已经超过 700万[4],预计到 2050年将增加到2 000万,成为世界上患病人口最多、增长最快的国家,给患者、家庭、社会、医疗带来沉重负担。目前,治疗阿尔茨海默病比较有效的药物有乙酰胆碱酯酶抑制剂多奈哌齐、利凡斯的明、加兰他敏,以及NMDA受体拮抗剂美金刚[5],但长期服用引起的副作用或不良反应在一定程度上限制了临床应用,故开发一种安全有效的治疗药物显得尤为重要。
白藜芦醇是一种首次从毛叶藜芦根部分离出来的非黄酮类多酚化合物,后来从虎杖、花生、桑葚等植物中也发现了这种天然活性成分,具有抗肿瘤、抗氧化、抗自由基、抗衰老、保肝、保护心血管等多种药理作用[6-7]。近年来,白藜芦醇对包括阿尔茨海默病在内的神经退行性疾病神经保护作用越来越受到科研人员重视,它对阿尔茨海默病的延缓作用主要表现为抑制Aβ(β-淀粉样蛋白)生成、稳定微管相关蛋白、抑制炎症、抗氧化等方面。刘贵珊等[8]发现,白藜芦醇可通过提高脑组织抗氧化能力来改善D-半乳糖致衰老模型小鼠的学习记忆能力;王宇等[9]报道,白藜芦醇可通过抑制炎症反应来提高海马神经元数量,从而达到治疗阿尔茨海默病的作用,但鲜有关于白藜芦醇是否通过抑制APP/PS1双转基因小鼠海马区胶质细胞增生、促炎症因子释放来改善学习记忆能力的报道。因此,本实验将进行该方面的研究,并探讨其机制。
1 材料
1.1 试药 白藜芦醇 (批号R5010,含有量≥99%)、多奈哌齐 (批号664081,含有量≥95%)、牛血清白蛋白均购于美国Sigma公司;FITC标记的山羊抗小鼠的二抗购于美国Jackson公司;DAPI染色液购于上海碧云天生物技术有限公司;RNA isolater Total RNA Extraction Reagent购于诺唯赞生物技术有限公司;RevertAidTM First Strand cDNA Synthesis Kit、PCR Master Mix Kit购自美国Thermo公司;小鼠IL-1β、IL-6和TNF-α ELISA试剂盒购于上海酶联生物科技有限公司。
1.2 仪器 Morris水迷宫系统 (赞德仪器有限公司);冰冻切片机 (HM525,北京华兴科仪科技发展有限公司);倒置荧光生物显微镜 (FM-500,上海普丹光学仪器有限公司);PCR仪 (MG96G,杭州朗基科学仪器有限公司);凝胶成像系统(2500R,上海天能科技有限公司);紫外可见分光光度计 (UV9100)、酶标仪 (DNM-9602A) (邢台润联机械设备有限公司)。
1.3 动物 野生型C57BL/6小鼠购自上海杰思捷实验动物有限公司,合格证号SCXK(沪)2013-0006;9月龄APP/PS1双转基因C57BL/6小鼠购自南京大学模式动物研究所,合格证号SCXK(苏)2010-0021。每笼2~3只小鼠,自由饮食饮水,12 h昼夜交替饲养,室温 (22±2)℃,相对湿度55%~65%。
2 方法
2.1 分组及给药10只C57BL/6小鼠作为对照组;50只APP/PS1双转基因小鼠随机分为模型组、多奈哌齐组 (10 mg/kg)及白藜芦醇低、中、高剂量组 (25、50、100 mg/kg), 每组 10只。 白藜芦醇组小鼠灌胃含相应剂量的药物 (1%CMC-Na助溶),每天1次,连续40 d;模型组、对照组小鼠灌胃等容量生理盐水 (含1%CMC-Na)[8-10]。
2.2 Morris水迷宫定位航行实验[11]给药后,将小鼠从平台所在象限的对侧头朝池壁放入水中,进行定位航行实验,共5 d(训练4 d+正式实验1 d),其间记录小鼠找到并爬上平台的线路图和所需时间,即为小鼠游泳路程和逃避潜伏期。如果小鼠逃避潜伏期超过60 s,则引导其爬上平台并停留10 s,并将逃避潜伏期设定为60 s,根据各组小鼠的游泳路程和逃避潜伏期比较其学习能力。
2.3 Morris水迷宫空间探索实验[11]定位航行实验结束后撤除平台,将小鼠从平台所在象限的对侧头朝池壁放入水中,记录60 s内小鼠穿越平台次数及在原平台所在象限停留时间,并对所得数据进行分析。
2.4 组织切片 检测完学习记忆能力后,10%水合氯醛麻醉小鼠,仰放于手术台上,去毛,剪开胸腔,暴露心脏,用预冷生理盐水进行心脏灌注,待小鼠肝脏变白后换成4%多聚甲醛进行灌注,直到肝脏变硬、四肢及尾巴僵硬为止,断头取脑,将脑组织放入30%蔗糖溶液中,4℃下过夜,再包埋于-80℃冰箱中冻实,置于-20℃冰冻切片机中作连续冠状切片,片厚5 μm,隔十取一,置于4℃切片盒中备用[12]。
2.5 脑内星型胶质细胞表达检测 采用免疫荧光法。脑组织切片置于4%多聚甲醛中固定30 min,1%PBS洗涤3次后1%Tritox X-100充分透化30 min,1%PBS洗涤3次后加入5%BSA溶液,室温下孵育30 min,加入小鼠抗GFAP稀释液 (1∶300),4℃下孵育过夜,1%PBS洗涤3次后加入FITC标记的山羊抗小鼠的二抗稀释液 (1∶500),1%PBS洗涤3次后加入 DAPI染色液 (1∶50),室温下避光放置10 min,倒置荧光显微镜下观察拍照[13], 重复 3 次。
2.6 IL-1β、 IL-6、 TNF-α mRNA 表达检测 参照RNA isolater说明书操作步骤提取小鼠海马区RNA,RevertAidTM First Strand cDNA Synthesis Kit反转成cDNA,PCR Master Mix Kit构建PCR反应,引物序列见表1。反应条件为95℃预变性2 min,95℃变性30 s,55℃退火30 s,72℃延伸1 min,扩增40个循环,72℃终延伸 10 min[13], 以 β-actin为内参。然后,所得结果用琼脂糖凝胶电泳及凝胶成像系统分析,Image J图像分析软件对条带进行吸光度扫描,结果用相对光密度 (光密度目的基因/光密度β-actin) 表示。
2.7 IL-1β、IL-6、TNF-α水平检测 取小鼠脑组织0.1 g,加入1% PBS制成1 mL匀浆,按照ELISA试剂盒说明书操作步骤在450 nm波长处测定吸光度,根据回归方程计算蛋白浓度,重复3次。

表1 引物序列Tab.1 Primer sequences
2.8 统计学分析 通过SPSS 17.0软件进行处理,数据用s)表示,组间比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
3 结果
3.1 白藜芦醇对小鼠学习能力的影响 图1、表2显示,与对照组比较,第2天 (训练)开始模型组小鼠逃避潜伏期显著延长 (P<0.05,P<0.01);与模型组比较,第4天 (训练)、第5天 (正式实验)白藜芦醇中、高剂量组小鼠逃避潜伏期显著缩短 (P<0.05, P<0.01)。
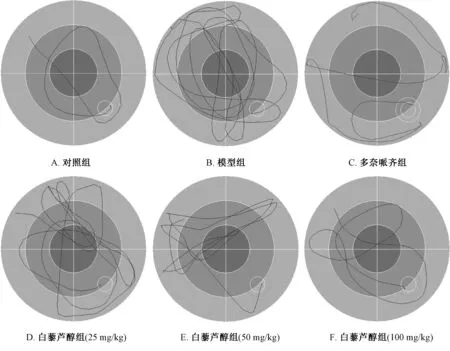
图1 各组游泳路线Fig.1 Swimming routes in various groups
表2 白藜芦醇对逃避潜伏期的影响 (s,, n=10)Tab.2 Effects of resveratrol on escape latent period (s,, n=10)
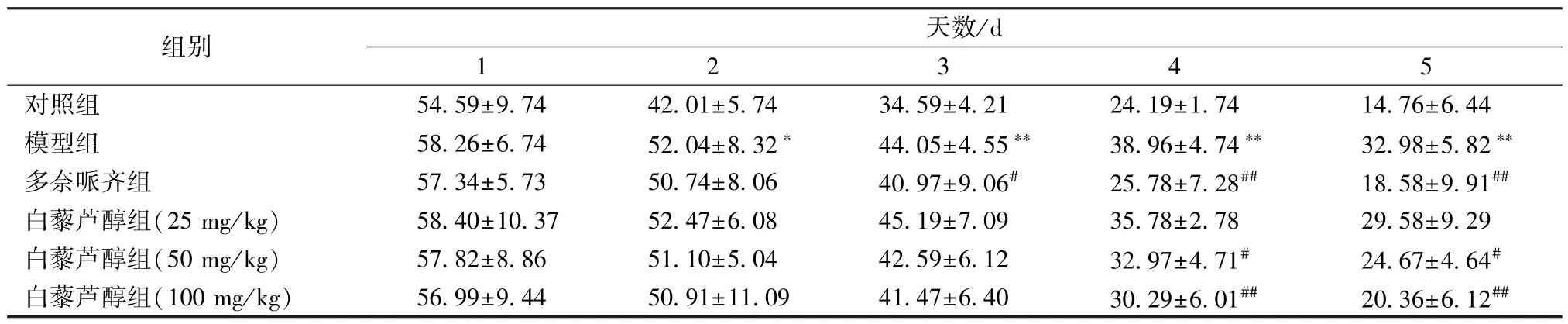
表2 白藜芦醇对逃避潜伏期的影响 (s,, n=10)Tab.2 Effects of resveratrol on escape latent period (s,, n=10)
注:与对照组比较,∗P<0.05,∗∗P<0.01;与模型组比较,#P<0.05, ##P<0.01
组别 天数/d 1 2 3 4 5对照组 54.59±9.74 42.01±5.74 34.59±4.21 24.19±1.74 14.76±6.44模型组 58.26±6.74 52.04±8.32∗ 44.05±4.55∗∗ 38.96±4.74∗∗ 32.98±5.82∗∗多奈哌齐组 57.34±5.73 50.74±8.06 40.97±9.06# 25.78±7.28## 18.58±9.91##白藜芦醇组(25 mg/kg) 58.40±10.37 52.47±6.08 45.19±7.09 35.78±2.78 29.58±9.29白藜芦醇组(50 mg/kg) 57.82±8.86 51.10±5.04 42.59±6.12 32.97±4.71# 24.67±4.64#白藜芦醇组(100 mg/kg) 56.99±9.44 50.91±11.09 41.47±6.40 30.29±6.01## 20.36±6.12##
3.2 白藜芦醇对小鼠记忆能力的影响 表3显示,与对照组比较,模型组穿越平台次数、目标象限停留时间显著减少 (P<0.01);与模型组比较,白藜芦醇中、高剂量组两者显著增加 (P<0.05,P<0.01)。
3.3 白藜芦醇对小鼠海马区星形胶质细胞表达的影响 图2、表4显示,与对照组比较,模型组海马区凋亡细胞显著增多 (P<0.01);与模型组比较,白藜芦醇中、高剂量组大脑皮层神经细胞凋亡率显著降低 (P<0.01)。
表3 白藜芦醇对穿越平台次数和目标象限停留时间的影响n=10)Tab.3 Effects of resveratrol on platform-crossing frequency and target quadrant residence times, n=10)
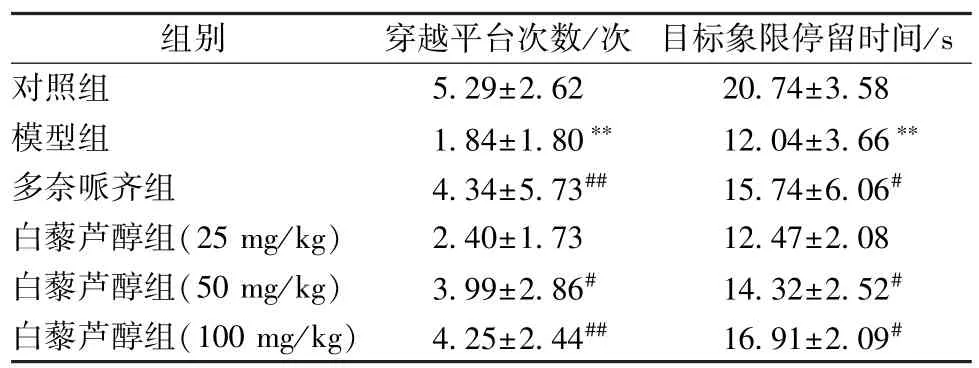
表3 白藜芦醇对穿越平台次数和目标象限停留时间的影响n=10)Tab.3 Effects of resveratrol on platform-crossing frequency and target quadrant residence times, n=10)
注:与对照组比较,∗∗P<0.01;与模型组比较,#P<0.05, ##P<0.01
组别 穿越平台次数/次 目标象限停留时间/s对照组 5.29±2.62 20.74±3.58模型组 1.84±1.80∗∗ 12.04±3.66∗∗多奈哌齐组 4.34±5.73## 15.74±6.06#白藜芦醇组(25 mg/kg) 2.40±1.73 12.47±2.08白藜芦醇组(50 mg/kg) 3.99±2.86# 14.32±2.52#白藜芦醇组(100 mg/kg) 4.25±2.44## 16.91±2.09#

图2 各组星形胶质细胞表达Fig.2 Astrocyte expressions in various groups
表4 白藜芦醇对星形胶质细胞表达的影响 (x±s, n=10)Tab.4 Effect of resveratrol on astrocyte expressionn=10)

表4 白藜芦醇对星形胶质细胞表达的影响 (x±s, n=10)Tab.4 Effect of resveratrol on astrocyte expressionn=10)
注:与对照组比较,∗∗P<0.01;与模型组比较,##P<0.01
对照组 5.11±1.50模型组 21.78±2.43∗∗多奈哌齐组 8.94±5.37##白藜芦醇组(25 mg/kg) 19.75±2.06白藜芦醇组(50 mg/kg) 15.55±2.18##白藜芦醇组(100 mg/kg) 10.58±5.18##
3.4 白藜芦醇对小鼠海马区IL-1β、IL-6、TNF-α mRNA表达的影响 图3、表5显示,与对照组比较,模型组 IL-1β、IL-6、TNF-α mRNA表达显著上升 (P<0.01);与模型组比较,白藜芦醇中、高剂量组三者mRNA表达显著降低 (P<0.01),同时低剂量组 IL-1β mRNA表达也显著降低 (P<0.05)。

图3 各组IL-1β、IL-6、TNF-α mRNA表达Fig.3 IL-1β, IL-6 and TNF-α mRNA expressions invarious groups
表5 白藜芦醇对IL-1β、IL-6、TNF-α mRNA表达的影响( n=10)Tab.5 Effects of resveratrol on IL-1β, IL-6 and TNF-α mRNA expressions, n=10)

表5 白藜芦醇对IL-1β、IL-6、TNF-α mRNA表达的影响( n=10)Tab.5 Effects of resveratrol on IL-1β, IL-6 and TNF-α mRNA expressions, n=10)
注:与对照组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01
?
3.5 白藜芦醇对小鼠海马区IL-1β、IL-6、TNF-α水平的影响 表6显示,与对照组比较,模型组IL-1β、 IL-6、 TNF-α 水平显著升高 (P<0.01); 与模型组比较,白藜芦醇中、高剂量组三者水平显著降低 (P<0.01),同时低剂量组IL-1β水平也显著降低 (P<0.05)。
表6 白藜芦醇对IL-1β、IL-6、TNF-α水平的影响(ng/L, n=10)Tab.6 Effects of resveratrol on IL-1β, IL-6 and TNF-α levels (ng/L±s, n=10)
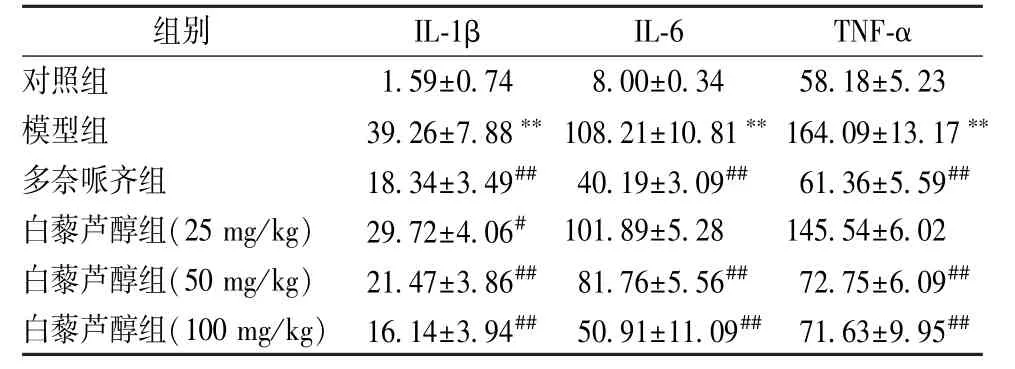
表6 白藜芦醇对IL-1β、IL-6、TNF-α水平的影响(ng/L, n=10)Tab.6 Effects of resveratrol on IL-1β, IL-6 and TNF-α levels (ng/L±s, n=10)
注:与对照组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 IL-1β IL-6 TNF-α对照组 1.59±0.74 8.00±0.34 58.18±5.23模型组 39.26±7.88∗∗ 108.21±10.81∗∗ 164.09±13.17∗∗多奈哌齐组 18.34±3.49## 40.19±3.09## 61.36±5.59##白藜芦醇组(25 mg/kg) 29.72±4.06# 101.89±5.28 145.54±6.02白藜芦醇组(50 mg/kg) 21.47±3.86## 81.76±5.56## 72.75±6.09##白藜芦醇组(100 mg/kg) 16.14±3.94## 50.91±11.09## 71.63±9.95##
4 讨论
在阿尔茨海默病研究过程中,出现了多种动物模型,如兴奋性氨基酸毒性损害模型、脑室注射Aβ1-42模型等[14-15]。随着转基因及克隆技术的快速发展,科学家将与阿尔茨海默病相关的人突变基因淀粉样前体蛋白 (APP)基因、早老素-1(PS1)基因、Tau蛋白基因中的1个或几个转入C57BL/6小鼠等啮齿动物的生殖细胞中,使这些突变基因稳定表达并遗传给后代,达到模拟人类发病及其进程的目的[16]。根据转入基因数目的多少,可将阿尔茨海默病转基因小鼠分为单转、双转和多转,其中单转不足以模拟发病进程,而多转在后期可能会引起其他未知基因的突变,不可控性强,故APP/PS1双转基因小鼠是最佳动物模型。
本实验发现,与对照组比较,模型组小鼠有着更长的逃避潜伏期与航行线路,并且穿越平台次数与目标象限停留时间明显减少,表明模型可靠性高;给予白藜芦醇后,不仅缩短了逃避潜伏期及游泳距离,还增加了穿越平台次数及停留时间,表明该成分可提高小鼠学习记忆能力,并呈剂量依赖性。
目前大多数学者认为,神经炎症在阿尔茨海默病发病中起着重要的作用,其过程是由星形胶质细胞和小胶质细胞释放的细胞因子介导,并参与免疫反应。其中,星形胶质细胞是体积最大、分布最广的一类胶质细胞,它从胞体发出许多长而分支的突起,伸展并填充于神经元胞体及突触之间,发挥支持和分隔的作用[17];它在生理状态下呈静止状态,而当脑内Aβ大量沉积时呈活化状态,细胞肿胀、肥大、突出增多,胶质纤维酸性蛋白 (GFAP)表达增强,并释放IL-1β、IL-6、TNF-α等炎性介质,导致脑内临近的神经元变性死亡[18]。
由于脑内海马区发挥记忆作用及方向定位作用,故本实验通过免疫组织化学染色法检测了小鼠脑内海马DG区GFAP表达。结果,模型组小鼠脑内海马区 GFAP阳性细胞比例达 (21.78±2.43)%,显著高于对照组,并且 IL-1β、IL-6、TNF-α mRNA表达和水平也显著升高,而给予白藜芦醇后阳性细胞比例明显减少,3种炎性因子增强作用也被明显逆转,显示了该成分对炎症反应的抑制作用,也进一步印证它可通过减少脑内海马区星形胶质细胞增生及炎症因子表达来改善小鼠学习记忆能力。
综上所述,白藜芦醇可改善APP/PS1双转基因小鼠学习记忆能力,可能是通过抑制脑内海马区星形胶质细胞增生及炎性因子释放、减轻炎症反应来发挥治疗作用。本实验可为治疗阿尔茨海默病等神经退行性疾病开辟新途径,具有广阔的临床应用前景和重大的社会经济价值。

