南方红豆杉水提物通过PI3K/AKT/mTOR信号通路调控HER2阳性胃癌移植瘤生长实验研究
池苗苗 王亚坤 谢长生
胃癌是常见恶性肿瘤之一。抗人类表皮生长因子受体2(HER2)单克隆抗体曲妥珠单抗(Trastuzumab,商品名:赫赛汀,Herceptin)对 HER2 阳性胃癌有明显的临床意义。磷脂酰肌醇3-激酶(phosphoinositide-3 kinase,PI3K)/蛋 白 激 酶 B(protein kinase B,PKB,又称AKT)信号通路的异常激活对胃癌的发生起着重要的作用[1],可受HER2调控,活化的AKT又可激活下游的雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),研究表明,PI3K/AKT/mTOR信号传导通路异常激活后,可发生肿瘤疾病,并与细胞增殖和凋亡相关[2]。南方红豆杉(taxus chinensis var.mairei)具有较高的抗肿瘤作用。本实验通过建立人胃癌HER2阳性移植瘤模型裸鼠,研究南方红豆杉水提物对PI3K/AKT信号通路相关靶点的作用,并从mRNA及蛋白表达水平对其机制进行初步探讨,为临床用药提供依据。
1 实验材料
1.1 动物与瘤株 4~6周龄BALB/c裸鼠80只,体质量18~20g,购自上海西普尔-必凯实验动物有限公司,生产许可证号:[SCXK(沪)2013-0016]。人胃癌HER2阳性细胞株NCI-N87购自中国科学院上海生命科学研究院细胞资源中心。
1.2 药物与试剂 南方红豆杉购自宁波泰康红豆杉生物工程有限公司(规格:8g/袋,批号 100513)。曲妥珠单抗:购自上海罗氏公司(规格:440mg/瓶,批号N3586)。GIBCO胎牛血清购自美国GIBCO公司,RPMI-1640培养液购自吉诺生物医药技术有限公司。
1.3 主要仪器 蛋白印迹检测系统由美国Bio-Rad公司生产,多功能全波长酶标仪系统由美国Thermo公司生产,定量PCR仪器由美国ABI公司生产。
2 实验方法
2.1 南方红豆杉水提物制备 取13袋南方红豆杉(8g/袋)置于医用不锈钢锅中,冷水中充分浸泡过夜,置入控温电炉,第一遍时加入药物7倍量的冷水煮沸20min,煮沸后倒出药液,第二遍时加入药物5倍量的煮沸20min,倒出药液,合并两次煎液,旋转蒸发仪浓缩至终浓度为208mg(生药量)/mL,静置过夜后用滤网过滤药渣,将过滤液作为高剂量母液,按照1:2和1:4体积分别稀释为中剂量104mg(生药量)/mL和低剂量52mg(生药量)/mL,药物保存在4℃冷藏冰柜。
2.2 赫赛汀溶液制备 用20mL灭菌注射用水配制成无色至淡黄色的透明液体作为母液,母液浓度为21mg/mL,4℃冰箱保存。
2.3 细胞培养 用含有10%胎牛血清的RMPI-1640培养液,在37℃、5%CO2、饱和湿度条件培养箱内培养,1~2天更换1次培养液,待细胞长满培养瓶后,加2mL 0.25%胰酶-EDTA消化,置于培养箱10~15min,待细胞全部脱落加培养基终止消化,将细胞悬液移至离心管,800rpm离心5min,弃上清液,重悬于细胞培养液中按1:2比例进行传代,每3~5天传代1次。
2.4 建立模型、分组给药 取1×107个/mL的NCIN87单细胞悬液接种裸鼠右侧腋窝下,接种后第七天观察瘤体情况并将80只BALB/c裸鼠采用随机数字表法随机分为对照组、红豆杉高剂量组、红豆杉中剂量组、红豆杉低剂量组、赫赛汀(Herceptin)联合红豆杉(高、中、低)剂量组,Herceptin单药组,共8组,每组10只。实验中共有4只裸鼠死亡,从相应组别中剔除。根据《中药药理研究方法学》计算,红豆杉低、中、高剂量分别为:成人剂量的 5 倍(0.520g·kg-1·d-1),成人剂量的 10 倍(1.040g·kg-1·d-1),成人剂量的20 倍(2.080g·kg-1·d-1),灌胃,共给药 3 周。根据前期实验及参考文献[3],Herceptin组首剂按40mg/kg腹腔注射给药,每7天1次,后2次按20mg/kg给药,共给药3次。联合组同时灌胃给药,每次3mL,共给药3周。接种后第28天取瘤用于检测。
2.5 Western Blot检测蛋白表达 取适量瘤组织加入RIPA裂解液(含PMSF),进行匀浆再置于冰上。裂解30min后进行4℃下12000r/min离心5min,提取蛋白。用BCA法进行蛋白浓度测定,等量上样;然后进行SDS-PAGE电泳;最后用Quantity one图像分析软件进行灰度值分析。
2.6 实时荧光定量PCR检测基因表达 取移植瘤组织约50mg进行组织总RNA提取和纯化,进行RNA浓度测定,OD260/OD280为1.8~2.2之间。引物设计及合成由上海生工公司提供。PI3K(p110α)mRNA上游引物序列为:5’-ACACCACGGTTTGGAC TATGG-3’,下游引物序列为:5’-GGCTACAGTAGT GGGCTTGG-3’,AKT1 mRNA 上游引物为:5’-ATGAACGACGTAGCCATTGTG-3’,下游引物为:5’-TT GTAGCCAATAAAGGTGCCAT-3’,mTOR mRNA 上游引物为:5’-ACCGGCACACATTTGAAGAAG-3’,下游引物为:5’-CTCGTTGAGGATCAGCAAGG-3’。
各组裸鼠移植瘤组织总RNA提取和cDNA合成按试剂说明书操作。使用ABI荧光定量PCR仪器进行,每个样品取2μL作为模板。反应体系:上下游引物各 0.4μL,DNA 样品 2μL,ddH2O6.8μL,SYBR Premix Ex TapTM10.0μL。PCR循环结束后,样品加热到95℃马上降至60℃并保持15s,然后按照1.75℃·s-1递增到95℃,在升温时收集荧光信号,建立熔解曲线。
2.7 统计学方法 应用SPSS22.0统计分析软件进行处理,数据均以平均数±标准差(±s) 表示,多组间比较采用单因素方差分析(One-way analysis of variance,ANOVA),方差齐性采用 LSD 法,P<0.05 为差异有统计学意义。
3 实验结果
3.1 Western Blot检测各组瘤组织 PI3K、pAKT、mTOR蛋白表达 应用Quantity one软件分析并与β-actin灰度值比值显示结果(见表1、插页图1)。与对照组比较(插页图1-1),红豆杉中、低剂量组PI3K蛋白相对表达量均极显著降低(P<0.01);与赫赛汀组(Herceptin)比较,红豆杉中剂量联合赫赛汀组PI3K蛋白相对表达量显著降低(P<0.05);红豆杉中剂量联合赫赛汀组PI3K蛋白相对表达量较红豆杉高、低剂量联合组显著降低(P<0.05)。与对照组比较(插页图1-2),红豆杉单药组pAKT蛋白表达相对量差异无统计学意义(P>0.05);红豆杉高剂量组较红豆杉中、低剂量组pAKT蛋白表达相对量显著降低(P<0.05);与对照组比较,红豆杉联合赫赛汀组pAKT 蛋白相对表达量均显著降低(P<0.05,P<0.01),红豆杉联合组组间差异不显著(P>0.05)。与对照组比较(插页图1-3),红豆杉各组mTOR蛋白表达显著下调(P<0.05,P<0.01);红豆杉单药各组红豆杉高、低剂量组mTOR蛋白表达显著降低(P<0.05);与对照组比较,红豆杉各剂量联合赫赛汀组及赫赛汀组mTOR蛋白表达极显著降低(P<0.01)。与赫赛汀组比较,红豆杉高剂量联合赫赛汀组OTOR蛋白表达量显著降低(P<0.05),红豆杉联合赫赛汀各组间差异不显著(P>0.05)。
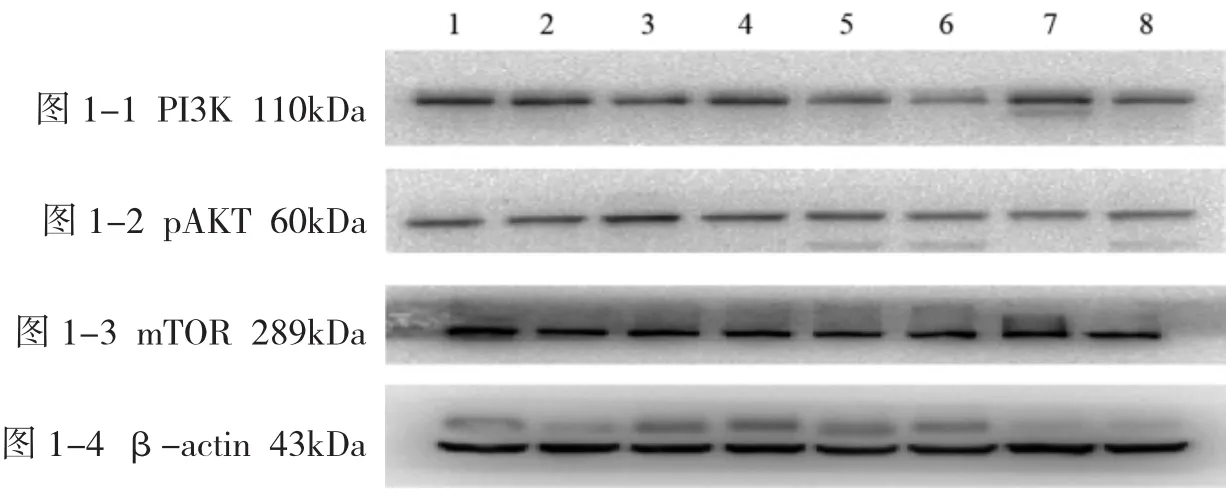
图1 各实验组PI3K、pAKT、mTOR蛋白表达
图2-1 PI3K mRNA扩增曲线图
图2-3 AKT1 mRNA扩增曲线图

图2-5 mTOR mRNA扩增曲线图

图2-2 PI3K mRNA溶解曲线图

图2-4 AKT1 mRNA溶解曲线图图2 各组PI3K、APT1、mTOR mRNA表达

图2-6 mTOR mRNA溶解曲线图
3.2 实时荧光定量PCR法检测各组瘤组织PI3K、AKT1、mTOR mRNA表达 结果显示,与对照组比较,红豆杉低剂量组PI3K mRNA表达降低(P<0.05),红豆杉联合组及赫赛汀组PI3K mRNA表达显著降低(P均<0.01)。与赫赛汀组比较,红豆杉高、中、低剂量联合赫赛汀组PI3K mRNA表达显著降低(P<0.01或P<0.05),与对照组比较,红豆杉单药组AKT1 mRNA表达差异无统计学意义(P>0.05);红豆杉高、中剂量组AKT1 mRNA表达较红豆杉低剂量组显著降低(P<0.05);红豆杉高、中、低联合赫赛汀组 AKT1 mRNA表达显著降低(P<0.01)。与赫赛汀组比较,红豆杉联合赫赛汀各组AKT1 mRNA表达差异不显著(P>0.05);红豆杉联合组组间差异不显著(P>0.05)。与对照组比较,红豆杉中、低剂量组mTOR mRNA 表达显著降低(P<0.05),红豆杉联合赫赛汀各剂量组及赫赛汀组mTOR mRNA表达显著降低(P<0.01)。与赫赛汀组比较,红豆杉联合赫赛汀各组差异无统计学意义(P>0.05)。见表 2。

表1 各组瘤组织PI3K、pAKT、mTOR蛋白表达量比较(x±s)
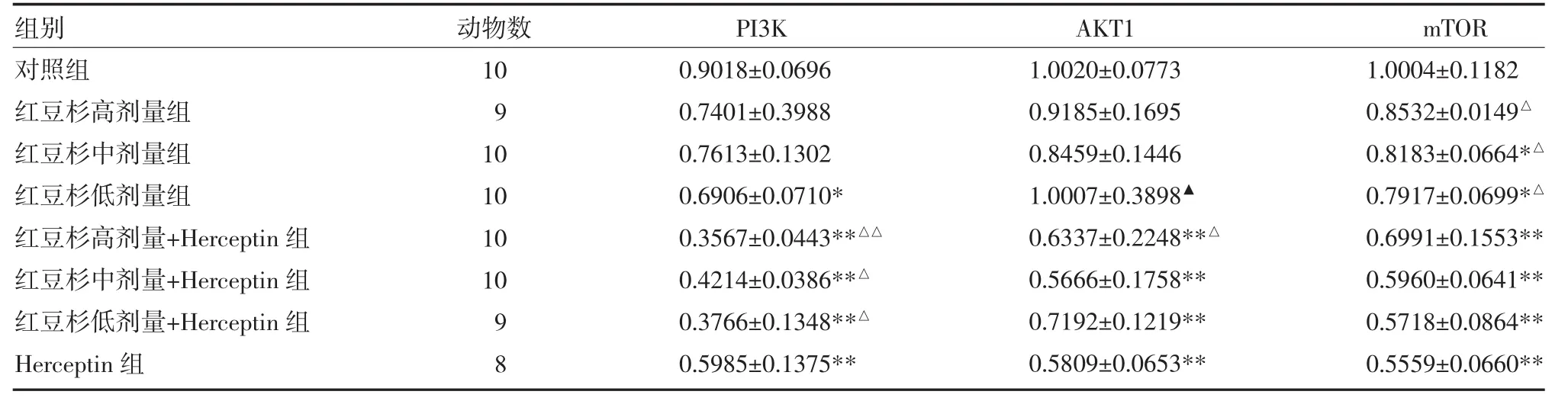
表2 各组瘤组织PI3K、AKT1、mTOR mRNA表达量比较(x±s)
4 讨论
HER2属于表皮生长因子受体(EGFR)家族,是一种原癌基因,与多种恶性肿瘤的发生发展及预后有密切联系[4]。其中曲妥珠单抗是重组的人源化抗HER2的单克隆抗体,通过抑制HER2参与的信号传导[5-6],发挥抑制肿瘤细胞生长的作用,并且可以在HER2高表达的NCI-N87胃癌细胞内诱发抗体依赖性细胞介导的细胞毒作用(ADCC)效应而杀伤靶细胞[7-8],从而增强抗肿瘤活性。PI3K/AKT/mTOR信号通路激活可受HER2调控,HER2通过活化PI3K,催化第二信使 3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol 3,4,5-triphosphate,PIP3),在 PDK1和mTORC2作用下激活下游的AKT,调节细胞抗凋亡[9-10]。活化的AKT进一步激活下游因子,如mTOR,调节细胞周期、凋亡和新生血管生成。AKT的三个亚型有80%以上的氨基酸序列同源性,相似的结构,存在共同结构特征于三个不同的功能区域,三个亚型均参与下游底物的活化[11],其中AKT1促进细胞存活和增殖并在,并在肿瘤的发生、细胞生长、增殖过程中起重要作用。PI3K/AKT/mTOR信号通路的阻断,可以通过抑制此信号通路上的各个靶点,例如siRNA靶向阻断I型PI3K,从而阻断PI3K信号通路,导致肿瘤细胞的凋亡[12]。另外,通过抑制AKT的激活,从而进一步抑制下游信号靶点的激活导致信号通路的阻断[13-14],抑制肿瘤细胞的增殖。
本实验结果表明,不同剂量南方红豆杉水提物能部分下调PI3K、pAKT、mTOR表达,中、低剂量组下调PI3K、mTOR表达较高剂量组明显,高剂量组下调pAKT较中、低剂量组明显,起到抑制PI3K/AKT/mTOR信号通路,从而抑制肿瘤的生长,但不同剂量南方红豆杉水提物对相同靶点的作用结果存在着差异,且红豆杉联合赫赛汀后较红豆杉单药组下调各靶点的表达更显著,这些差异提示虽然部分抑制了此信号通路的激活,HER2阳性胃癌仍可以通过其他信号通路起到增殖作用。从而得出南方红豆杉水提物能通过调控PI3K/AKT/mTOR信号通路抑制HER2阳性胃癌移植瘤生长,也可能存在作用于除PI3K/AKT/mTOR信号通路外其他旁路或下游通路等从而抑制HER2阳性胃癌的发展。

