豌豆-根瘤菌共生体对盐分胁迫的生理响应
徐勃,马绍英,张绪成,李胜,,柴强
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学基础教学实验中心,甘肃 兰州 730070;3.甘肃省农业科学院旱地农业研究所,甘肃 兰州 730070;4.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070)
土壤盐渍化是影响生态环境的严重问题,是造成世界农作物减产的主要原因之一[1-2].据统计,全球盐渍土约 9.55× 108 hm2,中国约有3.69×107 hm2盐渍土[3].盐分胁迫下植物的生长发育受到抑制[4-5],光合作用减弱,细胞内活性氧大量积累,导致细胞损伤,甚至死亡[6-8].豌豆(Pisumsativum)属豆科、豌豆属,具有较全面而均衡的营养,是重要的豆科小杂粮作物[9],中国是世界上第三大豌豆生产国和第二大青豌豆生产国.近年来,由于不合理灌溉和水资源匮乏等环境问题使土壤盐渍化加重,豌豆等作物的产量受到了严重影响.因此寻求增强植物抵御盐胁迫的适宜方法对于豌豆稳产高产显得尤为重要.利用生物技术改善环境对作物生长发育的影响被人们寄予厚望,寻找提高植物耐盐性的途径和方法,就需要研究和掌握植物的耐盐机理,这对进一步加强盐渍土的治理和综合开发利用具有重大意义.
众所周知,根瘤菌(Rhizobium)作为一种细菌微生物,可与豆科植物共生形成共生固氮体系,将大气中的无机氮转化为植物可以吸收利用的有机氮,为宿主豆科作物提供更多氮素[10].此外,有研究表明接种根瘤菌可提高豆科作物对逆境的抵御能力,根瘤菌和植物形成的共生体在逆境下具有更强的膜稳定性、活性氧干旱防御以及渗透调节能力[11-12].然而目前关于豌豆-根瘤菌共生体系响应盐胁迫的报道尚少.本文以豌豆为试验材料,通过接种3种根瘤菌,研究外源根瘤菌对豌豆响应盐胁迫影响的生理机制,旨在为利用根瘤菌提高作物耐盐性提供理论依据.
1 材料与方法
1.1 试验材料
以定西市农科院提供的耐盐性较好的‘定豌8号’和甘肃省农科院提供的耐盐性较差的‘陇豌6号’豌豆种子作为试验材料.3种根瘤菌菌株分别是由甘肃农业大学草业学院提供的苜蓿根瘤菌Ca66和中国农业微生物菌种保藏管理中心提供的两种豌豆根瘤菌ACCC15657和ACCC15735.
1.2 根瘤菌的培养
将保藏的根瘤菌加入无菌水制成菌液接种于YMA固体培养基上进行活化扩增培养.活化两代后接种于YMA液体培养基中,置于180 r/min、28 ℃恒温摇床中培养.测定根瘤菌菌液的光密度值(D值),并将供试菌株的菌液D值调至于0.8.
1.3 盆栽试验
于2018年4月3日播种,播种前用无菌水浸泡豌豆种子5 h,移至光照培养箱中培养至发芽.挑选整齐一致的发芽种子浸泡于根瘤菌菌液中15 min,对照组浸泡于无菌水种15 min.播种于高35 cm,内径30 cm的试验用盆中,每盆播种25粒,每个处理3个重复.供试土壤取自黄土高原半干旱区的定西市安定区凤翔镇景家店村,上茬种植作物为小麦,土壤为黄绵土,过筛后自然风干,每盆装8 kg.
播种7 d后,参考刘新星[13]在豌豆盐胁迫研究的盐分胁迫浓度,设置对照组用蒸馏水浇灌,轻度胁迫组用35 mmol/L的NaCl溶液浇灌,重度胁迫组用105 mmol/L的NaCl溶液浇灌,土壤持水量保持在75%.试验播种后的第15天(幼苗期),第30天(花期),第45天(结荚期)收集植株材料,使用液氮速冻后储存在-80 ℃的低温冰箱中待测.
1.4 测定指标与方法
株高与鲜质量在植物样品采集时直接测量,株高采用精度为1 mm的直尺测定,鲜质量采用万分之一天平称量.SOD活性采用氮蓝四唑还原法测定,MDA含量采用硫代巴比妥酸法测定,脯氨酸含量采用酸性茚三酮显色法测定,可溶性糖含量采用蒽酮法测定,POD采用愈创木酚法测定[14].
1.5 数据处理
采用Excel 2007初步整理实验数据,用IBM SPSS Statistics 20进行单因素方差分析(ANOVA)和显著性检验,显著水平设定为α=0.05.
2 结果与分析
2.1 不同盐分胁迫对根瘤与豌豆共生植株株高的影响
‘定豌8号’的株高测定结果如表1所示,在轻度胁迫下,接菌ACCC15657豌豆株高在苗期显著低于CK1,接菌ACCC15735和Ca66株高在花期低于CK1,其他时期无显著差异;在重度胁迫下,接菌ACCC15657株高在花期和结荚期显著低于CK3,其他处理与CK3相比无显著差异.总体上接菌处理对于‘定豌8号’的株高影响较小.
‘陇豌6号’株高测定结果如表2所示.在轻度胁迫和重度胁迫下,接菌处理缓解了轻度胁迫和重度胁迫对3个时期豌豆株高的抑制.重度胁迫下,接种ACCC15657和Ca66的豌豆株高在结荚期优于CK3,接种ACCC15735的豌豆株高在苗期和花期优于CK3.
2.2 不同盐分胁迫对根瘤与豌豆共生植株地上部分鲜质量的影响
‘定豌8号’的鲜质量结果测定结果如表3所示,在轻度胁迫下,接菌ACCC15657株高在花期低于CK2,其他接菌豌豆的鲜质量和CK2相比无显著差异;在重度胁迫下,接菌ACCC15657鲜质量同样在花期低于CK3.总体上,接种根瘤菌对于‘定豌8号’的鲜质量影响较小.
‘陇豌6号’的鲜质量测定结果如表4所示,无胁迫下,接菌ACCC15735豌豆鲜质量在结荚期显著高于CK1;轻度胁迫下,接菌ACCC15735豌豆鲜质量在花期和结荚期均显著高于CK2;在重度胁迫下,接菌ACCC15735豌豆鲜质量在结荚期显著高于CK3.总体上,接菌ACCC15735提高了‘陇豌6号’植株鲜质量,其他2种根瘤菌无明显差异.
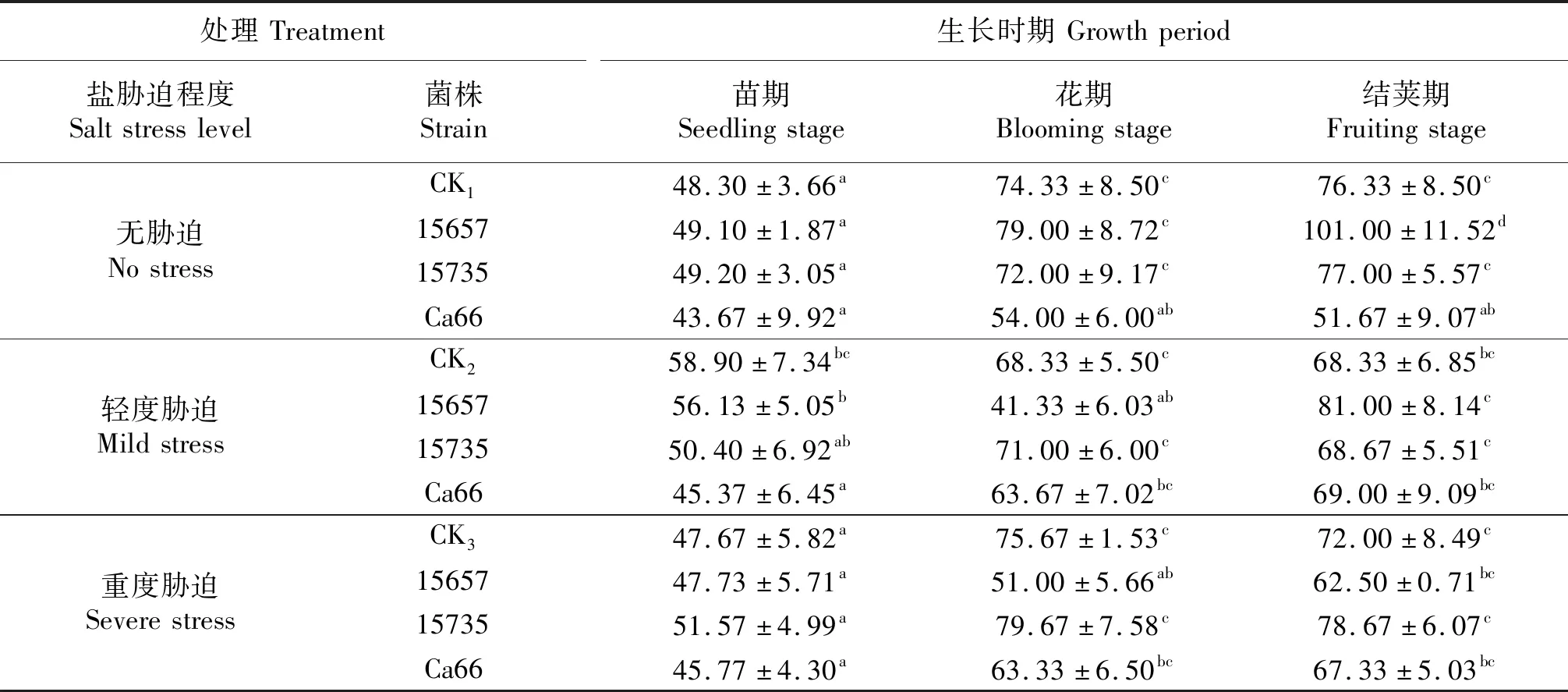
表1 ‘定豌8号’的株高
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables.
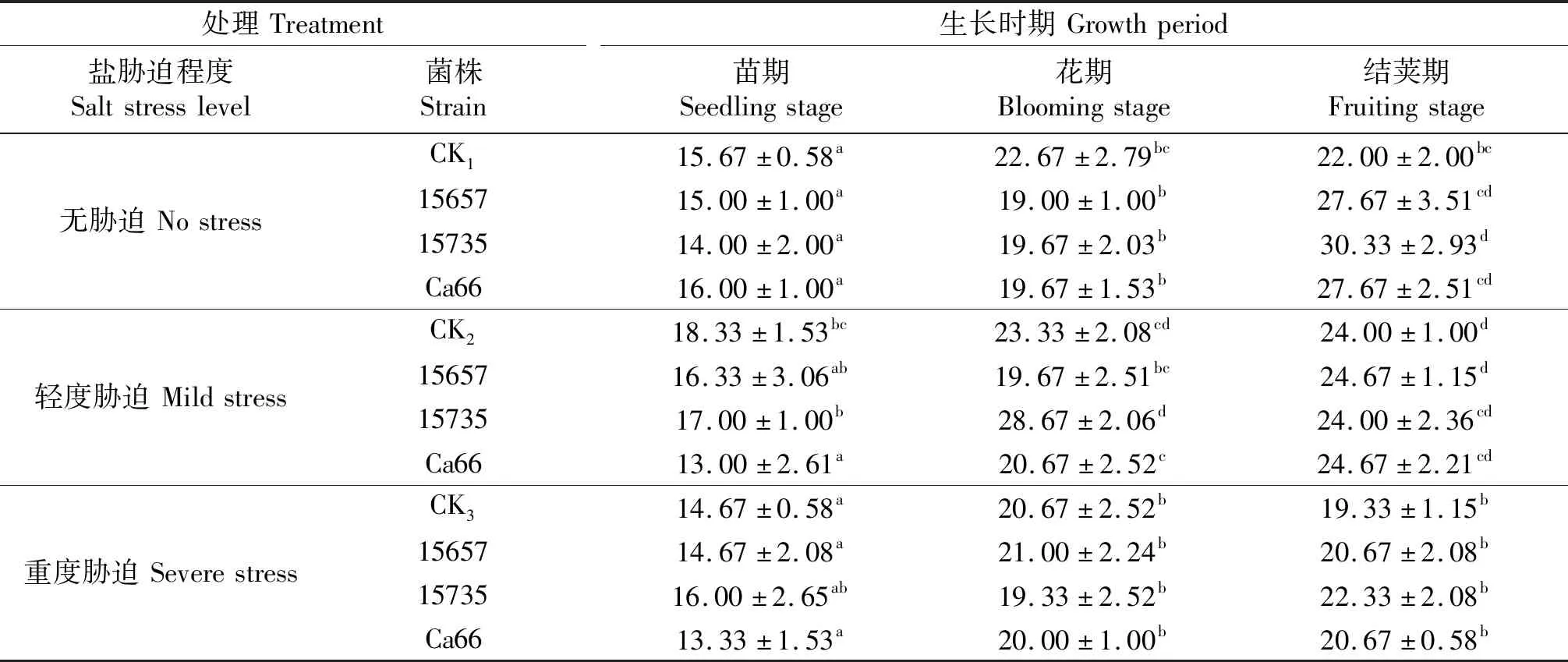
表2 ‘陇豌6号’的株高
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables.
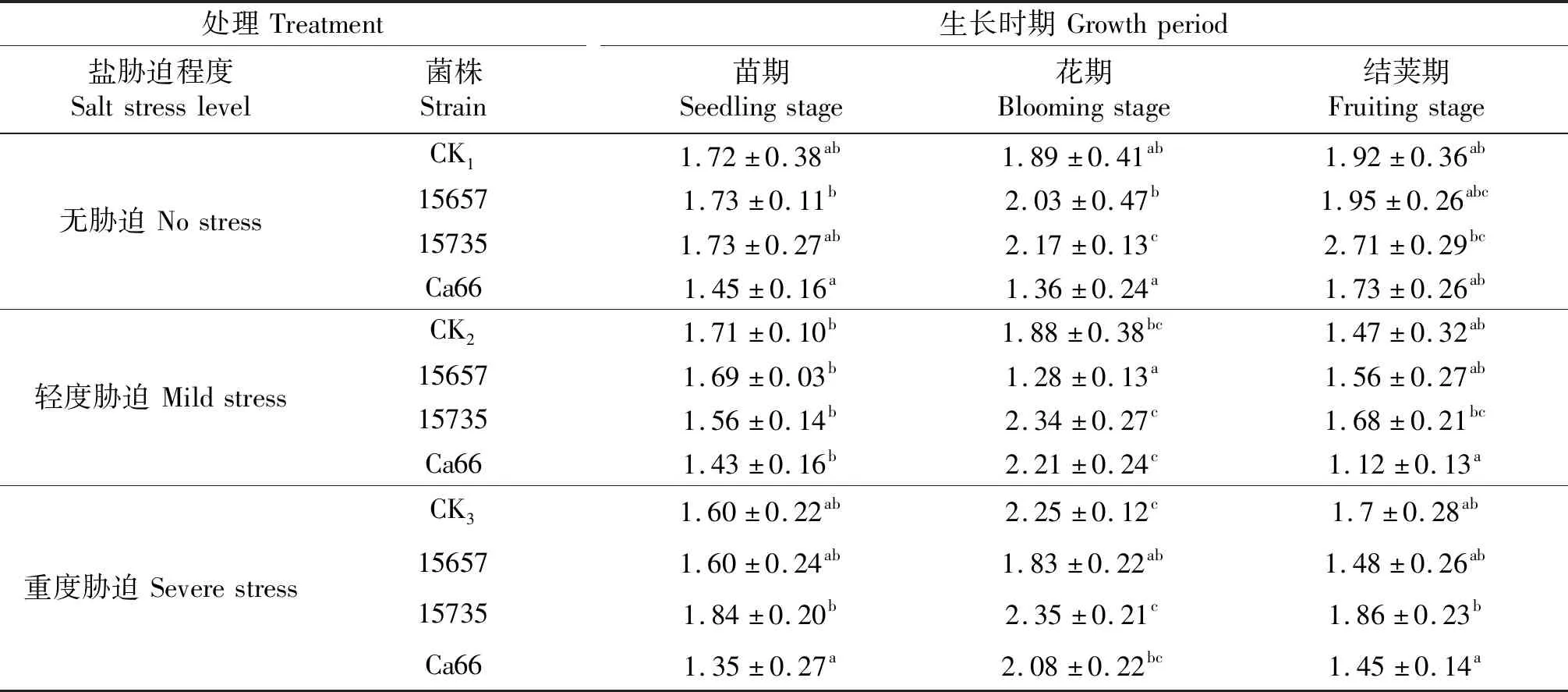
表3 ‘定豌8号’地上部分鲜质量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables.
2.3 不同盐分胁迫对根瘤与豌豆共生植株SOD活性的影响
SOD是植物体内重要的抗氧化酶,直接控制植物体超氧阴离子自由基 (O2-·) 和过氧化氢 (H2O2) 的浓度.在盐分胁迫下,植物的SOD活性先增强后降低[15].如表5所示,接种根瘤菌显著提高了‘定豌8号’SOD活性,接种豌豆根瘤菌ACCC15657和ACCC15735处理较对照组SOD活性变化大,苜蓿根瘤菌Ca66处理变化较小.轻度胁迫下,3个时期的SOD活性较CK2分别提高了116.59%、44.03%、28.16%;重度胁迫下,3个时期的SOD活性较CK3分别提高了80.80%、40.57%、66.30%.在3个接菌处理中,接种ACCC15735对SOD活性影响最大.接种ACCC15657对SOD活性的影响与ACCC15735相似,但提高程度较小.接种苜蓿根瘤菌Ca66对‘定豌8号’的SOD活性影响最小,而在苗期的轻度胁迫下SOD活性较CK2提高了53.63%.

表4 ‘陇豌6号’地上部分鲜质量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables..
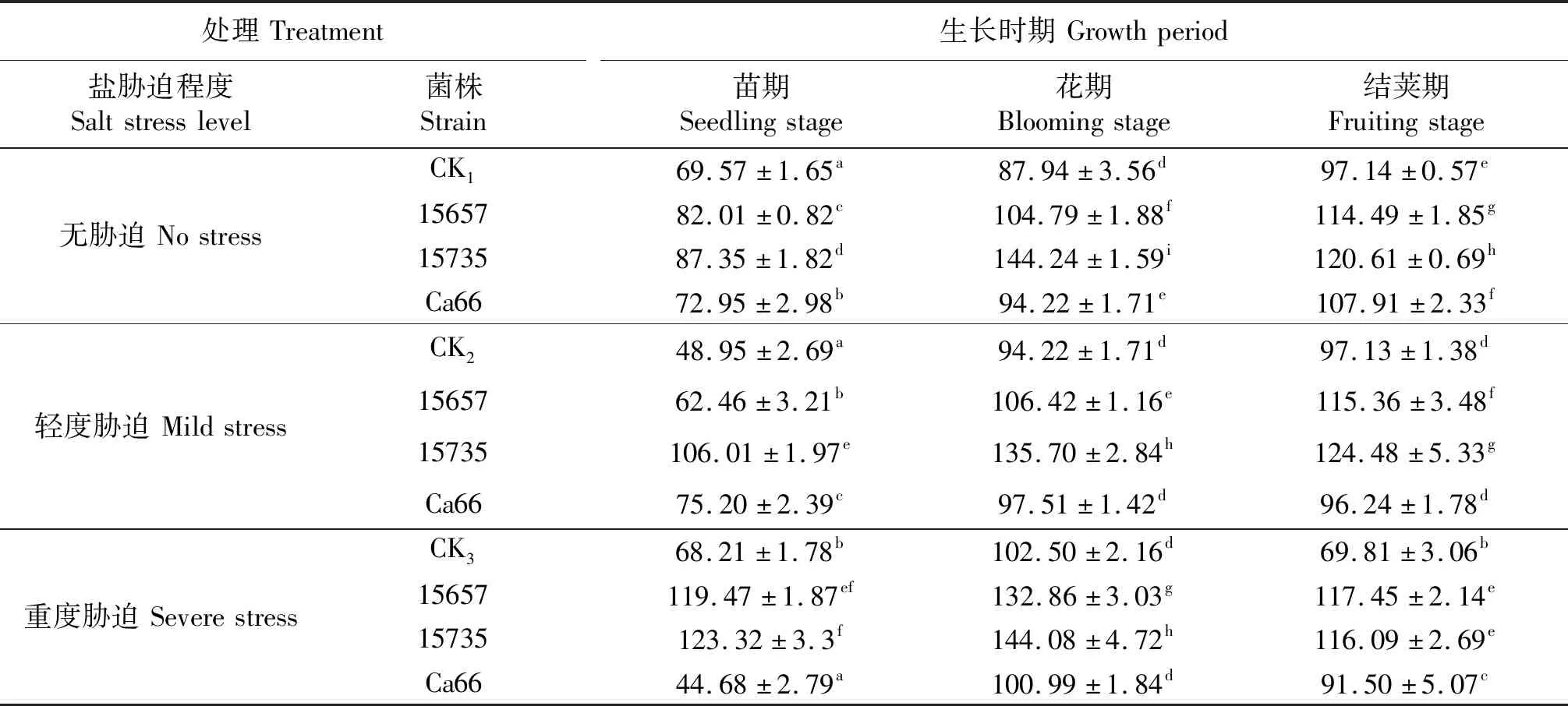
表5 ‘定豌8号’的SOD活性
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables.
‘陇豌6号’的SOD活性测定结果如表6所示,在轻度和重度胁迫下,接种ACCC15657和ACCC15735 可提高豌豆SOD活性.在无胁迫条件下,接种ACCC15735的豌豆SOD活性在3个时期较CK1分别提高了17.85%、31.08%、17.28%;轻度胁迫下3个时期较CK2分别提高了20.15%、32.34%、13.32%;重度胁迫下3个时期较CK3分别提高了35.39%、9.89%、25.53%.在轻度胁迫下,接种ACCC15657的豌豆SOD活性变化较其他接菌处理较为明显,3个时期较SOD活性较CK2分别提高了15.57%、12.51%、11.67%.在无胁迫下,接种Ca66豌豆SOD活性在结荚期较较CK1提高了23.34%.
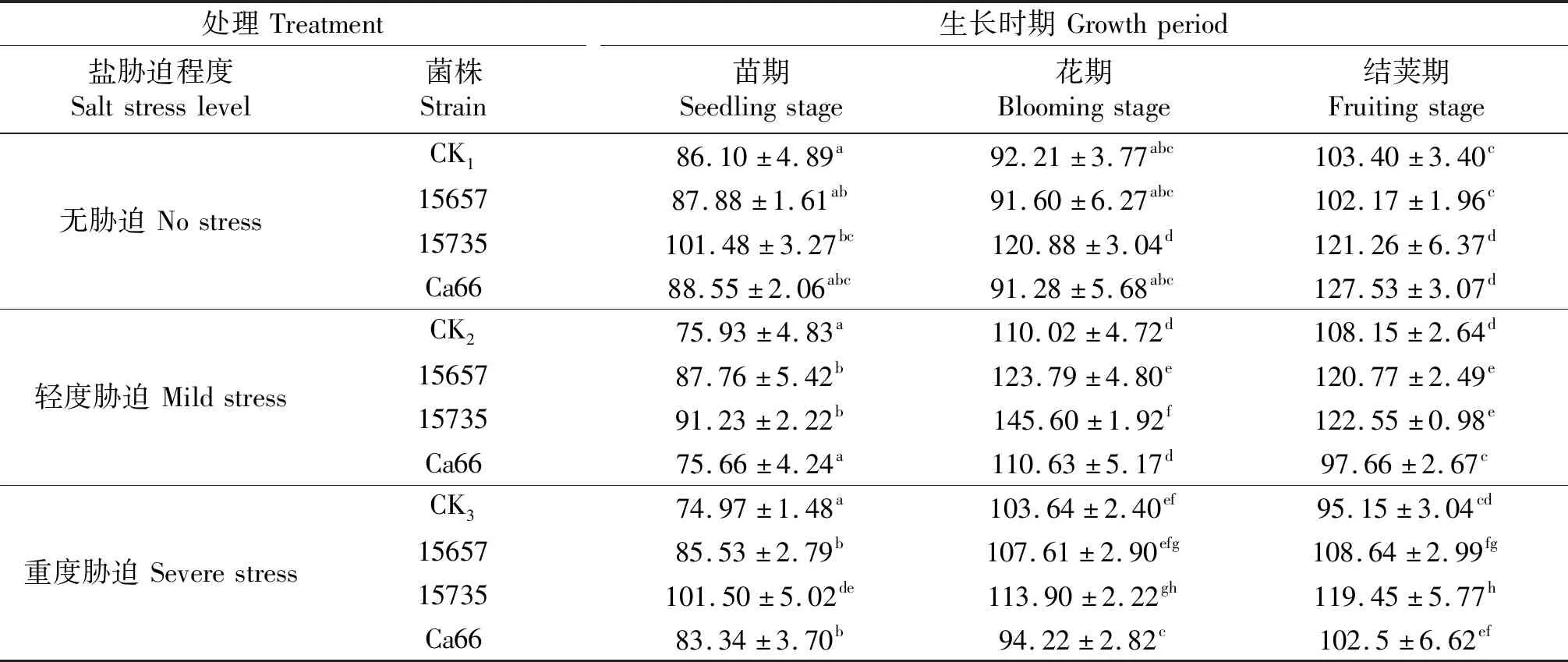
表6 ‘陇豌6号’的SOD活性
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables..
2.4 不同盐分胁迫对根瘤与豌豆共生植株POD活性的影响
‘定豌8号’POD活性测定结果如表7所示,轻度和重度盐胁迫下,3个时期‘定豌8号’的POD活性和CK1相比显著升高(P<0.05).在轻度胁迫下,接菌豌豆POD活性在苗期均小于CK2,在花期接种ACCC15657处理POD活性低于CK2,接种ACCC15735和Ca66豌豆POD活性显著高于CK2,结荚期接种ACCC15657处理的POD活性低于CK2,接种Ca66处理显著提高了POD活性;重度胁迫下,苗期接菌处理与CK3相比POD活性差异较小,花期接种ACCC15657和ACCC15735豌豆POD活性低于CK3,结荚期接种ACCC15657和ACCC15735豌豆POD活性显著高于CK3.
‘陇豌6号’的POD活性测定结果如表8所示,在无胁迫的情况下,苗期和花期CK1显著高于接种处理,结荚期CK1显著低于接种处理.在轻度胁迫下,苗期接种ACCC15735和Ca66豌豆的POD活性显著高于CK2,花期接菌ACCC15735豌豆的POD活性显著高于CK2;在重度胁迫下,苗期CK3组POD活性显著低于接菌处理,花期接种ACCC15735豌豆的POD活性低于CK3,接种Ca66豌豆的POD活性显著高于CK3(P<0.05),结荚期CK3组POD活性高于接种处理.
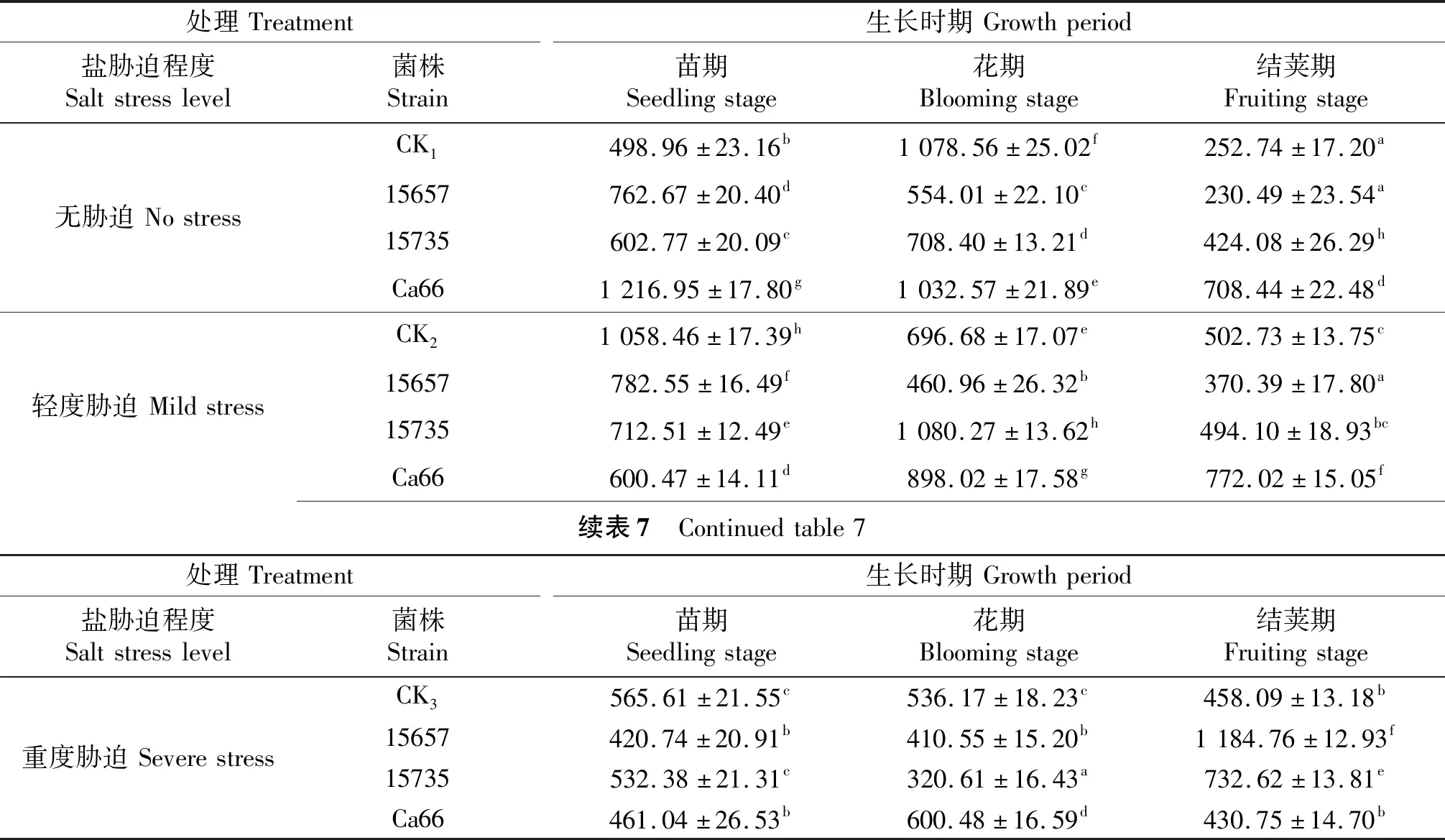
表7 ‘定豌8号’的POD活性
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables..
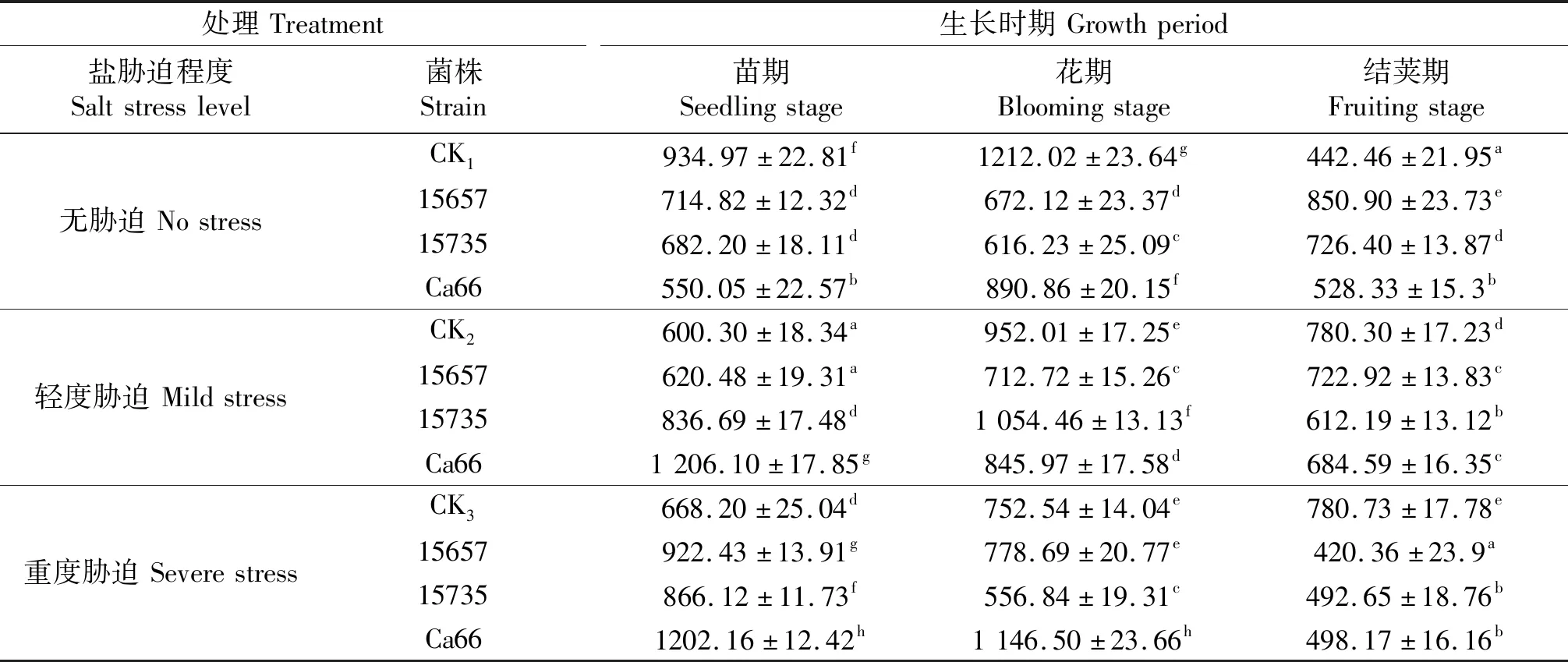
表8 ‘陇豌6号’的POD活性
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables..
2.5 不同盐分胁迫对根瘤与豌豆共生植株MDA含量的影响
MDA含量的高低是反应细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[16].在重度胁迫下,‘定豌8号’MDA含量和无胁迫相比显著提高.由表9可以看出,在轻度和重度盐分胁迫下,接种ACCC15657和ACCC15735豌豆和对照组相比MDA含量显著降低.在轻度胁迫下,接种ACCC15735豌豆的MDA含量在苗期和结荚期较CK2分别降低了48.33%和57.55%,在花期与CK2相比差异不显著;重度胁迫下接种ACCC15735豌豆的MDA含量在3个时期和CK3相比分别降低了62.77%、53.57%、61.04%.接种ACCC15657对MDA含量的影响表现出和ACCC15735相似的效应,其中变化最大的是重度胁迫下MDA含量在花期较CK3降低了60.35%.
如表10所示,轻度和重度胁迫下‘陇豌6号’MDA含量显著高于无胁迫处理.接菌处理显著降低了轻度和重度胁迫下3个时期豌豆的MDA含量.3个接菌处理中ACCC15657菌株在轻度胁迫下效应尤为显著,接种Ca66豌豆的MDA含量较CK2变化最小,接种ACCC15657‘陇豌6号’的MDA含量在3个时期较CK2分别降低了41.93%、44.91%、40.38%.

表9 ‘定豌8号’的MDA含量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column, different lower case letters mean significant difference by different treatments (P<0.05), CK1, CK2and CK3indicate without inoculation treatment under no stress, mild stress and severe salt stress, respectively, the same in the following tables.
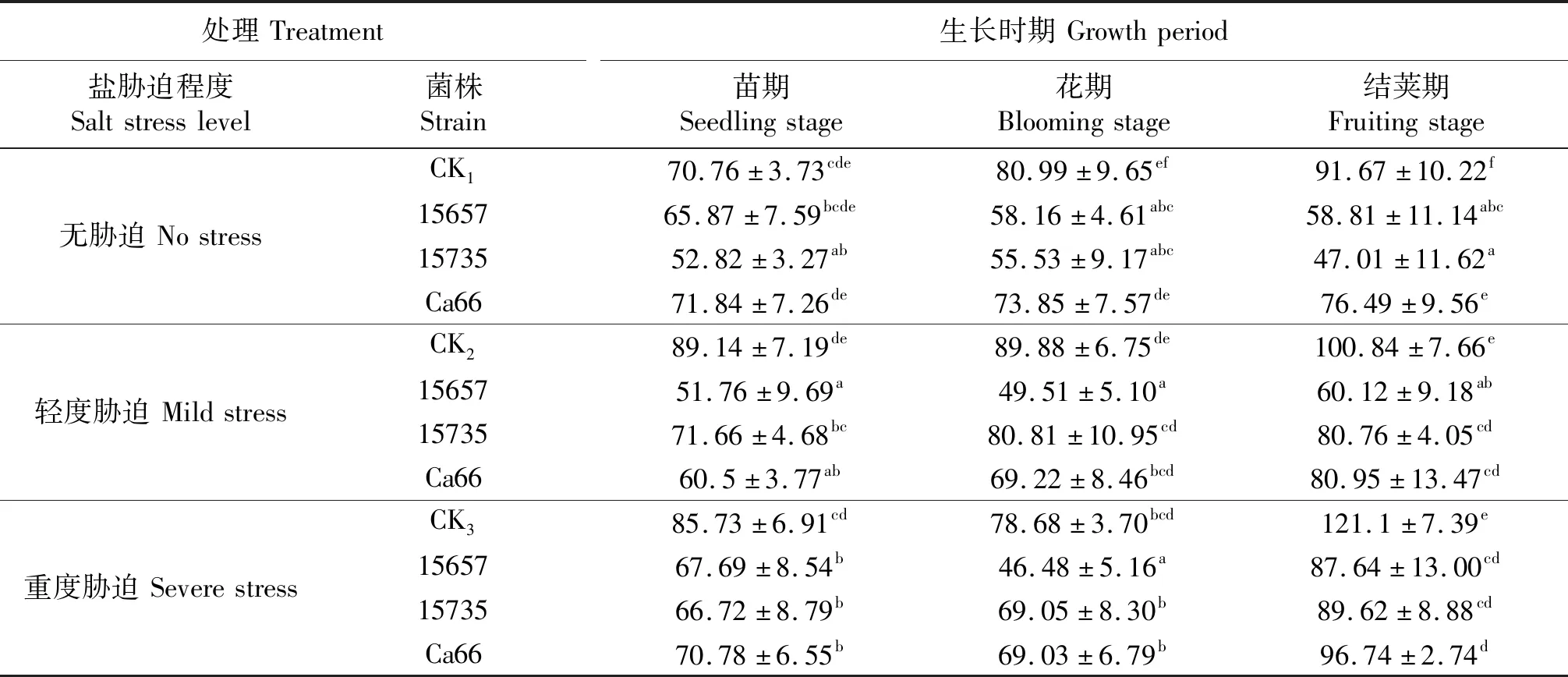
表10 ‘陇豌6号’的MDA含量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column,different lower case letters mean significant difference by different treatments (P<0.05), CK1,CK2and CK3indicate without inoculation treatment under no stress,mild stress and severe salt stress,respectively,the same in the following tables.
2.6 不同盐分胁迫对根瘤与豌豆共生植株脯氨酸含量的影响
脯氨酸积累是许多植物在不同环境胁迫下的一种代谢适应机制,在多数逆境条件下,脯氨酸积累对植物抗逆起积极作用[17].从表11可知,轻度和重度盐胁迫下‘定豌8号’脯氨酸含量较无胁迫处理显著提高.在轻度盐分胁迫下,接种ACCC15735处理豌豆的脯氨酸含量显著高于其他接菌处理,3个时期脯氨酸含量较CK2分别提高了21.71%、22.63%、18.55%;在重度盐分胁迫下,接种ACCC15735的处理脯氨酸含量在花期显著高于其他接菌处理,接种根瘤菌的3个处理在结荚期脯氨酸含量显著高于CK3,其中接种ACCC15735处理的豌豆脯氨酸含量最高.
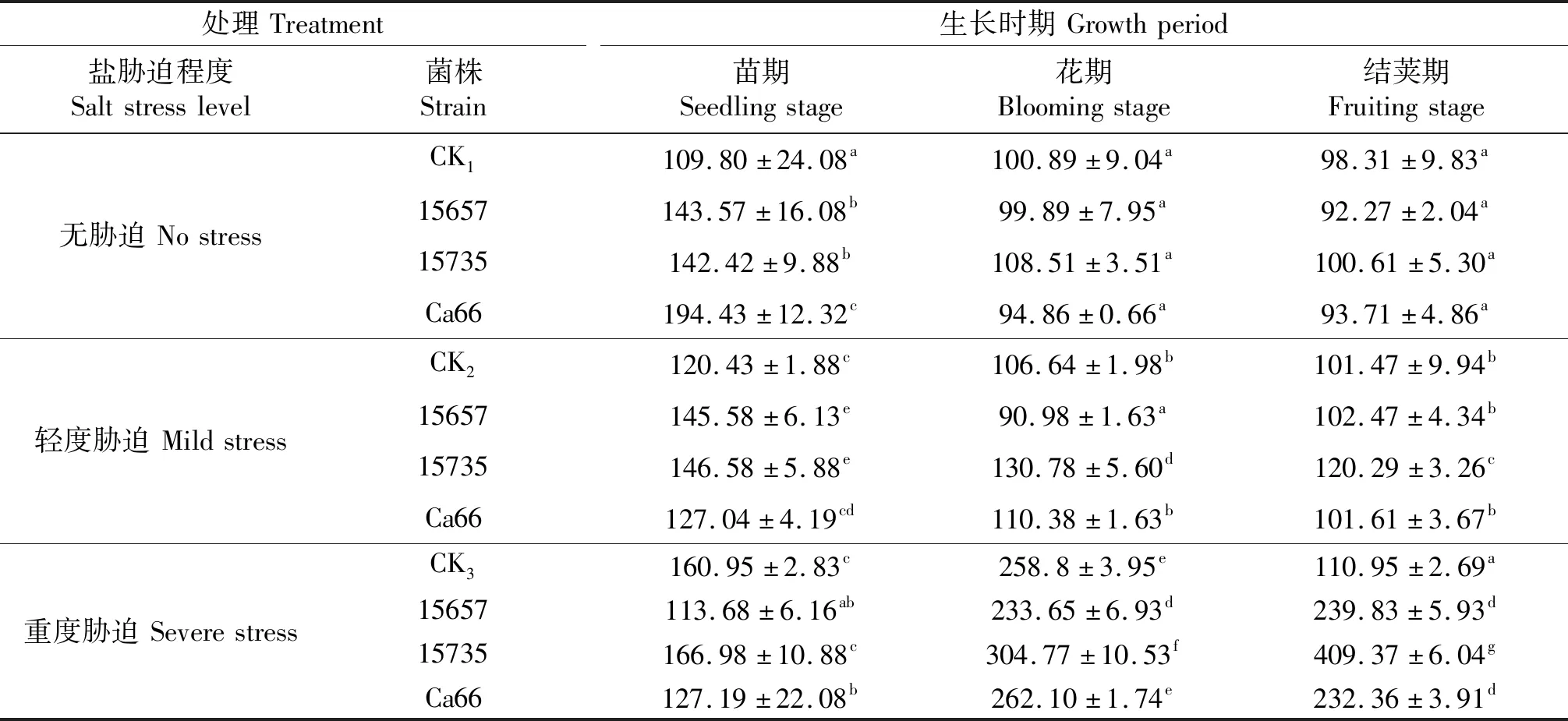
表11 ‘定豌8号’的脯氨酸含量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column,different lower case letters mean significant difference by different treatments (P<0.05), CK1,CK2and CK3indicate without inoculation treatment under no stress,mild stress and severe salt stress,respectively,the same in the following tables..
‘陇豌6号’的脯氨酸测定结果如表12所示,轻度和重度盐胁迫下‘陇豌6号’脯氨酸含量较无胁迫处理显著提高,接种3种根瘤菌豌豆的脯氨酸含量较不接菌处理显著提高.在轻度胁迫下,接种ACCC15735对脯氨酸含量的影响效应显著强于其它接菌处理,3个时期脯氨酸含量较CK2分别提高了45.21%、31.73%、47.91%.在重度胁迫下3个接菌处理对脯氨酸含量的提升效果相似.
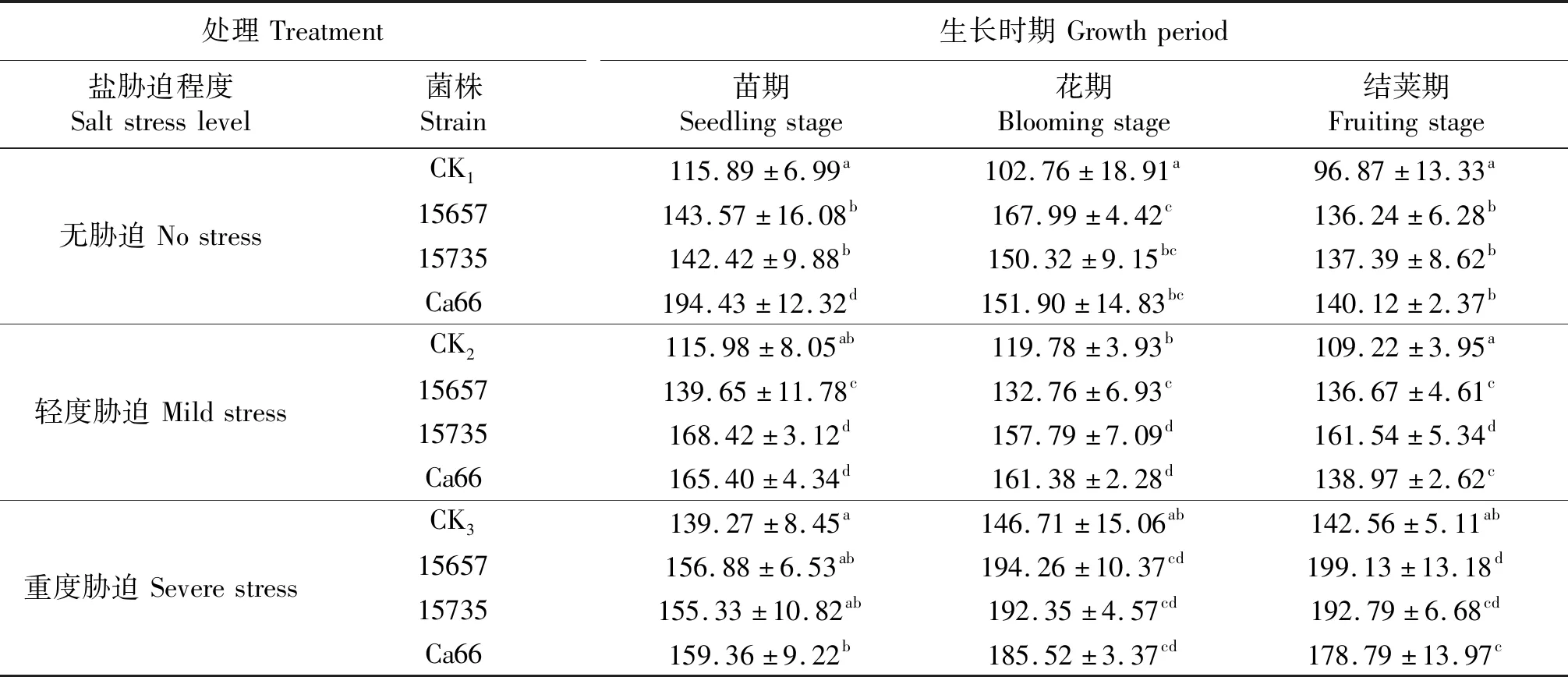
表12 ‘陇豌6号’的脯氨酸含量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column,different lower case letters mean significant difference by different treatments (P<0.05), CK1,CK2and CK3indicate without inoculation treatment under no stress,mild stress and severe salt stress,respectively,the same in the following tables..
2.7 不同盐分胁迫对根瘤与豌豆共生植株可溶性糖含量的影响
可溶性糖是植物应对渗透胁迫的主要渗透调节物质,维持植物的渗透平衡以保证植物的正常生理代谢[18].由表13可以看出,轻度和重度盐分胁迫下,接种根瘤菌的‘定豌8号’可溶性糖含量较对照显著提高,其中接种ACCC15735处理下增加最多,轻度胁迫下接种ACCC15735豌豆可溶性糖含量在3个时期较CK2分别提高了192.43%、132.93%、69.18%,重度胁迫下3个时期较CK3分别提高了67.79%、63.84%、40.62%.接种ACCC15657对可溶性糖含量的效应与ACCC15735相似,但影响程度较小.接种Ca66对‘定豌8号’的可溶性糖含量影响是3个接菌处理中最小的.

表13 ‘定豌8号’的可溶性糖含量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column,different lower case letters mean significant difference by different treatments (P<0.05), CK1,CK2and CK3indicate without inoculation treatment under no stress,mild stress and severe salt stress,respectively,the same in the following tables..
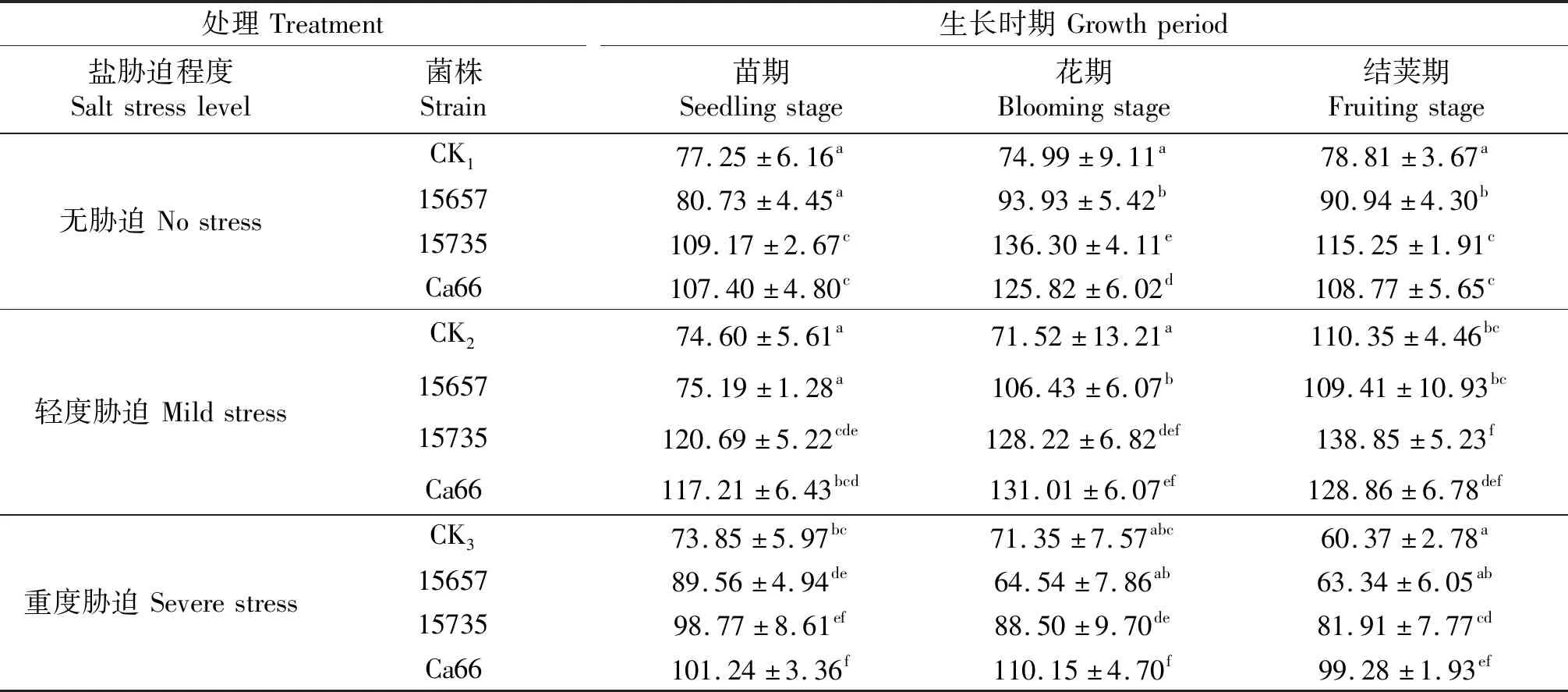
表14 ‘陇豌6号’的可溶性糖含量
同列不同小写字母表示同一时期各处理间差异显著(P<0.05),CK1,CK2和CK3分别表示无胁迫,轻度胁迫和重度盐胁迫下的不接菌处理.
In the same column,different lower case letters mean significant difference by different treatments (P<0.05), CK1,CK2and CK3indicate without inoculation treatment under no stress,mild stress and severe salt stress,respectively,the same in the following tables.
‘陇豌6号’的可溶性糖含量测定结果如表14所示,轻度和重度胁迫下,接菌处理显著提高了豌豆可溶性糖含量,相比不接菌处理差异显著.轻度胁迫下,接种ACCC15735和Ca66对豌豆可溶性糖含量的影响相比接菌ACCC15657效果显著.接种Ca66对‘陇豌6号’可溶性糖含量影响较大,在重度胁迫下效应最为突出,3个时期较CK3可溶性糖含量分别提高了37.10%、54.38%、64.45%.
3 讨论
在本试验中,接菌处理对豌豆植株的株高和鲜重影响较小,接种ACCC15735对‘陇豌6号’的鲜重影响较大,在3个生长时期均高于CK.当植物适应环境变化时,通过调整叶片形态、叶绿体色素组成和生化过程活性来缓解光系统氧化损伤[19].研究表明减弱光抑制的两个途径是叶黄素色素的热耗散和电子转移到除水以外的氧受体,后一种反应需要降低活性氧(ROS)水平的关键酶,如SOD、CAT和POD[20].本研究中,在盐胁迫下,接菌的两个品种豌豆的SOD活性较对照组提高,这表明接种根瘤菌可以降低盐分胁迫诱导的ROS.在盐分胁迫下,植物体内正常的ROS平衡被破坏,产生了大量的ROS,并加剧了膜脂过氧化作用,造成细胞膜系统的损伤.作为膜脂过氧化产物,MDA含量的变化是质膜损伤程度的重要标志之一.MDA在植物体内含量的高低,能够衡量植物细胞膜脂过氧化作用的强弱[21].植物中的MDA含量与其质膜透性呈正相关[22].本研究中盐胁迫下2个豌豆MDA含量变化也表出相似的规律.在盐胁迫下,接种根瘤菌豌豆MDA的含量相比不接菌显著降低,这表明接种根瘤菌对盐胁迫引起的氧化胁迫有缓解作用.此外,研究结果表明SOD活性较高时MDA含量较低,这表明接种根瘤菌处理提高了盐胁迫下豌豆的SOD活性和清除了植株体内过多的ROS.
大量研究表明,在非生物胁迫,如干旱、高盐、强紫外线照射、重金属、氧化应激以及生物胁迫下,高等植物脯氨酸含量增加[23-24].脯氨酸的渗透保护功能最早在细菌中发现,脯氨酸积累与耐盐之间存在因果关系.脯氨酸在植物中具有多种功能,可用于蛋白质合成,具有渗透保护作用,有助于维持氧化还原平衡,调节植物发育,是控制线粒体功能和缓解氧化胁迫损伤的重要组成部分[25].据报道,施加外源脯氨酸可增加植物的鲜重,增强光合速率,提高抗氧化酶活性[26].可溶性糖既是植物正常新陈代谢的合成材料和能源,也是植物的渗透调节物质之一[27].植物的可溶性糖含量随着土壤中盐浓度的增高而先上升后下降,盐浓度较高时植物出现可溶性糖下降的现象[28-29].脯氨酸与可溶性糖是植物重要的渗透调节物质,较高的脯氨酸和可溶性糖含量可以维持较高的渗透压,有利于植物在盐胁迫下吸收水分.本研究中,在无胁迫下,苗期3个接菌处理下‘定豌8号’的脯氨酸含量均高于对照组,花期与结荚期脯氨酸含量与对照组差异较小,在轻度和重度胁迫下,接种ACCC15735豌豆脯氨酸含量在各个时期均高于对照,而接种ACCC15735和Ca99豌豆的脯氨酸含量变化较小,这或许是由于菌株和豌豆品种间匹配性不同所致.在盐分胁迫下,接种根瘤菌的两个品种豌豆的脯氨酸与可溶性糖含量均高于不接菌豌豆,接菌处理有利于豌豆在盐分胁迫下吸收水分维持正常的生理代谢.
4 结论
接种根瘤菌对盐胁迫下2个豌豆株高影响较小,但接种ACCC15735对‘陇豌6号’鲜质量影响显著.接种根瘤菌增强了‘定豌8号’耐盐性,表现为SOD活性升高,MDA含量降低,脯氨酸和可溶性糖的含量增加.此外,POD活性变化与SOD相反,同一处理下SOD活性较大时,POD活性则较弱.接种根瘤菌对‘陇豌6号’和‘定豌8号’的影响相似,同样的接菌处理下‘定豌8号’表现出更好的效果.实验所用3个菌株中ACCC15735与2个品种豌豆的匹配性最好,在所测指标与对照组均有显著差异,苜蓿根瘤菌Ca66接种对测定指标的影响最小

