红芽直立茶紫色叶形成机制的转录组分析
刘 悦,曲 浩,李友勇,段志芬,杨盛美,尚卫琼,矣 兵,杨兴荣,孙雪梅,刘本英
(云南省农业科学院 茶叶研究所,云南省茶学重点实验室,云南 勐海 666201)
茶树(Camellia sinensis)是被子植物山茶科的成员,叶片用于生产多种茶叶[1]。茶是世界上最受欢迎的饮料之一,它含有许多次级代谢产物,使得茶叶具有丰富的味道,并且对人类健康有益处[2]。因为茶树的性状和应用非常多样化,得以在世界范围内广泛栽培[3]。在长期自然杂交和人工选择压力下,茶树芽叶的颜色变得非常丰富[4],是茶感官评价中的重要组成部分。中国具有丰富的茶树种质资源,除了常见的浓绿色芽叶以外,还有黄绿、红褐和紫褐色等其他颜色。红芽直立茶(Camellia assamica cv.Hongya zhili tea)是云南特有的茶树种质资源,原产于云南景谷,其典型特征为大叶,芽叶深紫红色,茎紫红色,花青素含量高。红芽直立茶和紫色芽、茎、叶的“紫鹃”相类似,但紫色的叶子不会随着叶片的生长和发育而逐渐变绿[5],可以一直保持紫色。这些茶树品种是生产具有特定颜色和风味的独特茶叶的宝贵材料,对未来整个茶业都是有利的。
植物叶片具有各种颜色是色素积累的综合结果,植物中普遍存在的色素包括叶绿素、类胡萝卜素和类黄酮[6]。花青素属于类黄酮化合物,到目前为止,已经在许多水果、蔬菜和花卉中发现了超过635种花青素[7],是植物科学中研究最多的化合物之一,其代谢途径已被多次描述。花青素衍生物中的飞燕草色素、牵牛花色素和锦葵色素是植物紫色和深色的来源,而矢车菊色素和天竺葵色素是鲜红色果实中的主要色素[8]。花青素不但可以使叶色发生变化,还可以导致生理生化过程的改变[4],例如增加植物的抗性。花青素可保护植物免受各种生物和非生物胁迫,包括冷胁迫[9]、盐胁迫[10]和低磷胁迫[11]。茶树紫色叶中的花青素具有多种与健康相关的生物功能,如作为抗氧化剂、抗菌剂[12]和降低血脂[13]。因此,紫芽茶树是茶树育种中的重要资源,目前已经选育出许多具有红紫色芽叶的茶树品种,例如“武夷奇种”[14]、“紫鹃”[5]和“紫燕”[15]。
尽管已经鉴定出了几种与花青素生物合成和调节有关的基因,但是对每种花青素生物合成途径调控的机制仍然不是很清楚。近年来,随着高通量测序技术的发展,使得利用大规模基因表达数据集对花青素生物合成及其调控基因的功能研究成为现实。RNA测序(RNA-Seq)的易用性和高效性有助于研究代谢物变异的机制,转录组学已成功应用于研究植物代谢机制[16]和基因在组织发育过程中的调控功能[6]。本研究中,我们在转录组水平上分析了同一株茶树上两种不同颜色叶片之间的差异表达基因及其功能,探索茶树紫色叶中花青素和类胡萝卜素的生物合成及其调控机制。研究结果增加了我们对茶树紫色叶中与色素积累相关的生物合成基因和相关调节因子的理解,对未来特色茶树品种的选育具有指导意义。
1 材料与方法
1.1 试验材料
本研究使用的实验材料为红芽直立茶的一芽三叶,采集于云南省农业科学院茶叶研究所国家种质大叶茶树资源圃(勐海)。在同一株茶树上分别采摘紫色和绿色的茶叶,用锡纸包好之后立即放入液氮速冻,-80℃冰箱保存。每种样品准备3个生物学重复。
1.2 建库测序
使用 TRIzol试剂(Invitrogen,Carlsbad,CA,USA)分别提取每个样品的总RNA。使用DNaseI处理检测合格后的总RNA,用带有Oligo(dT)的磁珠富集其中的mRNA,将mRNA打断后反转录为cDNA。使用Illumina TruSeq RNA样品制备试剂盒第2版(Illumina,San Diego,CA,USA)制备RNA-seq配对末端文库。使用Illumina HiSeq 4000测序平台完成测序,建库测序在北京诺禾致源生物信息科技有限公司完成。
1.3 新基因预测
使用cufflinks(2.2.1)软件组装新的转录本,再利用cuffmerge对多个样品的组装结果进行合并,并过滤可能为人工引入的组装错误的转录本生成唯一注释文件供后续差异分析使用。Cuffcompare将组装的转录本根据与参考文件在基因组上的位置关系分为十二类,其中classcode为u(未知的,基因间区的转录本)即认定为新基因。以Length>=200bp且exon number>=2作为可靠的新基因筛选条件,并对新基因进行功能注释。
1.4 基因表达与富集分析
首先对测序得到的原始数据进行过滤,去除含有接头和低质量的序列。使用Tophat 2(2.1.1)软件将clean reads比对到茶树的参考基因组[1]上,统计每个样品中每个基因比对到其位置上的read count数目,并计算其FPKM(Fragments Per Kilobase of transcript per Million mapped reads)值。使用edgeR软件分析紫色和绿色叶中的基因表达差异,然后使用R程序中的GOseq包对差异基因 (DEGs)进行GO富集分析,使用KOBAS(2.0)对DEGs进行Pathway富集分析,同时使用超几何分布检验的方法分析富集的显著性。
1.5 RT-qPCR验证
通过荧光定量PCR(RT-qPCR)对RNA-seq的结果进行验证,对每个颜色的三个生物学重复的样本都进行PCR,且每个样品都进行三次技术重复。使用Primer 5.0软件设计引物,通过TUREscript 1st Stand cDNA SYNTHESIS反转录试剂盒(艾德莱)和SYBR Green I进行qPCR反应,所使用的qPCR仪为qTOWER2.2型荧光定量PCR仪。通过茶树的肌动蛋白基因(actin)作为内参,使用2-ΔΔCt的方法计算每个基因的相对表达量。
2 结果和分析
2.1 转录组测序
为了解茶叶颜色多态性的分子基础,将紫色和绿色叶共6份样品(每个3个生物学重复)进行高通量测序。紫色叶转录组测序共得到141,279,238条高质量的数据,绿色叶共得到130,780,196条高质量的数据。高质量数据均超过6G,来自配对末端读数的Q20百分比(测序错误率<1%的序列百分比)均在98%以上,Q30都不低于94%(表1),说明各样品的测序数据质量好、可信度高,能满足后续数据分析的需求。测序得到的clean data上传至NCBI的SRA(Short Read Archive)数据库,获取号为SRP189546。
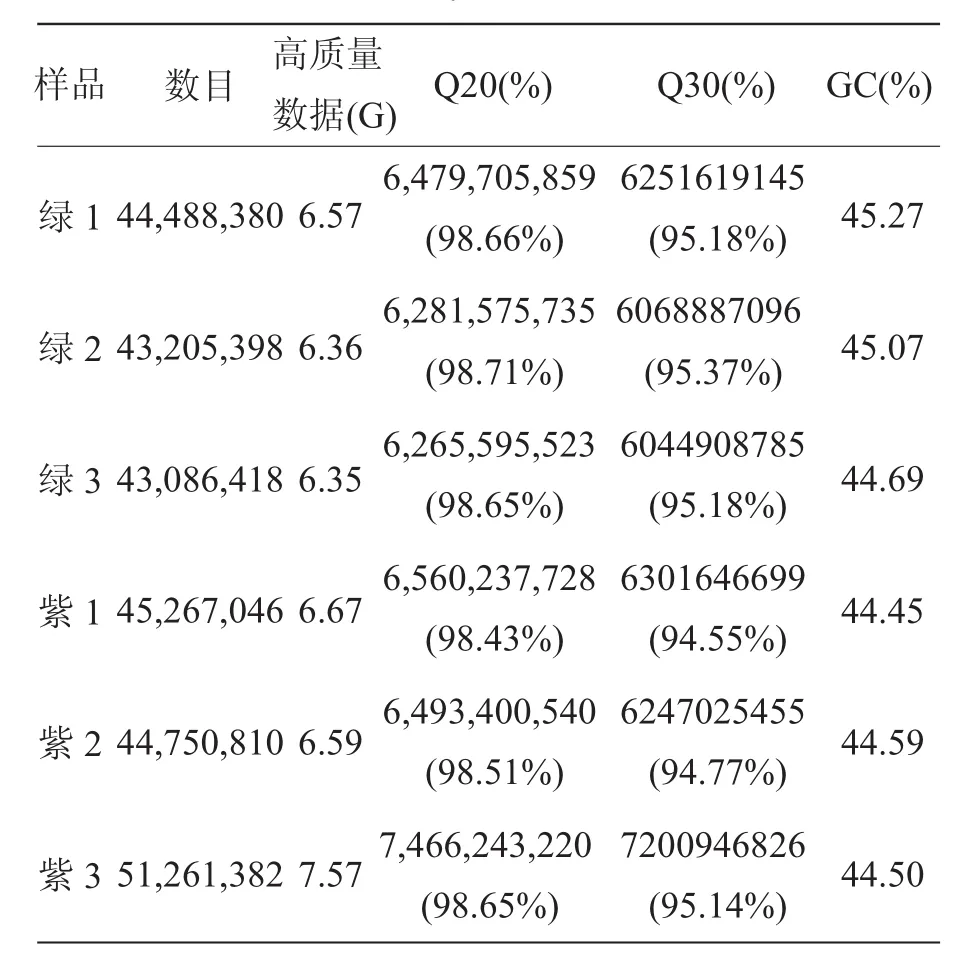
表1 测序数据质量统计Table 1 Quality statistics of cleandata
2.2 不同颜色茶叶差异表达基因
为了分析不同颜色茶叶中的差异基因,我们首先对所有基因进行定量。然后使用FDR<0.05且|log2FC|>1作为差异基因(DEG) 的筛选条件,以绿色叶为对照,在紫色叶中一共有8779个基因是差异表达的,其中有6936个基因上调,1843个基因下调(图1A)。分别从紫色和绿色的叶片中选取表达量最高的50个基因进行基因表达模式分析,从图1B中可以看出,这些基因的表达模式分为两种。紫色叶中的基因与绿色相比,大多数基因的表达量上调。基于标准基因名和同义词在差异基因的功能中进行搜索,分析与植物色素积累有关的三个代谢途径(类黄酮生物合成,花青素生物合成,黄酮和黄酮醇生物合成途径)的差异基因(表2)。
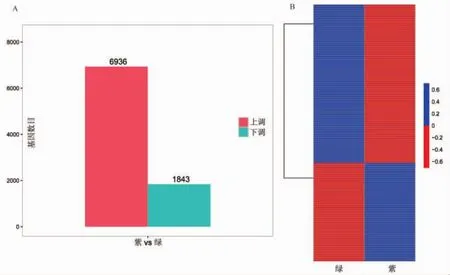
图1 紫色和绿色叶中差异表达的基因Fig.1 Differentially expressed genes in purple and green leaves
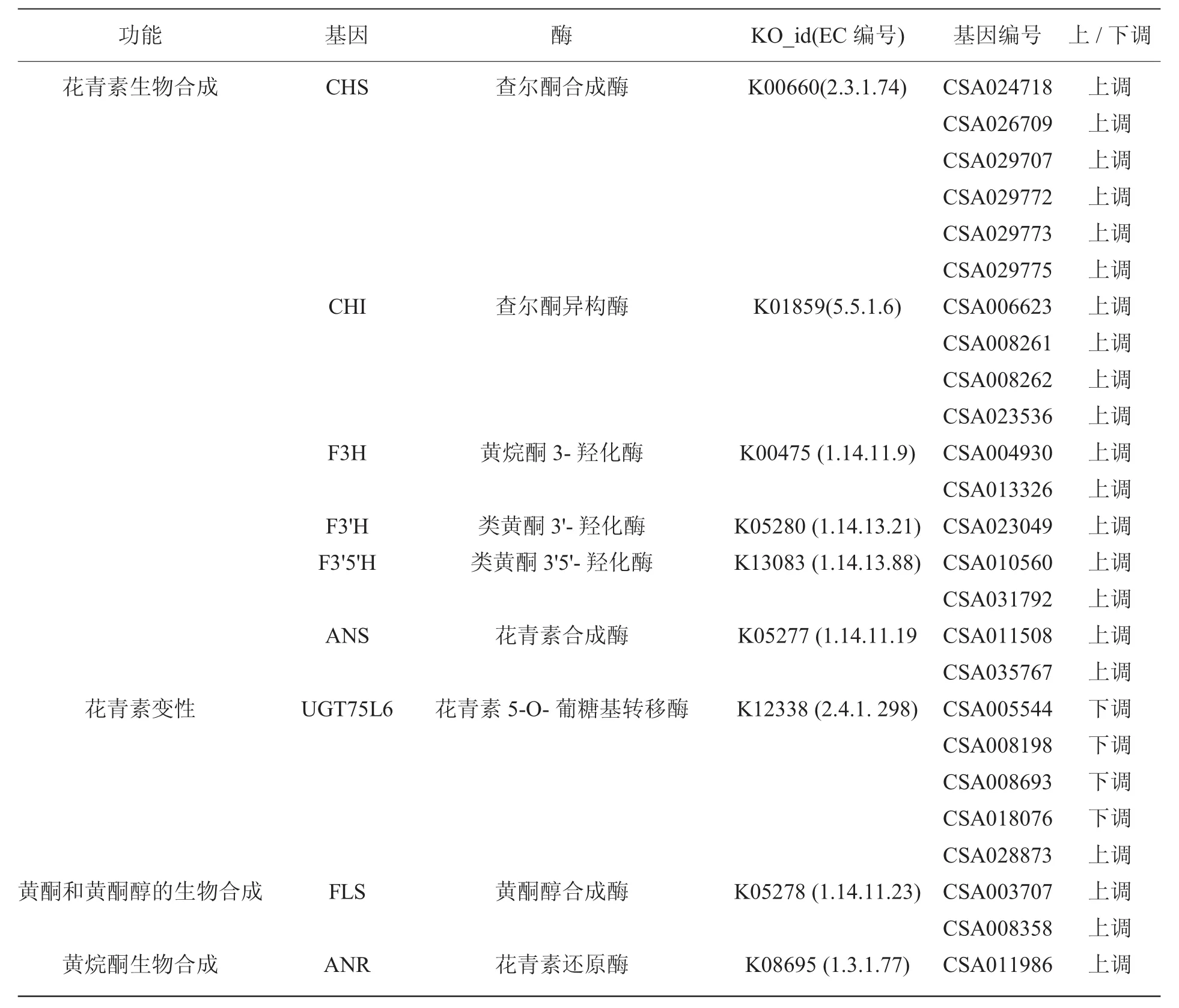
表2 与茶叶色素积累相关的候选基因Table 2 Candidate genes related to tea pigment accumulation
2.3 差异表达基因的功能富集
得到差异基因之后,对差异基因进行GO和KEGG Pathway富集分析。如图2所示,GO数据库把基因的本体分为三种:物过程(Biological Process,BP)、细胞组成(Cellular Component,CC)和分功能(Molecular Function,MF)。紫色叶与绿色叶比较,富集到差异基因数目最多的是分子功能,富集到差异基因数目最多的功能是结合与催化活性,其中尤其与糖基水解酶活性、葡萄糖苷酶活性和氧化还原酶活性相关的功能富集最显著(表3)。富集到生物过程的差异基因主要集中在细胞过程和代谢过程中,其中最显著富集的功能集中在细胞生长、碳水化合物代谢和激酶活性三方面。我们还注意到其中的GO:0043473、GO:0043476、GO:0043478、GO:0043479和GO:0043480五条term都属于组织中色素积累过程(表3)。
2.4 黄酮和花青素代谢对茶叶颜色的调控
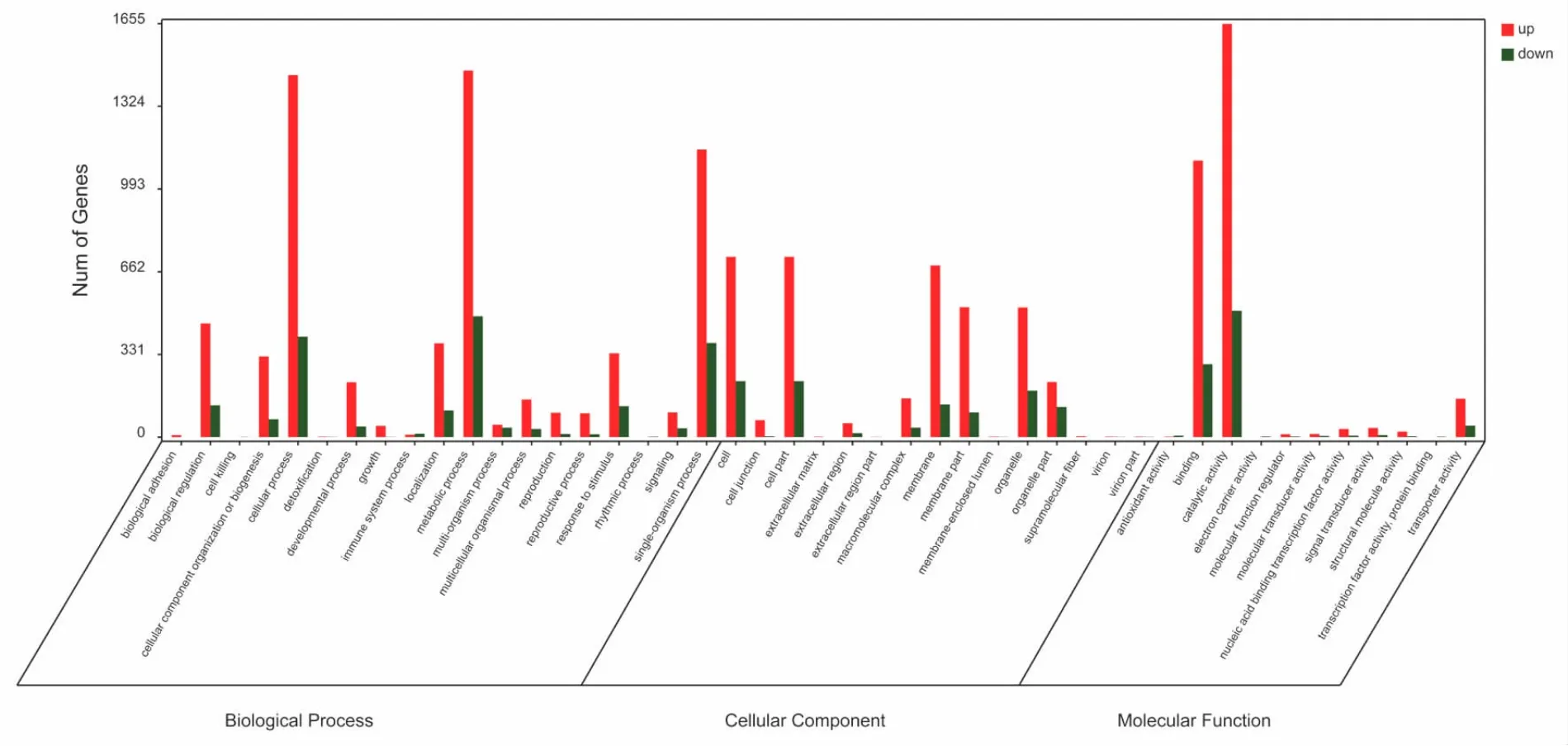
图2 差异基因GO功能二级分类统计Fig.2 Secondary classification statistics of GO function of differential gene
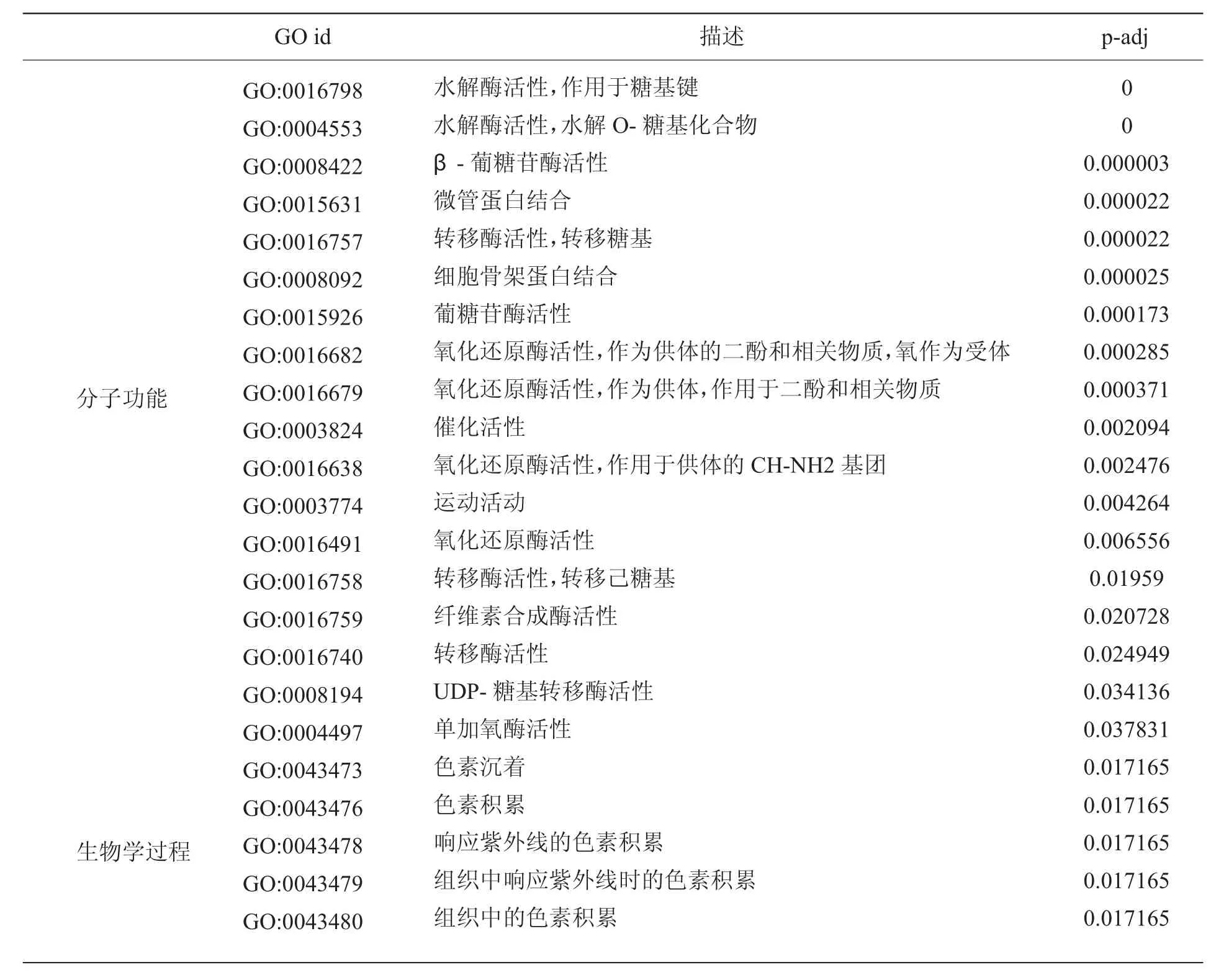
表3 显著富集的GO条目Table 3 GO items of significant enrichment
通过KEGG pathway富集分析,紫色叶与绿色叶相比,富集到的通路主要有氨基糖和核糖代谢、黄酮代谢、次级代谢产物生物合成,代谢途径,苯丙烷类生物合成、淀粉和蔗糖代谢(图3A)。以富集到的黄酮代谢和花青素合成途径为基础,结合文献构建花青素在茶叶中的合成路径(图3B),以期找出调控茶叶颜色变化的关键基因。对途径中的核心基因进行了详细分析,结果表明大多数基因的表达水平发生了显著变化,无论它们是早期基因(查尔酮异构酶CHS等)还是晚期基因 (花青素合酶ANS,葡糖基转移酶UFGT等),它们在紫色叶中的基因表达丰度均高于绿色叶(图3C)。这些化合物和花青素的生物合成共有的常见酶促步骤由查尔酮合成酶(CHS),黄烷酮3'-羟化酶(F3'H),类黄酮3'5'-羟化酶(F3'5'H)等催化。众所周知,CHS催化花青素生物合成的第一反应,并有助于形成中间体查尔酮,这是所有类黄酮的主要前体。二氢黄酮还原酶(DFR)催化二氢黄酮醇生成各种无色的花色素,是花青素合成过程中的关键酶,ANS催化无色花青素变成有颜色的花青素,UFGT使花色苷的结构更加稳定。在花青素生物合成过程中涉及的所有基因中,有6个CHS、1个DFR、2个F3'5'H和2个ANS基因在紫色叶中的表达量显著上调。通过甲基化、酰基化、羟基化与糖基化等方式对植物中的花青素碳骨架进行修饰,不同的修饰反应可以形成不同的花青素。花青素糖基转移酶(GT)决定了糖基的位置,在茶叶中主要是第3位糖基化的修饰酶UFGT(3GT),这也是共有的修饰步骤。与绿色叶相比,这也是花青素生物合成途径中唯一一个出现下调的基因,说明紫色叶中的花青素糖基化可能受到了抑制。
2.5 类胡萝卜素生物合成与茶叶红色和黄色色素的积累
类胡萝卜素在植物中具有重要的生物学意义,β-胡萝卜素在深色的植物中广泛存在。八氢番茄红素是植物中的第一个类胡萝卜素,经过八氢番茄红素脱氢酶(PDS)和ζ胡萝卜素脱氢酶 (ZDS)等酶经过多步反应催化脱氢后形成番茄红素。番茄红素经ε-环化酶(lcyE)作用形成δ-胡萝卜素,再经lcyB催化形成α-胡萝卜素。番茄红素还可以通过β-环化酶(lcyB)作用形成β-胡萝卜素,进而通过β-环羟化酶 (LUT5)催化形成β-隐黄质和玉米黄素,玉米黄素又在玉米黄素环氧化酶(ZEP)的催化下形成环氧玉米黄素和紫黄质(图4A)。在茶叶中发现许多编码类胡萝卜素生物合成的关键酶基因,如PDS和lcyB在紫色叶中都是下调的,而LUT5是上调的,九顺式环氧类胡萝卜素双加氧酶(NCED)的多个拷贝上调与下调现象均有存在 (图4)。PDS和lcyB基因在紫色叶中的下调表明番茄红素的合成受到抑制,LUT5的上调则说明β-胡萝卜素的分解加强了,可以推测紫色叶中含有较低的番茄红素和β-胡萝卜素。在紫色叶中下调的ZEP和NCED之间的平衡表明紫黄质的减少,这些变化说明紫色叶的变黄衰老过程得到减缓。
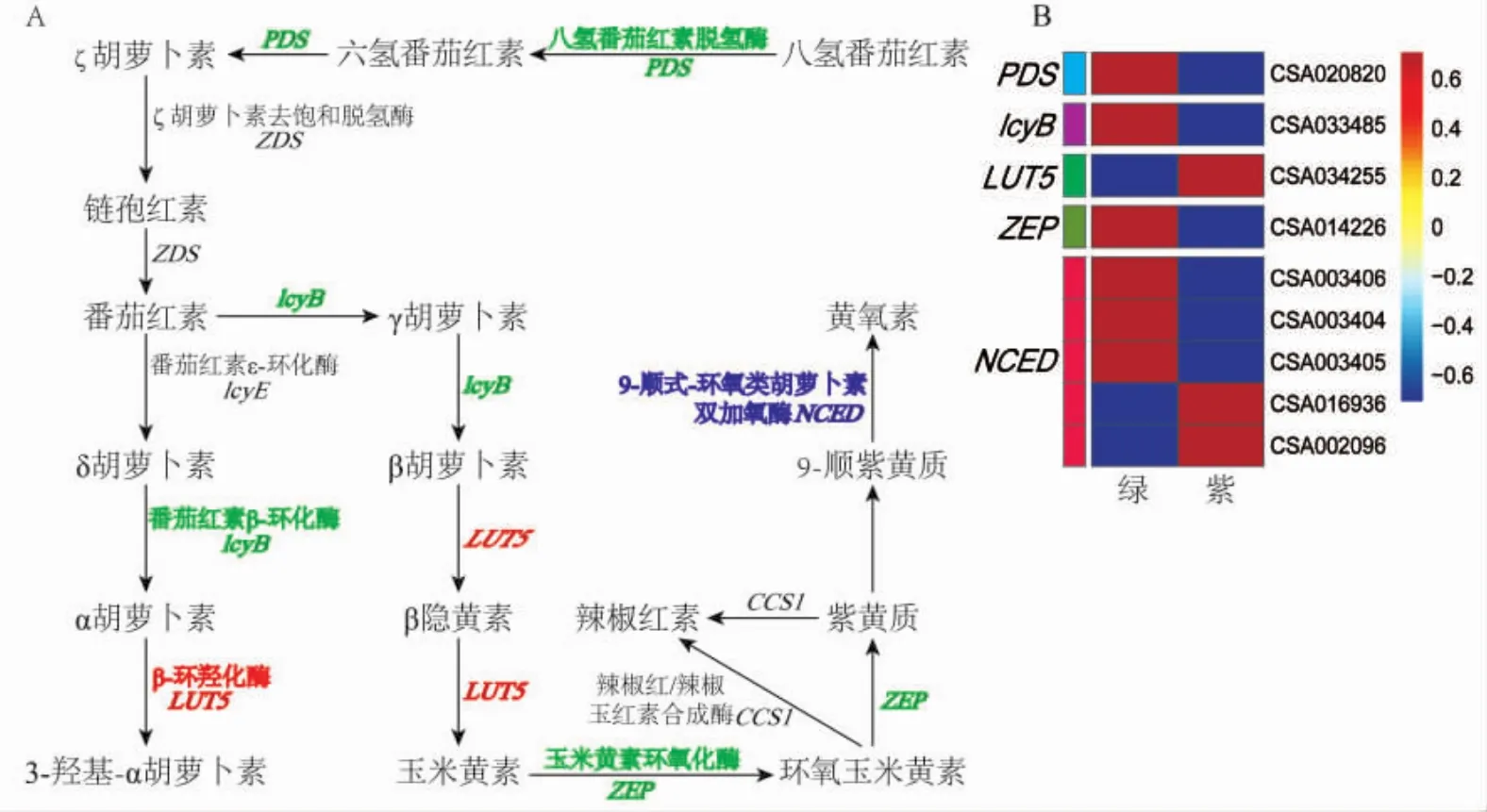
图4 茶叶中类胡萝卜素生物合成及其关键基因Fig.4 Carotenoid biosynthesis and its key genes in tea
2.6 茶叶中基因表达水平的验证
以茶树的肌动蛋白基因actin作为内参基因,对参与茶树黄酮和类胡萝卜素生物合成途径中的关键基因CSA004930(F3H)、CSA011508(ANS)、CSA018076(UFGT)、CSA003404( NCED)、CSA029707(CHI)、CSA024718(CHS)和CSA031792(F3'5'H)进行了验证。使用2-ΔΔCt计算qRT-PCR的结果,验证的7个基因中,紫色叶和绿色叶相比,有5个上调,2个下调(图5),与转录组测序结果进行比较后发现这些基因的表达模式与转录组中高度一致,说明转录组测序数据准确。
3 讨论
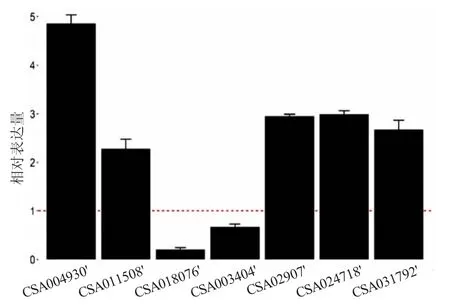
图5 差异表达基因的QRT-PCR结果Table 5 Verification of the expression level of key genes in tea
紫色茶叶中富含花青素等黄酮类化合物,高浓度黄酮类化合物的茶产品对于人体健康有益。近年来,很多研究者开始探索富含花青素的茶叶品种[17-18]。茶叶的品质受到茶树颜色的影响,特殊颜色的茶树由于其所含有的生化成分而受到广泛关注。黄酮类化合物被认为是茶产品中最重要的品质参数,他们决定了茶产品的颜色和味道。儿茶素是导致涩味和苦味的主要原因[19],而花青素可以与儿茶素和茶黄素结合[20]。相比于绿色茶叶,紫色茶产品具有独特的口感和甜味。
本研究通过比较紫色和绿色叶在转录水平的差异,分析紫色叶中与花青素和类胡萝卜素生物合成相关基因的表达变化,揭示不同颜色茶叶形成的机制。已经有很多研究报道了紫叶茶品种的叶片化学组成和颜色形成的分子机制。紫色叶的形成与色素的代谢密切相关,植物组织的颜色主要由叶绿素、类胡萝卜素和黄酮化合物三种主要的色素决定[16]。黄酮类化合物通常是导致叶片呈红色、蓝色和紫色的原因,当黄酮的含量比较高,足以掩盖叶绿素的颜色时叶片就会变为其他颜色[21]。在之前的研究中,发现紫色叶中的花青素和总黄酮含量比绿色叶高很多[5]。
我们通过通路富集找到了类黄酮/花青素生物合成过程中的一些关键基因,这些基因在紫色叶中的表达水平显著高于绿色叶,推测黄酮类化合物很可能与茶树紫色叶的形成有密切联系。在紫色叶中花青素合成相关的基因CHS、CHI、F3H和F3'5'H等表达量显著上调。这些基因的表达可能会导致黄酮类/花青素生物合成途径中的代谢物的积累,如矢车菊色素-3葡萄糖苷、飞燕草色素-3-葡萄糖苷和天竺葵色素-3-葡萄糖苷,会导致这些产物在紫色叶中保持较高水平。而代谢组研究发现,黄酮类/花青素生物合成途径中的代谢物在紫叶中保持高水平,而卟啉、叶绿素代谢和类胡萝卜素生物合成的中间体在绿叶中表现出高水平[22]。这和我们转录组分析的结果一致,进一步揭示了茶树品种叶色变化的机制。
我们发现5个UGT75L6基因在紫色叶中表达下调,1个基因表达上调。之前在栀子花中色素积累研究发现,UGT75L6的表达量与果实中色素积累并无显著相关性[23]。UGT基因是糖基转移酶家族,负责将糖部分连接到多种受体底物上,包括碳水化合物、蛋白质、脂质和次级代谢物[24-25]。UDP-糖基转移酶利用高度特异性的糖供体以及糖受体[26],UDP-糖基转移酶是花青素和黄酮醇生物合成中的最终酶。在78个UGT家族基因当中,UGT78G1和UGT78D2参与到了花色素、黄酮醇、黄酮及异黄酮的生物激活,并且参与花青素的糖基化[27-28]。而另一种UGT78A14的研究中,发现它参与了黄酮醇-3--O-葡萄糖苷的生物合成[29]。值得一提的是,一种新发现的UGT72AM1在紫色茶叶中有更高的表达量,而且在酶测定实验中证实UGT72AM1具有花青素 -3-葡萄糖苷转移酶的活性[30]。UGT75L6属于次生代谢产物糖基转移酶(PSPGs),有研究报道,UGT7516最有可能位于叶绿体中[23]。在紫色叶中,叶绿素含量下降,我们推测可能和UGT7516基因表达量下调存在关联。我们的研究表明,UGT75L6在紫色叶中大都表现为表达下调。我们推测UGT75L6基因表达与花青素积累无明显关联,而且在紫色叶中,UGT75L6的表达受到抑制。这可能表明UGT75L6没有花青素-3-葡萄糖苷转移酶活性。
黄酮类化合物在植物抵抗寒冷、干旱和UV-B辐射等逆境中发挥着重要作用,同时对植物的生长起着调节作用[31]。茶叶中较高含量的黄酮类化合物可以保护茶叶免受高光损伤和其他不利的环境压力,使得红芽直立茶具有良好的抗性,可以作为茶树育种的重要资源。在之前的研究中已经克隆了许多参与花青素代谢途径的基因,并且已经报道了这些基因的表达模式与积累的花色素苷之间的关系[5]。通过转录组测序鉴定到了浙江红花山茶花中与花青素代谢相关的9个基因,包括苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)、黄烷酮3-羟化酶(F3H)和二氢黄酮醇还原酶(DFR)[32]。通过对CHS和F3H表达序列标签进行分析发现了它们的表达水平在“紫鹃”茶的嫩叶中显著高于老叶[33]。这些研究证实了黄酮生物合成过程中的关键基因对花青素积累的重要性。
类胡萝卜素是植物中另一种重要的天然色素,在植物光合作用和对外界的响应方面具有重要作用[34]。同时具有光保护和清除自由基的作用,是植物光合速率和营养情况的重要指标[35]。人们普遍认为核心类胡萝卜素途径在大多数植物物种中是保守的,然而不同的植物中类胡萝卜素的积累具有其特性。植物中类胡萝卜素代谢合成调控非常复杂,从茶叶转录组的角度来看,紫色叶中类胡萝卜素的积累是受限的。代谢组研究也表明,绿色茶叶中类胡萝卜素生物合成中的中间体含量较高,而在紫色茶叶中含量较低[30]。从转录组研究来看,类胡萝卜素生物合成中的关键基因 PDS、lcyB、ZEP和NCEN等都在绿色茶叶中表达更高。
之前研究显示,类胡萝卜素可以作为在花青素/黄酮类含量降低时的补充,绿叶中的类胡萝卜素有助于确保有效的光合作用,清除各种活性氧[36],并保护叶绿素免受光氧化作用[37]。所以类胡萝卜素的升高也有助于保持叶绿素含量,这是造成叶片显示绿色的原因之一。此外,植物中类胡萝卜素的合成受到多方面的影响,茶叶中类胡萝卜素的分解主要是通过9-顺式-环氧类胡萝卜素双加氧酶(NECD)来完成的,它是控制类胡萝卜素向脱落酸(ABA)转化的限速酶[38]。ABA是重要的植物激素,可以抑制细胞分裂,促进叶片的衰老和脱落。紫色叶和绿色叶相比,编码NECD的5个同源基因的表达量有3个是降低的,并且紫黄质的合成也受到抑制,说明紫色叶中的ABA的合成不足,紫色叶具有更强的抗老化能力。

