采用饱和突变提高谷氨酰胺酶的热稳定性
陈笑,李江华*,刘松,堵国成
1(江南大学 生物工程学院,江苏 无锡,214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
谷氨酰胺酶(glutaminase,EC 3. 5. 1. 2)广泛存在于细菌、酵母菌、真菌等微生物中,是生物体氮代谢过程中的关键酶,被广泛应用于食品、医疗等多个领域[1-2]。某些微生物来源的谷氨酰胺酶可以催化谷氨酰胺的γ-谷氨酰基转移反应,制备一种功能性食品添加剂——茶氨酸,比如硝基还原假单胞菌(Pseudomonasnitroreducens)[3]。在酱油酿造业中,利用L-谷氨酰胺酶水解谷氨酰胺生成具有鲜味的氨基酸——谷氨酸,酱油曲料中的谷氨酰胺酶的酶活力是影响酱油发酵中L-谷氨酸得率的关键因素[4]。WAKAYAMA等[5]将来自嗜麦芽寡养单胞菌(StenotrophomonasmaltophiliaNYW-81)的谷氨酰胺酶纯化至均一,该酶比酶活为325 U/mg,具有较高的耐盐性和热稳定性。在添加S.maltophilia谷氨酰胺酶的模型反应中,谷氨酸的浓度是添加米曲霉(Aspergillusoryzae)谷氨酰胺酶的4倍,是添加藤黄微球菌(MicrococcusluteusK-3)谷氨酰胺酶的2.6倍,该酶显示出较高的谷氨酸生产能力。此外,谷氨酰胺酶能特异性水解植物蛋白中谷氨酰胺残基的胺酰基,提高蛋白质的功能性质[6]。
目前大部分谷氨酰胺酶热稳定性较低,限制了其在酱油酿造等高温环境中的应用[7]。为提高谷氨酰胺酶的应用效果,人们开始重视它的稳定性研究。DURA等[8]研究发现,添加乙二胺四乙酸和乙二醇可使德巴利酵母属(Debaryomycesspp. CECT 11815)谷氨酰胺酶的半衰期(t1/2,25 ℃)分别提高29%和43%。MATSUURA等[9]将大肠杆菌(Escherichiacoli)谷氨酰胺酶封装于Santa Barbara Amorphous(SBA)颗粒中形成酶-SBA10.6 复合物,其60 ℃下热稳定性较固定化前提高3.3倍。尽管相关研究一定程度上提高了谷氨酰胺酶的热稳定性,但仅局限于酶稳定剂筛选及固定化,缺乏对酶分子自身稳定性的改造。
随着生物信息学的发展,部分软件可以利用蛋白质结构计算氨基酸突变能(如Discovery Studio[10-11]等),预测影响蛋白稳定性的关键氨基酸。李广林等[12]通过设计点突变和二硫键位置的策略,构建筛选库(36个单点突变体)提高脂肪酶热稳定性。最稳定的突变体Tm值提高14.3 ℃,半衰期(t1/2,70 ℃)提高12.5倍,催化效率提高39%。合理的计算方法能减少筛选突变克隆的数量,减少工作量,高效筛选出优良突变株。最近的研究表明,蛋白质中排斥静电相互作用会破坏蛋白质的稳定性。KOIDE等[13]发现人纤连蛋白(FNfn10)的第10个纤连蛋白III型结构域在酸性环境中比中性环境中稳定,其中Asp23、Glu9和Asp7在FNfn10表面形成带负电的斑块,表明在中性环境中存在排斥的静电相互作用。突变体D7N和D7K表现出适应性且稳定性不再依赖pH,推测减少蛋白中不利相互作用有利于提高蛋白稳定性。郑鹏[14]为评估静电相互作用对小蛋白GB1的机械稳定性的影响,将双组氨酸基设计到GB1的受力区域中,改变pH值His可以在质子化和去质子化之间切换,在酸性条件下两个带正电荷His静电排斥作用强,GB1机械稳定性降低34%。因此可以通过优化蛋白质静电相互作用的方法提高蛋白稳定性。
本研究以枯草芽孢杆菌(Bacillussubtilis168)的谷氨酰胺酶(YbgJ)为研究对象,利用DS 2017(BIOVIA,美国)对酶分子中具有不利相互作用的49个氨基酸进行虚拟突变,确定了影响酶热稳定性的关键氨基酸位点进行饱和突变,获得热稳定提高的突变体。
1 材料与方法
1.1 材料与试剂
菌株与质粒:表达质粒pP43NMK、大肠杆菌(EscherichiacoliJM109)及宿主枯草芽孢杆菌(BacillussubtilisWB600),来源于本实验室前期构建保存。质粒pP43NMK-YbgJ为作者实验前期构建。
种子培养基(LB,g/L):酵母粉5,胰蛋白胨10,NaCl 10。
发酵培养基(TB,g/L):酵母粉24,胰蛋白胨12,甘油4,K2HPO416.43,KH2PO42.31,调节pH至7.0,于121 ℃,0. 08 MPa下灭菌20 min。
固体培养基是在液体培养基中加2%的琼脂。
重组大肠杆菌用LB培养基(含100 μg/mL氨苄霉素)进行培养和筛选;重组枯草芽孢杆菌用LB培养基(含80 μg/mL卡纳霉素)进行培养和筛选
酶、试剂、引物和DNA序列测定:限制性核酸内切酶购自Thermo Fisher Scientific公司,胶回收试剂盒和Competent Cell Preparation Kit试剂盒购自Takara(大连)公司,Bradford蛋白浓度测定试剂盒购自碧云天公司。引物合成和DNA测序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 软件分析
利用DS对YbgJ(PDB,1mki)分子中具有不利相互作用的49个氨基酸位点进行虚拟突变,计算出突变体与野生型的结合自由能差值[ΔΔGmut=ΔGbind(mut)-ΔGbind(WT)]。根据能量值高低对突变体排序,选择前3个氨基酸位点E3、E55、D213进行饱和突变实验。利用在线服务器SWISS-MODEL (http://swissmodel.expasy.org/),以YbgJ为模板构建突变体的模拟结构。
1.2.2 YbgJ突变体的构建及表达
以pP43NMK-YbgJ质粒为模板,通过PCR引入突变氨基酸(引物如表1)。PCR循环数为15,PCR结束后利用DpnI消化模板1 h,柱回收后回收产物转化至E.coliJM109中,在37 ℃恒温培养箱中培养10 h。待长出明显的单个菌落后,挑取2~3个菌落进行测序,并将测序正确的转化子提取质粒转入B.subtilisWB600中,得到突变菌株。挑取单个菌落至LB培养基(含100 μg/mL卡纳霉素)中,于37 ℃、220 r/min摇床振荡培养8 h。将种子液以2%的接种量转接TB培养基,37 ℃,220 r/min摇床振荡培养15 h。
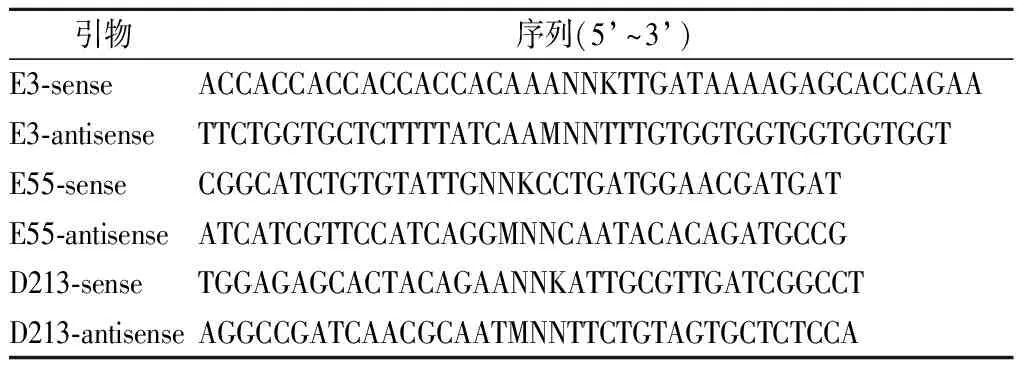
表1 E3、 E55、 D213位点饱和突变引物Table 1 Saturation mutagenesis-primer of E3, E55 andD213 site
注: “NNK”、“MNN”中N代表A/G/C/T;K代表G/T;M代表A/C。
1.2.3 YbgJ突变体的纯化
将发酵液于4 ℃,7 000 r/min条件下离心15 min后收集菌体,将菌体用buffer A (pH 7.5,20 mmol/L K2HPO4-KH2PO4缓冲液)重悬后超声破碎30 min (工作1 s,暂停2 s),于4 ℃,7 000 r/min条件下离心15 min即得粗酶液。将粗酶液经0.22 μm滤膜过滤后使用His TrapTMHP 5 mL(GE)进行纯化。首先使用buffer A平衡预装柱,以1 mL/min的流速上样,上样量15 mL。用10倍柱体积的结合缓冲液脱洗非特异性结合杂质,随后用洗脱缓冲液(500 mmol/L咪唑,20 mmol/L K2HPO4-KH2PO4,pH 7.5) 洗脱结合蛋白,其中15%洗脱缓冲液洗脱出杂蛋白,40%洗脱缓冲液洗脱出目标蛋白。收集穿透峰、洗脱峰,利用SDS-PAGE检测YbgJ突变体纯化情况。
1.2.4 YbgJ酶活测定
采用奈氏试剂法[15-16]测定YbgJ的活力。利用buffer A配制底物(L-谷氨酰胺,1.2 g/110 mL),取1 100 μL底物(74 mmol/L)于37 ℃保温10 min后,加入100 μL稀释到适当倍数的粗酶液,37 ℃反应10 min后加入100 μL终止剂(三氯乙酸,1.5 mol/L)终止反应。在37 ℃保温10 min的1 100 μL底物中加入上述100 μL粗酶液与100 μL终止剂的混合液,于37 ℃保温10 min,所得溶液即为吸光度检测的对照。反应结束后12 000 r/min离心2 min,取100 μL上清,加入3 400 μL去离子水和500 μL奈氏试剂,混匀后在波长436 nm下测定吸光度。酶活力的定义:在37 ℃,pH为7.5条件下每分钟催化L-谷氨酰胺产生1 μmol NH3所需要的酶量定义为1个酶活力单位。
1.2.5 浓度的测定
蛋白质浓度测定采用Bradford蛋白浓度测定试剂盒,具体按说明书操作。
1.2.6 酶学参数的测定
半衰期检测(t1/2, min):将纯化后的突变YbgJ稀释到同一浓度,放置于55 ℃水浴保温30 min,其中每隔3 min取样并按照1.2.4方法测定YbgJ的残余酶活,确定半衰期。
Km和kcat测定:配制0、10、20、30、40、50、60、70、80、90、100 mmol/L的L-谷氨酰胺溶液,按照1.2.4测定酶活力,并用MATLAB软件拟合y=ax/(b+x)曲线,b=Km、a=Vmax,再计算得到Kcat值、Kcat/Km值。
数据分析:采用Microsoft Office Excel 2003单因素方差分析模块对WT和突变体的酶学参数进行分析。
1.2.7 圆二色谱及稳态荧光光谱分析
采用圆二色谱仪(circular dichroism spectrum, CD)分析YbgJ以及突变体YbgJ的二级结构。将纯化后的YbgJ酶液稀释到100~120 μg/mL,样品池光程为1 mm,分析190~250 nm远紫外波长下的CD光谱。再运用在线预测网站(http://dichroweb.cryst.bbk.ac.uk/html/home.shtml)获得蛋白质的各类二级结构(α螺旋、β折叠等)的含量。
采用Hitatch F-7000测定YbgJ内源荧光光谱。将纯化后的YbgJ及突变体用buffer A稀释至100 μg/mL,激发波长为298 nm,发射波长为300~500 nm,间隔0.2 nm进行扫描,激发和发射狭缝宽度均为10 nm。
1.2.8 酱油发酵模拟体系的构建
酱油发酵模型系统(5 mL)由大豆蛋白分离物、NaCl、碱性蛋白酶、复合风味酶、谷氨酰胺酶组成。0.5 g大豆蛋白分离物(SPI)溶于5 mL 100 mmol/L Tris-HCl(pH 8.0)中,加入碱性蛋白酶500 μL,60 ℃水浴2 h后加入复合风味500 μL,50 ℃继续水浴4 h,90 ℃ 10 min终止蛋白酶的活性。4 ℃,12 000 r/min离心15 min,收集上层样品用作生物转化反应的底物。根据FIELDS的方法[17]利用三硝基苯磺酸(TNBS)测定α-氨基含量以检测大豆蛋白分离物被酶解的程度,使用L-亮氨酸作为标准样品。在上层清液中加入18% NaCl,调节pH至5。将制备得到的YbgJ及突变体纯酶液添加到模型反应混合物中,45 ℃水浴保温,在不同的时间取出反应液1 mL,90 ℃ 10 min终止酶反应。利用谷氨酸脱氢酶检测谷氨酸的含量。
2 结果与分析
2.1 YbgJ突变位点的确定
运用Discovery Studio 2017软件的分子对接模块,构建YbgJ与底物L-谷氨酰胺的复合物。利用该软件的虚拟氨基酸突变模块,对YbgJ中具有不利相互作用的49个氨基酸进行丙氨酸扫描,基于突变能变(ΔΔGmut)分析影响该酶热稳定性的关键氨基酸。一般认为,ΔΔGmut值是负值,表明突变后能量下降,酶稳定性提高;反之突变后能量上升,酶稳定性较差。根据能量值高低对突变体排序(如图1-b),选择前3个氨基酸位点E3、E55、D213进行饱和突变实验。

图1 YbgJ三级结构部分不利相互作用位点(a)及虚拟突变体能量值(b)Fig.1 Part of the adverse interaction sites of YbgJ tertiary structure(a) and energy value of virtual mutant(b)
2.2 YbgJ突变体的构建与表达
以pP43NMK-YbgJ质粒为模板,通过PCR引入突变氨基酸。将测序正确的转化子转入B.subtilisWB600中,发酵表达YbgJ突变体,测胞内YbgJ的热稳定性。前期研究中发现野生型YbgJ在55 ℃下的半衰期为10.79 min。为了能够筛选到稳定性提高的突变体,本研究将E3、E55、D213位点所有突变体在55 ℃保温12 min测定残余酶活(图2)。

M-蛋白质标准分子质量(kDa);1~9-YbgJ、E55F、E55L、D213T、D213W、D213R、E3C、E3S、E3P纯酶液图2 pP43NMK-YbgJ质粒图(a)及优势突变体纯化蛋白的电泳分析图(b)Fig.2 The plasmids mapof pP43NMK-YbgJ(a) and SDS-PAGE analysis(b) of wild YbgJ and mutant enzymes
突变体E55F、D213T、E3C、E3S、E3P和E3A较WT热稳定性明显提高。通过Ni2+亲和层析法纯化得到E55F、E55L、D213T、D213W、D213R、E3C、E3S、E3P纯酶液(图2-b),进一步分析其酶学性质。
2.3 YbgJ突变体酶学性质分析
如表2所示,突变体E3C、E3S、E3P、E55F、D213T半衰期(t1/2,55 ℃)较WT分别提高58%、42%、39%、69%和41%,这表明E3、E55、D213对YbgJ的热稳定性有较大的影响。此外D213W、D57S和D213T的比酶活分别提高了17%、12%和11%,而突变体E55F、E55L、D213R和E3S比酶活反而降低。所有突变体的Km值与WT相比均下降,其中D213T、E55F突变体的Km值分别降低了22%、19%;突变体的催化常数(kcat)与野生型相比提高了2%~13%不等;突变体E55F、D213T、D57S的kcat/Km分别提高了37%、32%、30%。这说明E55、D213对YbgJ的底物结合能力有一定的影响。

表2 野生YbgJ和突变体的酶学性质Table 2 Enzymatic properties of WT and mutants
注:P值用于判断突变体和WT之间酶学参数的统计学显着性。
2.4 复合突变提高YbgJ热稳定性
在前面研究中得到E3C、E55F、D213T三株较好的正向突变体。为了进一步验证E3,E55,D213位点对YbgJ稳定性有重要影响,将位点E3、E55、D213进行复合突变,获得E3C/E55F、E3C/D213T、E55F/D213T和E3C/E55F/D213T四个突变体(表3)。
如表3所示,4个复合突变体的半衰期(t1/2,55 ℃)明显提高,E3C/E55F/D213T、E3C/E55F、E3C/D213T和E55F/D213T的半衰期与WT相比分别提高了1.73、1.44、1.22和0.97。研究表明:多个耐热性突变位点协同作用可以进一步提高热稳定性。对复合突变体动力学参数进行分析,发现复合突变体Km值与WT相比均下降,其中E3C/D213T下降了31%。此外E3C/E55F/D213T、E3C/E55F的Kcat值提高的幅度较大,分别提高39%和29%。4个复合突变体比酶活均有增加,其中E55F/E3C提高23%,最终为693 U/mg。
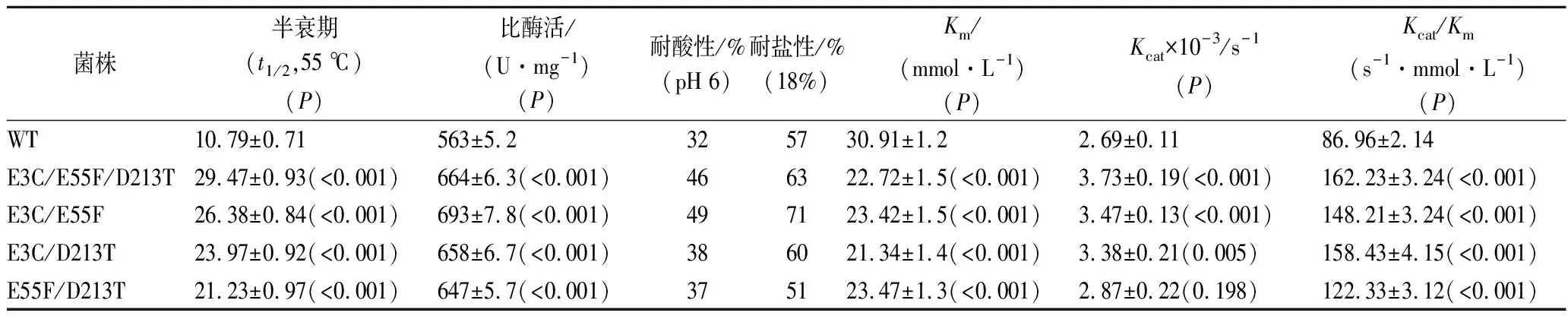
表3 野生YbgJ和复合突变体的酶学性质Table 3 Enzymatic properties of WT and mutants
注:P值用于判断突变体和WT之间酶学参数的统计学显着性。
2.5 YbgJ突变体的稳定化机制分析
上述研究中发现E3C/E55F/D213T 稳定性较好,为进一步分析突变体稳定性提升的原因,本研究利用圆二色谱(CD)和荧光光谱对WT及其突变体的二级、三级结构进行分析比较(图4)。如图4-a所示,突变体的CD圆二色谱曲线无明显变化,说明其二级结构并未发生改变。为进一步定量WT及突变体的二级结构含量,利用在线软件分析各二级结构的含量,结果显示突变体与WT的二级结构含量没有显著区别。如图4-b所示,荧光光谱结果显示其最大荧光吸收峰没有发生变化,仍为394 nm。综合上述结果可知复合突变并未改变YbgJ的结构。
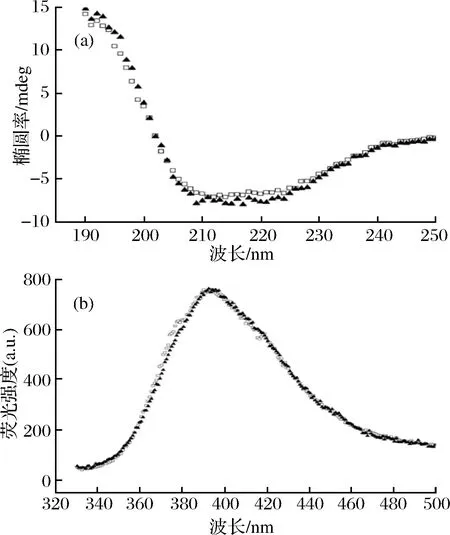
□-WT;▲-E3C/E55F/D213T图4 野生型及其突变体圆二色谱(a)及稳态荧光光谱分析(b)Fig.4 CD spectrum(a) and steady-state fluorescence spectra analysis(b) of WT and its mutants
为深入分析YbgJ突变体稳定性提高的机理,利用DS服务器以YbgJ (1mki.PDB)为模板同源建模,构建突变体的三维结构模型,并结合在线软件Protein Interaction calculator (http://pic.mbu.iisc.ernet.in/job.html)分析WT及突变体分子内部的相互作用力(如表4)。有研究表明,蛋白质分子的热稳定性、催化活性与蛋白质分子间作用力的种类和数量有关,且降低蛋白表面的疏水性或者增强分子内部的疏水性有利于蛋白质的稳定。PACE等[18]为了更好地了解蛋白质分子间相互作用对蛋白质稳定性的贡献,测定了四种蛋白突变体的构象稳定性的变化,研究发现疏水相互作用对小蛋白稳定性的贡献小于大蛋白质;折叠中掩埋的-CH2基团对蛋白质稳定性贡献(1.1±0.5) kcal/mol;疏水相互作用贡献(60±4)%,氢键贡献(40±4)%;构象熵贡献约2.4 kcal/mol/残基,并且提出蛋白质的球状构象主要由疏水性相互作用稳定。如表4所示,突变体E3C/E55F/D213T、E3C/E55F和E55F/D213T 的疏水相互作用力都增加。因此疏水作用力的增加极有可能是YbgJ热稳定性提高的一个原因。
此外,突变体E3C/E55F/D213T、E3C/E55F、E3C/D213T和E55F/D213T 较WT分别增加了30、23、11和8个氢键。JOHN等[19]为了研究来自极端嗜热生物Thermusaquaticus的D-甘油醛-3-磷酸脱氢酶(GAPDH)热稳定性的决定因素,将各种来源的GAPDH进行比较,发现热稳定性与带电侧链和中性配位体间的氢键数量存在很强的相关性。MABROUK等[20]基于序列比对和同源建模改造了芽孢杆菌属的麦芽糖淀粉酶,发现酶热稳定性提高是因为形成了新的疏水相互作用、盐桥和氢键,同时也提出氢键增加是酶分子稳定性提高的重要原因之一。因此氢键的增加可能是YbgJ热稳定性提高的重要原因之一。

表4 突变前后YbgJ作用力变化Table 4 Interactions potentially involved in the stability of wild-type and mutant
运用软件DS对YbgJ和突变体的不利相互作用数量进行统计(如表4)。突变体E3C/E55F/D213T、E3C/E55F、E3C/D213T和E55F/D213T较WT分别减少了5、4、4、3不利相互作用。相关研究表明蛋白质表面相同电荷之间的排斥相互作用会使蛋白质稳定性降低[13]。由此推测,不利相互作用的减少也可能是YbgJ热稳定性提高的原因之一。
2.6 酱油发酵模型反应中YbgJ及突变体的应用
为了验证YbgJ及突变体的潜在应用价值,将纯酶液添加到酱油发酵模型反应中检测谷氨酸的产量。利用碱性蛋白酶和复合风味酶对大豆蛋白进行酶解,检测酶解液中的α-氨基含量达到97~100 mmol/L,表明大豆蛋白被降解。在上层清液中加入18% NaCl,调节pH至5,模拟酱油发酵反应。将制备得到的YbgJ及突变体纯酶液添加到反应混合物中,45 ℃水浴保温。利用谷氨酸脱氢酶测不同时间谷氨酸的含量。如图5所示,相比于添加YbgJ的酱油发酵模型体系,添加复合突变体有效地增加了谷氨酸的含量。
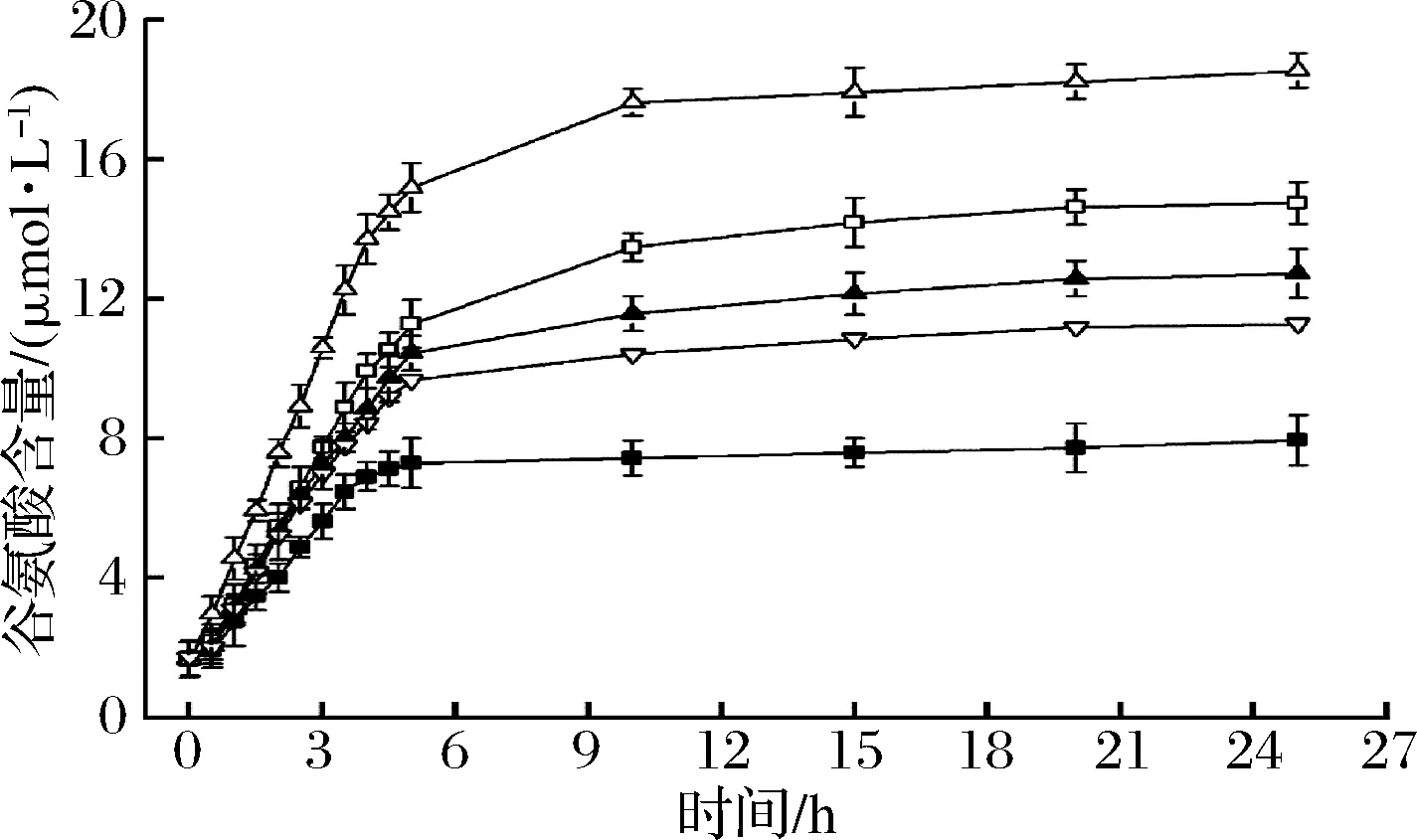
■-WT;▽-E55F / D213T;▲-E3C/D213T;□-E3C/E55F;△-E3C/E55F/D213T图5 酱油发酵模型中谷氨酸的产量Fig.5 Glutamic acid production in soy sauce fermentation model
在pH为5的酱油发酵模型中,添加E3C/E55F/D213T、E3C/E55F、E3C/D213T、E55F/D213T后谷氨酸的含量分别比添加WT提高134%、86%、60%、42%。随着反应时间的延长,谷氨酰胺酶逐渐失活,谷氨酸含量的增长逐渐减慢。比较图中5条曲线,发现E3C/E55F/D213T在5~10 h中的谷氨酸增长斜率>E3C/E55F>E3C/D213T>E55F/D213T>WT,由此说明E3C/E55F/D213T的应用价值较大。
3 结论
本研究中通过饱和突变的方法,确定了E3、E55、D213位点是提高谷氨酰胺酶热稳定性的重要位点,构建的突变体E3C、E55F、D213T半衰期(t1/2,55 ℃)较WT分别提高58%、69%和41%。复合突变体E3C/E55F/D213T、E3C/E55F、E3C/D213T和E55F/D213T的半衰期(t1/2,55 ℃)与WT相比分别提高了1.73、1.44、1.22和0.97,其中E3C/E55F比酶活提高23%,最终为693 U/mg。在pH为5的酱油发酵模型中,添加E3C/E55F/D213T、E3C/E55F、E3C/D213T、E55F/D213T后谷氨酸的含量分别比添加WT提高134%、86%、60%、42%。获得的热稳定性提高及催化活性提高的突变体YbgJ将有助于工业化应用。

