反应条件对牛血清白蛋白-葡萄糖体系糖基化产物形成的影响
李军,涂宗财,2*,沙小梅,张露,叶云花,罗娟,杨萍,邵艳红
1(江西师范大学 生命科学学院,江西 南昌,330022) 2(食品科学与技术国家重点实验室(南昌大学),江西 南昌,330047)
美拉德反应(maillard reaction,MR)又称为非酶褐变反应,是指含氨基化合物(氨基酸、蛋白质)和含羰基化合物(还原糖、醛)之间发生的复杂反应[1],该反应在蛋白质和还原糖之间自发进行,无需添加任何化学物质。相对化学改性和酶法改性而言,基于MR机理的糖基化改性是食品蛋白质改性的一种绿色、有效的方法,已被人们广泛应用于食品加工领域,成为食品科学领域的研究热点之一。高蛋白和高糖类食品在热加工过程中发生的糖基化反应可以促进食品风味物质的产生,增加口感,赋予食品色泽,增加美观程度[2],还能提高蛋白质的抗氧化活性等性质[3]。但当糖基化反应处于中期和晚期阶段时,还原酮、醛和杂环化合物等一系列有害的糖基化产物也会随之产生,进而对人体健康造成不良的影响。如DAGLIA等[4]研究发现羰基化合物可以造成细胞损伤,进而导致糖尿病及人体衰老;SACHSE等[5]研究发现,5-羟甲基糠醛具有致癌作用;张娟等[6]研究发现,高剂量的丙烯酰胺对雄性小鼠的睾丸细胞DNA有损伤作用;孙缅恩等[7]研究发现,食用过多含后期糖基化末端终产物(advanced glycation end products,AGEs)的食品可加速人体衰老,增加糖尿病、动脉粥样硬化和阿尔茨海默症等各种慢性退化疾病的发病率。因此,通过控制糖基化反应条件,降低食品加工过程中有害糖基化产物的形成具有重要的意义。
牛血清白蛋白(bovine serum albumin,BSA)是一种简单的球蛋白,其作为牛血清中的主要成分,在食品、医药和生化领域中均有广泛的应用。它作为动物来源的一种代表性蛋白,已经成为研究生物学功能、蛋白质理化性质、蛋白质与小分子相互作用等方面的一种理想蛋白模型。因此,本文以BSA-葡萄糖体系为简单模型来研究糖基化体系在热加工过程中糖基化产物形成的变化,研究反应时间和温度的变化对糖基化产物,尤其是有害糖基化产物形成的影响,为食品热加工过程中糖基化产物形成的调控提供一定科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
牛血清白蛋白(bovine serum albumin,BSA)、葡萄糖:分析纯,美国Sigma公司;糖化血清蛋白(GSP)测定试剂盒(果糖胺法),南京建成生物工程研究所;5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)、丙烯酰胺:色谱纯,上海阿拉丁生化科技股份有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、三氯乙酸(trichloroacetic acid,TCA)、异硫氰酸胍、盐酸等:分析纯,上海阿拉丁生化科技股份有限公司。
1.1.2 主要仪器设备
纳米超高压均质机(NCJJ-0.007/200),廊坊通用机械制造有限公司;酶标仪(Synergy H1),美国Bio Tek公司;荧光分光光度仪(F-7000型),日本日立公司;冷冻干燥机(LGJ-1D-80),北京亚泰科隆仪器技术有限公司;电热恒温鼓风干燥箱(DHG-9023A),上海精宏实验设备有限公司;电子分析天平(FA1104N型),上海丙林电子科技有限公司;Infinity Quaternary LC(Agilent 1260),美国安捷伦公司。
1.2 方法
1.2.1 样品的制备
参照LIU等[8]的方法制备BSA-葡萄糖糖基化样品。将BSA溶解于磷酸缓冲液(20 mmol/L,pH 7.4)中配成25 g/L的溶液,按照葡萄糖与蛋白质质量比为1∶1的比例向BSA溶液加入葡萄糖,混匀,冻干。将冻干的粉末置于恒温烘箱中55 ℃下分别反应6、12、24、36、48、72 h,或分别于50、60、70、80、90、100 ℃下反应12 h。烘箱内的相对反应湿度均为65%(饱和KI溶液)。待反应结束后,将BSA-葡萄糖糖基化样品置于冰水浴中终止反应,加入超纯水复溶到BSA的质量浓度为10 g/L,并置于4 ℃冰箱中待测。
1.2.2 褐变程度的测定
参照JUNG等[1]的方法测定不同反应条件下BSA-葡萄糖体系在294 nm以及420 nm处的吸光值。
1.2.3 果糖胺含量的测定
采用GSP试剂盒测定BSA-葡萄糖糖基化体系中的果糖胺含量,在530 nm波长处测定样品的吸光值。其中,标准溶液和标准空白溶液以试剂盒的方法配制。GSP含量的计算见公式(1)。
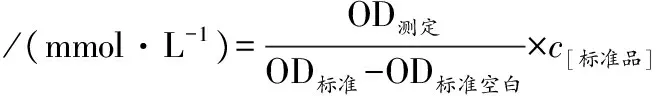
(2 mol/L)
(1)
1.2.4 羰基含量的测定
根据文献[9]略作修改:取0.2 mL稀释到适宜浓度的样品与0.8 mL 0.1%的DNPH溶液(2.5 mol/L盐酸配制)充分混合,室温避光反应1.5 h。然后加入1 mL 20%的TCA,10 000 r/min离心10 min后弃上清液,得到的沉淀物用1 mL蒸馏水重新溶解,加入1 mL 10%的TCA,再次10 000 r/min离心10 min,弃上清液。沉淀物用1 mL 1∶1(V∶V)的乙酸乙酯-乙醇溶液洗涤2次,以除去未反应的有机试剂。最后将沉淀物溶于0.5 mL 6 mol/L的异硫氰酸胍溶液中,在370 nm处测定样品的吸光值,并计算糖基化产物的羰基含量。
1.2.5 5-羟甲基糠醛含量的测定
根据文献[10]略作修改:用超纯水配制质量浓度分别为4、8、10、15、20、30和40 μg/mL的5-HMF标准品溶液,过0.22 μm水系滤膜后进行高效液相色谱(high performance liquid chromatography,HPLC)上样分析。取1 mL稀释到适宜浓度的样品溶液至15 mL离心管中,加入100 μL 6 mol/L的盐酸混匀,煮沸15 min后,4 000 r/min离心20 min。最后取上清液过0.22 μm水系滤膜后HPLC上样分析。色谱柱:Phenomenex C18长柱(5 μm,150 mm×4.6 mm);流动相:V(甲醇)∶V(水)=30∶70;流速0.4 mL/min;柱温:25 ℃;紫外检测波长285 nm;进样量:10 μL。
1.2.6 丙烯酰胺含量的测定
根据文献[11]略作修改:用超纯水配制质量浓度0.5、1、2、3、5、10、20、30和50 μg/mL的丙烯酰胺标准品溶液,过0.22 μm水系滤膜后进行HPLC分析。取1 mL稀释到适宜浓度的样品溶液,8 000 r/min离心20 min,取上清液过0.22 μm水系滤膜后进行HPLC分析。色谱柱:Phenomenex C18长柱(5 μm,150 mm×4.6 mm);流动相:V(甲醇)∶V(水)=5∶95;流速0.4 mL/min;柱温:30 ℃;紫外检测波长205 nm;进样量:20 μL。
1.2.7 荧光性AGEs测定
根据文献[12]修改如下:取3 mL稀释到适宜浓度的样品溶液,采用F-7000荧光分光光度计测定其在激发波长370 nm,发射波长440 nm处的荧光强度,激发和发射波长的狭缝宽度均为5 nm,扫描速度为1 200 nm/min,电压为400 V。样品的荧光强度单位以任意单位(arbitrary units)表示。
1.2.8 类黑精含量的测定
根据文献[13]修改如下:将样品溶液稀释到适宜的浓度,测定其在470 nm处的吸光值,通过Lamber-Beer等式计算样品中类黑精的含量,其计算等式见公式(2)。

(2)
式中:c,类黑精的浓度(mmol/L);A,样品的吸光度(470 nm);V,体积(mL);e,类黑精的摩尔消光系数282 L/(mol·cm);b,比色皿厚度(cm)。
1.3 数据处理
所有实验均重复3次,实验数据表示为平均值±标准偏差,采用Origin 8.6软件作图,SPPS 22.0软件进行单因素方差分析(ANOVA)。P<0.05则认为样品间具有显著性差异。
2 结果与分析
2.1 褐变程度分析
糖基化样品在294 nm处的吸光值常被用来监测糖基化反应的初始速度,代表中间产物生成的量;而在420 nm处的吸光值可以用来反映末期产物的生成量[14-15]。不同反应时间和反应温度制备的BSA-葡萄糖糖基化体系在294 nm和420 nm处的吸光值如图1所示。当糖基化反应时间为6~48 h时,样品的吸光值随反应时间的延长逐渐增大,而超过48 h时,吸光值随反应时间的延长逐渐下降,即55 ℃下反应超过12 h时,吸光值大幅度增加,反应48 h的样品在294 nm和420 nm处吸光值最高(P<0.05),分别为3.171和0.600。随着反应温度的升高,样品在294 nm和420 nm处的吸光值呈增加的趋势,即在本次实验中,当反应温度超过60 ℃时,吸光值大幅度增加,反应温度达到100℃时,其在294 nm和420 nm的吸光值达到最大值,分别为5.033和0.688,且显著高于50 ℃下制备的样品(P<0.05)。

图1 反应时间(A)和反应温度(B)对BSA-葡萄糖体系在294nm和420nm处的紫外吸收的影响Fig.1 Effect of reaction time (A) and temperature (B) on the UV absorption of the BSA-glucose system at 294 nm and 420 nm注:不同小写字母表示样品在294 nm之间存在显著性差异(P<0.05);不同大写字母表示样品在420nm之间存在显著性差异(P<0.05)
样品在294 nm处的吸光值可用于评价糖基化反应中间产物的形成量。在糖基化反应的初始阶段,葡萄糖脱水形成在294 nm有紫外吸收的中间产物并积累导致吸光值增加。但随着反应时间的延长或反应温度的升高,反应物逐渐被消耗,中间产物的积累速度变慢,吸光值增加缓慢。当糖基化反应到了最终阶段,长时间的反应让中间产物通过聚合逐渐形成最终产物,使反应72 h后体系的吸光值降低,这和AJANDOUZ等[15]报道相似。糖基化产物在420 nm和294 nm处的吸光值具有相似的变化趋势,这与中间阶段反应产物是最终阶段反应产物的前体物质有关[16]。但在反应后期,样品在420 nm处的吸光值变化不大甚至下降,这可能是由于生成越来越多不溶于水的类黑精所致。
2.2 果糖胺含量的分析
果糖胺是蛋白质进行非酶糖化而形成的糖化蛋白。高蛋白食品热加工过程中都会产生果糖胺,食用过多含果糖胺的食品会导致人体血糖偏高[17]。由图2可知,糖基化样品中的果糖胺含量随反应时间的延长和反应温度的升高均呈现先增加后下降的趋势(P<0.05)。

图2 反应时间(A)和反应温度(B)对BSA-葡萄糖体系中果糖胺浓度的影响Fig.2 Effect of reaction time (A) and temperature (B) on the content of fructosamine of BSA-glucose glycation system注:不同小写字母表示样品之间存在显著性差异(P<0.05)。下同。
在反应时间超过12 h和反应温度高于60 ℃时,果糖胺含量大幅度增加,并分别在24 h(2.36 mmol/L)和70 ℃(1.99 mmol/L)达到最大值。果糖胺含量增加的原因可能是,在反应初始阶段,希夫碱环化形成相应的葡糖胺,经过分子重排后形成了果糖胺。但继续延长反应时间或升高反应温度,果糖胺逐渐被消耗形成类黑精而导致果糖胺含量下降[18]。虽然55 ℃反应72 h或100 ℃反应12 h制备的糖基化体系的果糖胺含量达到最低,但随着反应时间和高温的增加,反应速率加快,反应程度加深,其有害糖基化末期产物增加,对人体健康存在更大的威胁[19-20]。因此,在蛋白质类食品加工过程中,将糖基化反应温度和时间应分别控制在60 ℃和12 h以内,能有效降低食品中果糖胺的含量。
2.3 羰基含量分析
羰基含量反映MR中间阶段羰基化合物形成的量,可通过测定样品中羰基含量来判断食品中蛋白质是否被氧化[21]。由图3可以看出,糖基化样品中的羰基含量随反应时间的延长和反应温度的升高均呈先增加后下降的趋势(P<0.05)。当糖基化反应在6~36 h和50~70 ℃内,羰基含量明显增加,且在12 h和60 ℃大幅度增加,这是因为随着反应程度的增加,BSA与葡萄糖反应形成大量的羰基化合物[22]。但继续延长反应时间或者提高反应温度,羰基含量逐渐减少,这可能是因为羰基化合物作为MR最终阶段产物的前体物质,被消耗形成对人体有害的末期产物所致[9]。因此,将糖基化反应的温度和时间应分别控制在60 ℃和12 h以内,可以有效地控制羰基化合物的形成,提高食品的相对安全性。
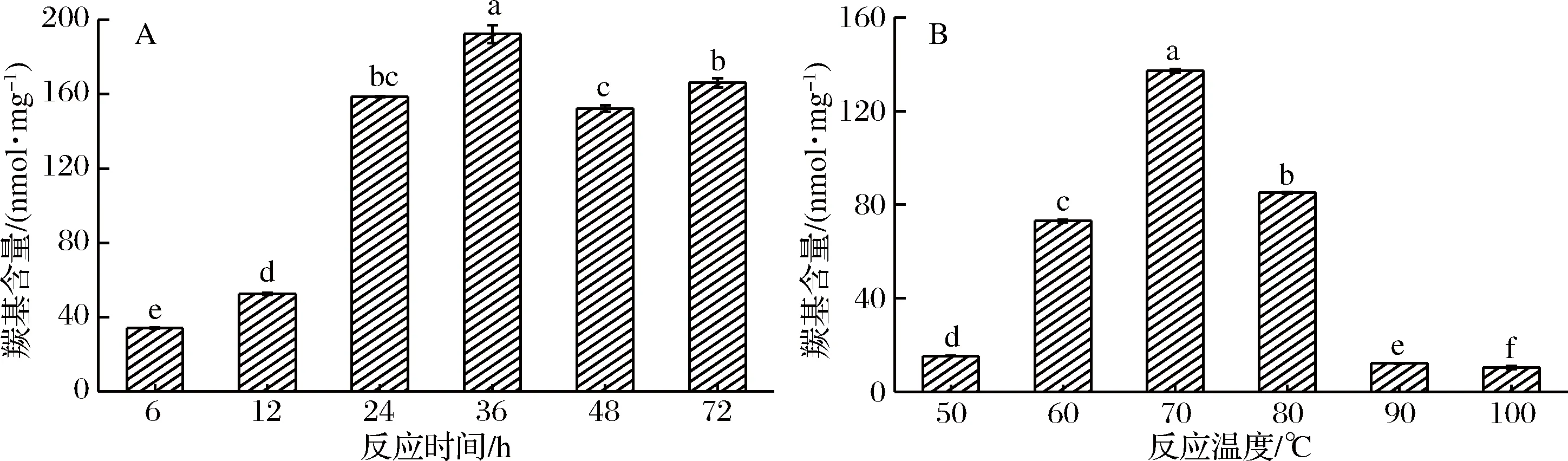
图3 反应时间(A)和反应温度(B)对BSA-葡萄糖体系中羰基浓度的影响Fig.3 Effect of reaction time (A) and temperature (B) on the content of carbonyl groups of BSA- glucose system
2.4 5-羟甲基糠醛含量的分析
本研究以峰面积为纵坐标(Y),5-HMF的质量浓度为横坐标(X),绘制5-HMF的标准曲线:Y=129.36X-64.064(R2=0.999 2),表明峰面积Y与5-HMF的质量浓度X(μg/mL)具有良好的线性关系,可用于计算样品中5-HMF的含量。
5-HMF是一种具有呋喃环结构的糠醛化合物,广泛存在于咖啡、焦糖制品、焙烤等食品中,可以改变食品的风味,已经被看作是带有微弱致癌性的一种指标成分。在人体内,5-HMF可以代谢产生毒性更强的羟甲基糠醛酸、羟甲基糠醛次硫酸盐等物质,具有很强的致癌致突变性[23]。反应时间和温度对样品中5-HMF含量的影响如图4所示,当反应温度为55 ℃时,样品中5-HMF含量随着反应时间的延长逐渐增加(P<0.05),反应时间≤24 h时,5-HMF含量增加幅度较大,从6 h的36.10 μg/mL增加到了24 h的106.13 μg/mL。当糖基化时间为12 h时,5-HMF含量随反应温度的升高呈先增加后下降的趋势,50 ℃时形成较少,含量为21.60 μg/mL,超过50 ℃时5-HMF大幅度增加,在70 ℃达到最大值(167.31 μg/mL),当反应温度超过70 ℃,5-HMF含量下降,且80~100 ℃反应12 h制备的样品中5-HMF含量无显著性差异(P>0.05),这可能是因为5-HMF含量的变化是其形成和降解共同作用,随着糖基化反应的进行,在己糖脱水形成5-HMF的同时,5-HMF与其他化合物反应生成类黑精等后期产物[22]。江姗姗等[10]研究表明,谷氨酸、赖氨酸、甘氨酸、半甘氨酸与葡萄糖的糖基化体系中5-HMF含量均随着加热时间的延长而增加。这一方面可能是因为氨基酸与葡萄糖体系的反应时间,最长反应时间仅为30 min,另一方面可能是因为BSA分子含有巯基,生成的5-HMF更容易被降解[10]。因此,将反应温度和时间分别控制在60 ℃和12 h以内,可有效降低糖基化体系中5-HMF含量。

图4 反应时间(A)和反应温度(B)对BSA-葡萄糖体系中5-羟甲基糠醛含量的影响Fig.4 Effect of reaction time (A) and temperature (B) on the content of 5-HMF of BSA-glucose system
2.5 丙烯酰胺含量的分析
本研究以峰面积为纵坐标(Y),丙烯酰胺的质量浓度为横坐标(X),绘制标准曲线:Y=456.58X-122.26(R2=0.998 4)。表明方程式的线性关系良好,可用于计算样品中丙烯酰胺的含量。
丙烯酰胺是MR的中间产物,在国际上被认为是一类食源性有毒物质。动物实验表明,丙烯酰胺对动物有神经毒性、生殖毒性,而且对啮齿类动物具有致癌性[24-25]。被国际癌症研究中心列为“人类可能的致癌物”[26]。反应时间和温度对样品中丙烯酰胺含量的影响如图5所示,延长反应时间和升高反应温度,均会增加样品中丙烯酰胺的含量(P<0.05)。且温度对丙烯酰胺形成的影响大于反应时间。当反应时间≤24 h,反应温度≤80 ℃时,样品中丙烯酰胺的含量明显增加,表明此时丙烯酰胺在大量生成并逐渐积累,但随着糖基化反应的持续进行,样品中丙烯酰胺的含量增加不明显,且无显著性差异(P>0.05),这和WEDZICHA等[27]报道的结果一致,这是因为丙烯酰胺本身降解或和其他物质发生反应导致其含量没有增加。丁晓雯等[11]研究也表明油条中丙烯酰胺的含量随着油炸时间和温度的增加呈先增加后下降的趋势,油炸温度为160~200 ℃,油炸时间为3~5 min时,油条中产生的丙烯酰胺最多(134.15 μg/kg)。因此,将反应温度和时间控制在60 ℃和12 h以内,可有效减少糖基化体系中丙烯酰胺的含量。

图5 反应时间(A)和反应温度(B)对BSA-葡萄糖体系中丙烯酰胺含量的影响Fig.5 Effect of reaction time (A) and temperature (B) on the content of acrylamide of BSA-glucose system
2.6 荧光性AGEs含量的变化
糖基化末端终产物(advanced glycation end products,AGEs)是指MR后期生成一类不可逆的有害糖基化终产物,主要是通过羰基化合物和氨基化合物经过复杂的反应生成荧光性AGEs。膳食是人体中AGEs的主要来源,AGEs在人体中的大量积累可导致糖尿病、尿毒症、动脉粥样硬化和阿尔茨海默症等疾病的发生[28-29]。如图6所示,当反应温度为55 ℃时,AGEs含量随着反应时间的延长呈先增加后下降的趋势,且在48 h达到最大值,约为6 h的4.6倍;当反应时间为12 h时,在50~80 ℃时,反应体系中AGEs含量大幅度增加,并在80 ℃达到最大值,约为50 ℃的12.8倍。表明随着反应时间的延长和反应温度的升高会促进糖类物质发生羟醛缩合生成羰基化合物,进而形成的AGEs也越多。但随着反应时间和反应温度的逐渐增加,样品的颜色加深,荧光值降低,这可能是在末期阶段中的羰基含量下降或荧光性AGEs逐渐生成了棕色的类黑精所致。根据房红娟等[12]的研究,BSA-葡萄糖模拟体系中AGEs含量也是随着加热时间的延长和加热温度的升高具有先增加后减少的趋势,表明荧光性AGEs聚合形成无荧光性的AGEs,并不是随着反应程度的加深而一直增加。在本次实验中,AGEs含量虽然在72 h和100 ℃有所下降,但此时反应体系中5-HMF和丙烯酰胺的含量较高。因此,将反应温度和时间分别控制在60 ℃和12 h以内,可有效减少糖基化体系中AGEs的生成,进而提高食品的安全性。

图6 反应时间(A)和反应温度(B)对BSA-葡萄糖体系中的荧光性AGEs生成的影响Fig.6 Effect of reaction time (A) and temperature (B) on the formation of fluorescent AGEs in BSA-glucose system
2.7 类黑精含量变化
类黑精是指MR后期生成的一种结构复杂的棕褐色高分子化合物,具有抗氧化、抗肿瘤、抗菌、降糖和降血压等生理功能[30]。由图7可知,BSA-葡萄糖样品中的类黑精含量随着反应时间的延长和反应温度的升高均呈现出先增加后下降的趋势(P<0.05)。反应时间和温度在12 h和60 ℃之内,糖基化体系中的类黑精含量增加缓慢,当反应时间和温度分别超过12 h和60 ℃时,其含量大幅度增加,分别在48 h(0.14 mmol/L)和80 ℃(0.10 mmol/L)达到最大值。这是因为类黑精的生成量与丙烯酰胺含量具有显著的相关性[31],由图5可知,糖基化体系中丙烯酰胺的含量在反应时间48 h和反应温度80 ℃时分别达到最高值。但当反应时间超过48 h,反应温度超过80 ℃时,类黑精含量显著下降,这可能是因为形成的部分大分子类黑精难溶于水,也有可能是温度过高或者长时间处理样品使部分类黑精发生裂解所致[16]。

图7 反应时间(A)和反应温度(B)对BSA-葡萄糖体系中类黑精含量的影响Fig.7 Effect of reaction time (A) and temperature (B) on the content of melanoidin of BSA-glucose system
3 结论
针对食品热加工过程中会形成有害糖基化产物的现状,本文旨在研究反应时间和反应温度的变化对糖基化产物形成的影响。结果表明,反应温度为55 ℃时,糖基化体系中的果糖胺、羰基、AGEs和类黑精含量随反应时间的延长呈先增加后下降的趋势,但5-HMF和丙烯酰胺含量逐渐增加;反应时间为12 h时,糖基化体系中的果糖胺、羰基、5-HMF、AGEs和类黑精含量随反应温度的升高呈先增加后下降的趋势,但丙烯酰胺含量逐渐增加。反应时间和反应温度分别超过12 h和60 ℃时,体系中的果糖胺、羰基、5-HMF、丙烯酰胺、AGEs和类黑精含量大幅度增加。因此,将反应温度控制在60 ℃以内,反应时间不超过12 h时,能有效减少BSA-葡萄糖体系中有害糖基化产物的产生,本研究结果可为高蛋白、高糖类食品在热加工过程中有害糖基化产物形成的调控提供一定的科学依据。

