不同干制方式对枸杞粉吸湿过程中水分变化的影响
徐昊,张喜康,颉向红,孔维洲,马浩然,刘敦华
(宁夏大学 农学院,宁夏 银川,750021)
枸杞(Lyciumchinensemiller)是一种茄科落叶小灌木的成熟果实[1],色泽鲜艳,果肉多汁,味酸甜。其含有丰富的功能活性物质,有较高的营养和药用价值,其中包括枸杞多糖、黄酮、类胡萝卜素和甜菜碱等,具有较好的抗氧化和免疫活性,因此枸杞也是一种“药食同源”的功能保健性食品[2]。但枸杞鲜果不耐储藏,室温下易腐烂变质,且存在产量高,成熟集中等特点,这导致枸杞鲜果在销售过程中,必须低温储藏,使得产品成本升高。为降低生产成本,大多枸杞以自然晒干的方式被制成干果保存并进一步加工,而加工成枸杞粉后,可以用作辅料添加到面包、糕点等食品中,提高食品的营养价值和附加值,并大大拓宽了枸杞的利用范围[3]。因此,枸杞制干后进一步加工成果干或者果粉成为其产业发展的一条重要途径。
近年来,随着枸杞市场的需求增大,新的制干方式被运用到枸杞加工中,包括太阳能干燥装置,微波干燥等,其中热风烘干和真空冷冻干燥[4]被广泛运用。由于各种干燥方式的原理及条件不同,最终所制得的枸杞粉性质也有所不同。TELIS等研究番茄脱水后发现,在干燥过程中,由于脱水速率太快,物质的结晶时间不够,会严重影响其干燥后的贮藏性[5]。更多研究也开始对粉体吸湿性质进行探索,刘华等对冻干后圣女果粉的水分吸附性质研究发现,冻干圣女果粉在25 ℃下的吸附等温线属于Ⅲ型等温线,并利用GAB模型来描述圣女果粉的吸附特性[6]。VIGANO等研究了菠萝粉在水分吸附过程中不同阶段熵/焓变所起的作用[7]。因此果蔬粉在吸湿过程中的水分变化研究对于其贮藏特性尤为重要,不同干制方式所获得的枸杞粉体在吸湿过程中的水分迁移变化及其吸湿特性还鲜有人研究。
因此本实验通过测定吸湿速率、吸湿增重及吸附等温曲线探讨枸杞粉的吸湿规律,利用低场核磁共振技术分析了不同干制方式下枸杞粉吸湿过程中的水分迁移特性,为更好地研究和改善枸杞粉体的贮藏及加工方法提供理论依据。
1 材料与方法
1.1 材料与试剂
枸杞鲜果,采于宁夏军马场枸杞园;食用碱面,南京甘汁园糖业有限公司;NaCl,天津市大茂化学试剂厂。
1.2 仪器与设备
智能水分活度仪(冠亚GYW-1),深圳市冠亚水分仪科技有限公司;分析天平(AL204),梅特勒-托利多仪器有限公司;康卫皿,北京广大恒益有限公司;真空冷冻干燥机(Free Zone 1.2 L),北京博医康实验仪器有限公司;鼓风干燥箱(DHG-9070A),上海一恒科学仪器有限公司;高速万能粉碎机(YB-700A),浙江永康市速锋工贸有限公司;核磁共振成像分析仪(NMR20),上海纽迈电子科技有限公司;生化恒温培养箱(LRH),上海一恒科学仪器有限公司;干燥器(Φ 250 mm),蜀牛玻璃仪器有限公司。
1.3 方法
1.3.1 样品处理
自然日晒:所采鲜果浸入50 g/L除蜡剂(NaCO3)后迅速捞出脱蜡,沥干,均匀摊开放在果栈上,并置于室内通风处(室温20~25 ℃)。待果实部分失水,便将其逐步转移至室外高温无遮处曝晒(室外温度30~33 ℃)。当枸杞中含水量低于8%时,得到干果样品,打粉后过80目筛备用。
热风干燥:脱蜡同上,沥干,均匀摊放在自制网眼硬纸板上于45 ℃烘箱内烘干,当枸杞中含水量达8%时,得到干果样品,打粉后过80目筛备用。
真空冷冻升华干燥:脱蜡同上,沥干,于-80℃的超低温冰箱预冻24 h,均匀平铺托盘上,冷肼温度为-35~-40 ℃,真空度为0~10 Pa,加热板温度为10~40 ℃(加热板温度初始值为10 ℃,每隔 1 h升温10 ℃直至40 ℃),当枸杞中含水量8%时,得到冻干果样品,打粉后过80目筛备用[8]。
1.3.2 样品吸潮条件
设置环境温度为30 ℃(恒温培养箱),环境湿度为75%(NaCl饱和盐溶液),吸湿30 d后进行试验。
1.3.3 水分活度的测定
在室温18~25 ℃,室内湿度50%~80%的条件下,用饱和氯化钠盐溶液校正水分活度仪。取样量为样品皿体积的2/3,将样品皿放入后封闭测量仓,进行测定,每间隔10 min记录水分活度仪的响应值,当相邻2次响应值之间误差小于0.005 Aw时为测定值。仪器平衡后,重复3次试验[9]。
1.3.4 含水率的测定
样品前处理:不同干燥方式所获得3种样品制粉后过40目筛网,放入干燥器中进行24 h平衡。
起始水分含量测定:参考GB 5009.3—2016,采用烘箱干燥法进行测定。
1.3.5 枸杞粉吸湿率的测定
称量干燥至恒重的称量瓶,记为m0。将样品粉末以5~9 mm厚铺展开并称重,记为m1。将上述称量瓶放置于25 ℃,75%相对湿度条件干燥器内,间隔一定时长称重,记录吸湿后质量m2′,m3′,…,mn′,以空称量瓶作为空白(吸湿前质量为m0″,吸湿后质量为m2″,m3″,…,mn″),计算枸杞粉吸湿质量m2,m3,…,mn。其中,mn=mn′-(mn″-m0″)。

(1)
式中:A,一定温度、湿度下的吸湿率,%。
1.3.6 吸附等温线的测定
根据参考文献[9]修改条件为:精确称取干燥至衡重的枸杞粉2 g,间隔24 h测定含水率和水分活度。
1.3.7 吸湿速率的测定
干燥称量瓶至恒重,记为M0,平铺2~3 g枸杞粉后称重,记为M1,将上述称量瓶至于恒温恒湿环境中平衡,每隔t(2 h)时间后称重,记录吸湿后质量为M2,M3直至平衡,平衡时质量为Mn,以空白称量瓶作为空白(吸湿前质量为Ma,吸湿后质量为M1,M2,M3,…,Mn),计算枸杞粉吸湿增重W2,W3,…,Wn。其中Wn=Mn-M0-(Mn-Ma)。一定温度、湿度下的吸湿速率Vn见公式(2):

(2)
1.3.8 低场核磁共振横向弛豫时间测定
利用核磁共振分析仪对粉体横向弛豫时间进行测定[10]。
测试条件:使用Carr-Purcell-Meiboom-Gill(CP-MG)脉冲序列测定横向弛豫时间T2,温度为30 ℃,主频SF=18 MHz,采样点TD=8192,90°脉冲时间P90=17 μs,180°脉冲时间P180=33 μs,重复扫描次数NS=16,采样间隔时间TW=1 500 ms,回波个数Echo Count=1 000,采样频率SW=200.00 kHz,弛豫衰减时间D0=1 000 ms。利用T2Fit软件进行反演拟合。
1.3.9 数据处理
SPSS 19.0、Excel 2003对试验数据进行统计,用Duncan程序进行显著性分析,P<0.05为差异显著,P<0.01为极显著,其中**表示差异极显著,*表示差异显著(P<0.05)。
2 结果与分析
2.1 枸杞粉吸湿规律分析
2.1.1 经不同干燥方式所获枸杞粉体的吸湿速率曲线
吸湿速率曲线是指样品回潮率随时间变化快慢的情况,如图1为3种不同干制方式下枸杞粉样品在环境温度为30 ℃,湿度为75%条件下的吸湿速率曲线。3种枸杞粉吸湿速率曲线趋势相近,可将其分为3个部分,为0~5 d,5~30 d和30~35 d,分别对应了样品吸湿的3个阶段,在第一阶段,吸湿速率较高,且随时间急速下降,在第二阶段,吸湿速率略低,且变化趋势较为缓和,在第三阶段,由于粉体内外蒸汽压趋向平衡[11],水分吸收趋于饱和,吸湿速率降低,逐渐趋于稳定,内外水分达到平衡。而第三阶段之后,粉体出现溶解现象,逐渐结块[12],霉变,对粉体品质影响较大,这可能是由于水分增加,激活部分氧化酶解反应,多糖有所消耗[13],分解出部分易溶于水的单糖[14],颗粒之间易黏连,也易滋生微生物[15]。由此可说明枸杞粉吸湿主要发生在第一阶段,部分发生在第二阶段。且还可以看出,3种方式所制的枸杞粉吸湿速率大小为晒干>烘干>冻干,相对来说冻干方式下的粉体吸湿性较差,反之则更利于储存。

图1 经不同干燥方式所获枸杞粉体的吸湿速率曲线Fig.1 Moisture absorption curve of Chinese wolfberry powder under different drying methods
2.1.2 不同干制方式下枸杞粉的吸附等温曲线
不同干制方式所获得的枸杞粉在30 ℃条件下的吸附等温线如图2所示。3种等温线中平衡含水率都随着水分活度的增加逐渐增大,在低于水分活度为0.5的区间,平衡含水率增加缓慢,而在高于0.5的区间,其上升幅度显著增大,同时真空冷冻干燥所获枸杞粉的平衡含水率变化与另外2种枸杞粉变化趋势存在差异,并且在同一水分活度下其水分含量更低。而不同干制方式下枸杞粉的吸湿等温线形状大致相同,据国际理论和应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)的分类,枸杞粉的吸附等温线形状为J型,属于Ⅲ型等温线[16]。这与ZHAO等对芒果吸附等温线的特性研究一致[17],分析其原因可能是由于不同干制方式下所获得的枸杞粉颗粒中存在大量微孔,水分穿过空隙被机械吸附于其上,因此其水分吸附能力主要受到微孔结构稳定性的影响[18]。经冻干后的枸杞打粉后,其内部结构致密,形成了更加稳定的微孔结构,使其吸湿性减弱[19]。另外出现J型水分吸附等温线可能是由于枸杞粉本属于富糖类产品,而多糖类物质在水中又具有较高的溶解性所导致的结果[20]。

图2 经不同干燥方式所获枸杞粉体的吸附等温曲线Fig.2 Adsorption isotherm curve of Chinese wolfberry powder under different drying methods
2.2 枸杞粉吸湿过程中水分的核磁共振测定
枸杞粉中水分的存在形式可分为3种,即结合水、不易流动水和自由水,3种水分的含量和存在状态会影响枸杞粉的品质和贮藏性[21]。通过核磁共振技术原理可知,其主要以氢质子为研究对象,氢质子所处的化学环境不同,T2弛豫时间的长短也不相同,而其化学环境又与氢质子所受的束缚力及其自由度有关[22]。在枸杞粉吸湿过程中,氢质子主要存在于不同形式的水中,因此可利用反演谱T2横向弛豫时间与横向弛豫总积分面积的关系曲线来间接反映水分的自由度,含量以及迁移行为,从而表征出粉体在吸湿过程中的水分变化特征[23]。
不同干燥方式所制得的枸杞粉吸湿过程中水分变化T2弛豫时间反演谱如图3所示,横坐标代表横向弛豫时间T2,值越小代表此种水分与非水组分结合力越大,值越大代表水分的流动性越大,越容易排出[24-25]。从图3可以看出,枸杞粉的反演图谱在T21(0.01~1 ms)、T22(1~10 ms)和T23(10~1 000 ms)3个区间内分别出现3个分界明显的峰,可以反映粉体吸湿过程中水分的3种存在状态。其中弛豫时间最短的T21被定义为结合水,这部分水与其他分子的极性基团结合最紧密。弛豫时间为T22的定义为不易流动水,其间接与大分子结合或直接与强结合水以氢键结合,紧密性仅次于结合水。弛豫时间最长的T23被定义为自由水,这部分水主要为结构水和体积水,具有水溶液中的水分子流动性[26-27]。
随着吸湿时间的延长,3种不同干制方法下的枸杞粉弛豫面积均有所增加,其中,晒干与烘干方式下的枸杞粉反演谱图趋势变化相似,结合水与不易流动水的相对含量在前5 d略有增加但变化不明显,在5~30 d,结合水相对含量急剧增加,而不易流动水均在15~30 d急剧增加;冻干方式下的枸杞粉结合水与不易流动水的相对含量在前15 d略有增加但变化不明显,15 d以后急剧增加。因此可能存在以下2种原因,一方面,粉体在吸潮过程中,其内部极性基团与外界水分子结合形成紧密的结合水,进而在饱和后以氢键结合的方式与大分子物质以及化合类结合水联结,形成邻近结合水或不易流动水,使粉体呈结块状。另一方面,可能是由于在枸杞烘干或晒干过程中,由于氧气和温度等的原因促使大分子物质,诸如多糖、蛋白质等发生降解,暴露氨基,羟基等亲水极性基团[28],使得环境水分子更易结合成结合水或不易流动水,以及小部分结合水向不易流动水发生了转变,而与之相比,冻干方式由于操作时间短,其大分子几乎不发生降解[29],前期结合水和不易流动水变化相对较小,而由于其多孔结构,在后期与环境中水分子结合表面积增大,使得其结合及吸水能力增强。

A-冻干;B-烘干;C-晒干图3 不同干燥方式下的枸杞粉T2弛豫时间反演谱Fig.3 The inversion diagram of transverse relaxation timeT2 of wolfberry powder obtained by three kinds of drying methods
横向弛豫时间T2可以表达水分所处的物理状态[30]。如表1、2和3所示,3种枸杞粉吸潮过程中不同状态水的横向弛豫时间变化。在吸湿0~15 d时3种枸杞粉T21值均有所下降,差异显著(P<0.05),在15~30 dT21值增大,差异显著(P<0.05),其中冻干方式所获得的枸杞粉T21值均大于其他2种方式。冻干、烘干和晒干枸杞粉结合水在0~30 d,水分子的自由度先降低后升高。这说明部分生物大分子可能发生了氧化酶解等反应,致使部分邻近结合水向化合类结合水转移,结合程度增大,离非水组分较近,自由度降低,随后又发生了反向转移,结合度下降,自由度增大。
3种枸杞粉在吸湿过程中,T22值均先增大后减小,在吸湿0~5 d时,T22值显著增大(P<0.05);当处于15~30 d,T22值显著降低(P<0.05)。由此说明,在吸潮前期,不易流动水结合力越来越弱,吸潮后期,不易流动水结合力增强。由表3看出,自由水在3种干燥方式所得枸杞粉中弛豫时间值在0~30 d都有所增加,冻干方式所获得枸杞粉T23值在0~5 d显著增加,5~30 d时几乎不发生变化(P>0.05),烘干枸杞粉T23值增加到15 d时就几乎不发生变化,而晒干枸杞粉前15 d的T23值几乎不发生变化,在30 d时显著增加(P<0.05)。自由水的自由度增大可能是由于不易流动水的转变以及表面吸附水和孔隙水的增多,直至饱和,而冻干方式所获样品,由于孔隙较密,较易吸附空气中水分,因此较早达到饱和[31]。
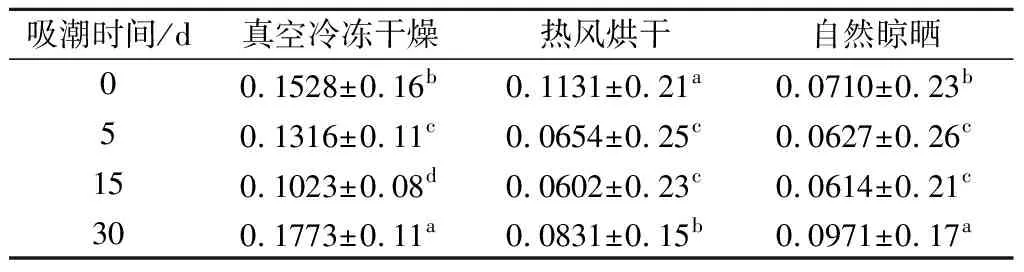
表1 枸杞粉吸潮过程中T21值变化Table 1 Change of T21 value in the course of moistureabsorption of Chinese wolfberry powder
注:表中同列不同小写字母表示差异性显著(P<0.05),表2、3同。

表2 枸杞粉吸潮过程中T22值变化Table 2 Change of T22 value in the course of moistureabsorption of Chinese wolfberry powder

表3 枸杞粉吸潮过程中T23值变化Table 3 Change of T23 value in the course of moistureabsorption of Chinese wolfberry powder
3 结论
通过3种不同干燥方式所获枸杞粉的吸湿等温线的类型均为J型,属于Ⅲ型等温线。当其水分活度大于0.5时,在同一水分活度下,平衡含水率的大小为晒干>烘干>冻干,而在冰点温度以上,水分活度低于0.5时,枸杞粉的吸湿稳定性更好,较易储存;同时,相较于其他2种干制方式,冻干方式所制得的粉体相对不易吸湿,更利于储存。
通过利用低场核磁共振技术测定横向弛豫时间,根据T2弛豫反演谱的多组分特征和粉体内部水分特性,将枸杞粉吸湿过程中的水分存在形式划分为结合水、不易流动水和自由水;其中结合水响应值随着吸潮的进行,先下降后上升;不易流动水响应值先上升后下降,自由水响应值呈上升。而结合水和不易流动水的横向弛豫峰面积增大,自由水峰面积几乎不变,这说明吸湿期间不易流动水和结合水含量增加,自由水含量几乎不变。其中不易流动水所占比例最大,自由水含量最少。由此发现,枸杞粉在吸湿过程中,水分迁移主要发生在结合水和不易流动水之间,同时结合水内部也在邻近水和化合水之间相互转化,自由水未发生明显变化,可能是因为枸杞粉吸湿过程中由于大分子物质,诸如多糖、蛋白质等在氧气、水分及温度的作用下发生酶促降解,使得环境水分子及小部分结合水向邻近结合水结合和转变。也同时证明了在吸湿15 d前,冻干方式所获得的枸杞粉吸湿性更稳定。

