普洱茶挥发性组分的抗癌、抗炎功能特性
, ,,, ,,,
(华南农业大学食品学院,广东广州 510642)
普洱茶是以地理标志保护范围内的云南大叶种晒青茶为原料,采用特定的加工工艺制成,具有独特品质特征的茶叶[1]。普洱茶因具有抗肿瘤[2]、抑菌[3]、抗氧化[4]、减肥[5]、降血糖[4]等多种功效和独特的陈香品质[6],而备受研究人员关注和广大消费者喜爱。近年来,普洱茶香气的研究主要集中于成分提取和组成分析。香气提取的方法主要有同时蒸馏萃取法、顶空固相微萃取法、减压蒸馏萃取法、超声波或微波辅助萃取法[7]。刘玲[8]、吕海鹏[9]等研究表明,萜烯类和甲氧基苯类物质是普洱茶中最主要的香气成分。而对其功能特性,仅任洪涛等[10]通过化学抗氧化法研究发现,普洱茶挥发性组分具有清除DPPH自由基和Fe3+还原能力。而基于体外细胞系水平的抗癌、抗炎等功能特性的研究尚未见报道。
因此,本研究以云南大叶种加工的普洱茶为材料,采用同时蒸馏萃取法(SDE)初提普洱茶挥发性组分,进而通过化学法和薄层层析法(TLC)分离,采用GC-MS分析鉴定这些挥发性组分的组成和含量,以小鼠肝癌细胞Hepa1c1c7诱导的高醌还原酶(quinone reductase,QR)活性和小鼠巨噬细胞RAW264.7检测的高NO抑制率为指标,筛选普洱茶挥发性组分中具有较强抗癌、抗炎活性的组分。最终采用小鼠肝癌细胞Hepa1c1c7、人结肠癌细胞HCT116、人肝癌细胞HepG2、人乳腺癌细胞MDA-MB-231四大癌症模型和小鼠巨噬细胞RAW264.7炎症模型分别评价主要挥发性单体的抗癌、抗炎活性,以期为普洱茶挥发性组分的功能特性研究及进一步的开发利用提供理论研究基础。
1 材料与方法
1.1 材料与仪器
云南大叶种普洱茶 广东省茶叶进出口公司;小鼠肝癌细胞Hepa1c1c7、小鼠巨噬细胞RAW264.7 美国模式培养物储存库(ATCC);人结肠癌细胞HCT116、人肝癌细胞HepG2和人乳腺癌细胞MDA-MB-231 中国科学院细胞库;四甲基偶氮唑篮(MTT)、甲萘醌、6-磷酸葡萄糖、6-磷酸葡萄糖脱氢酶、洋地黄皂苷、脂多糖(LPS)、台盼蓝、结晶紫、二甲基亚砜(DMSO)、1,2,3-三甲氧基苯(≥98%)、1,2,4-三甲氧基苯(≥97%)、1,2-二甲氧基苯(≥99%)、β-紫罗酮(≥97%)、α-松油醇(≥99%)、叶绿醇(≥95%)、植酮(≥97%) Sigma公司;α-MEM培养基、胰蛋白酶、胎牛血清(FBS)、青霉素和链霉素、DPBS Gibco公司;牛血清白蛋白(BSA) 北京普博欣生物科技有限公司;DMEM(无酚红)培养基 GluMax Hyclone公司;活性炭(分析纯) 天津科密欧有限公司;薄层层析板GF254青岛谱科试剂有限公司;细胞培养瓶 Nunc公司;Coster 96孔细胞培养板 Corning公司;二氯甲烷、甲醇、吐温-20、碳酸钠、氢氧化钠、盐酸、硫酸 均为国产分析纯。
同时蒸馏萃取装置 北京百晶生物科技有限公司;薄层色谱展开缸 广州市丛源仪器有限公司;VersaMax酶标仪BNR 06346 美国Molecular Devices公司;GC-MS-QP 2010 Ultra Shimadzu公司;Centrifuge 5804R离心机 德国Eppendorf公司;CKX31显微镜 日本Olympus公司;HERAcell 150i CO2培养箱 美国Thermo公司;HH2型恒温水浴锅 国华电器有限公司;BT25S电子分析天平 瑞士Mettle Toledo公司;HSC-12B氮吹仪 天津恒奥发展有限公司;Mili-Q Integral 3超纯水机 德国Merk-Milipore公司;SW-CJ-2FD超净工作台 苏州净化设备有限公司;2E-170557涡旋混合仪 江苏麒麟医用仪器厂。
1.2 实验方法
1.2.1 SDE法提取普洱茶挥发性组分 采用SDE法[11],将普洱茶样品磨碎,过20目筛,称取50 g,加入320 mL蒸馏水,置于1 L圆底烧瓶中,连接于SDE装置的一端,用电热套进行加热,使水保持沸腾;另一端连接装有二氯甲烷的圆底烧瓶,恒温水浴锅加热,温度设置为50 ℃;两端同时加热萃取2 h;富集萃取液,氮气吹干二氯甲烷,得到普洱茶初提组分,置于-20 ℃保藏备用。
1.2.2 化学法分离普洱茶初提组分 参照王佐[12]的方法。将1.2.1提取得到的含普洱茶初提组分的二氯甲烷溶液采用化学法分离,得到普洱茶中性组分、酸性组分和碱性组分。其流程见图1。

图1 化学法分离普洱茶初提组分Fig.1 The isolation procedures of volatile components in Pu-erh tea by chemical method
1.2.3 薄层层析法分离普洱茶中性组分及F6组分 在通过SDE法初提、化学法分离的基础上,本研究用薄层层析硅胶板GF254对同时具有抗癌、抗炎活性的普洱茶中性组分进行进一步分离。将1.2.2处理得到的中性组分溶于二氯甲烷中,毛细管点样,用含0.3%甲醇的二氯甲烷溶液作展开剂,在层析缸中展开至薄层板顶部约1 cm处取出,紫外灯下观察并标出条带区,共6条,标记为F1、F2、F3、F4、F5和F6,分条带刮下硅胶粉,溶于二氯甲烷,静置10 h左右,吸取上清液,氮气吹干二氯甲烷,置于-20 ℃保藏备用,将具有较强抗癌活性的F6组分按照中性组分的薄层层析条件进行分离,得到F6-1,F6-2,F6-3,F6-4,置于-20 ℃保藏备用。
1.2.4 GC-MS分析条件 参照王佐[12]的方法,将通过细胞模型筛选到的抗癌或抗炎功能较强的初提组分、中性组分、F6、F6-2组分进行GC-MS分析。将各色谱峰通过人工解析和计算机检索(NIST图谱库)进行定性分析,用面积归一法进行定量分析,以各组分的峰面积占总峰面积的百分比表示组分的相对含量。
GC条件:HP-INNOWAax弹性石英毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度为230 ℃;载气为高纯氦气,纯度>99.999%,流速2 mL/min;起始柱温40 ℃,保持2 min,以3 ℃/mim升至110 ℃,保持2 min,以5 ℃/min升至170 ℃,保持2 min,再以10 ℃/min升至230 ℃,保持1 min,不分流进样。
MS条件:离子源EI,电子能量为70 eV,电子倍增器电压350 V,质量扫描范围35~335 m/z。
1.2.5 普洱茶初提组分及其分离组分抗癌、抗炎活性评价 参照王佐[12]的方法。小鼠肝癌细胞Hepa1c1c7经解冻复苏后,培养于37 ℃、5% CO2培养箱中。培养基为89%的α-MEM培养基、10%的胎牛血清(55 ℃热处理)、1%青霉素(100 U/mL)/链霉素(100 μg/mL)。胰蛋白酶消化细胞,每隔3~4 d继代一次。
小鼠巨噬细胞RAW264.7经解冻复苏后,培养于37 ℃、5% CO2培养箱中。培养基为88%不含酚红的DMEM高糖培养基、10%胎牛血清、1%青霉素(100 U/mL)/链霉素(100 μg/mL)和1% GlutaMAX添加剂。用细胞刮刀刮下细胞,每隔2~3 d继代一次。
1.2.5.1 抗癌活性评价 QR是二相解毒酶的一种,小鼠肝癌细胞Hepa1c1c7诱导QR活性的模型被广泛应用于抗癌活性物质的筛选。参照Prochaska[14]的方法。取Hepa1c1c7细胞接种于96孔板,2.5×104个/mL,每孔200 μL,于37 ℃、5% CO2培养箱中培养24 h;弃去旧培养液,每孔添加150 μL溶于含0.5% DMSO培养基的普洱茶初提组分或其分离组分(样品浓度选择在使Hepa1c1c7细胞活力>0.5的浓度范围内)。加样后继续培养48 h;弃去旧培养液,每孔加50 μL洋地黄皂苷(含2 mmol/L EDTA溶液),37 ℃恒温摇床振荡40 min;每孔加200 μL QR酶液,测定490 nm波长下10 min内吸光值变化的动力学曲线,计算QR活性。另备一96孔板,按同样方法接种细胞和加样,培养48 h后弃掉旧培养液,结晶紫溶液染色15 min,弃去;SDS(0.5%)溶解1 h,用酶标仪测定610 nm吸光值,计算细胞活力。
以细胞活力(cell viability,CV)>0.5,相对QR活性≥2,作为样品具有QR诱导活性的筛选指标。将相对QR活性=2时,对应的样品浓度定义为CD值,CD值越小,抗癌活性越强。

1.2.5.2 抗炎活性评价 NO是机体炎症反应中的重要的促炎因子之一,限制过量的NO生成是抑制炎症反应的重要指标之一。参照Wang等[15]和Hsieh等[16]的方法。取RAW264.7细胞接种于96孔板中,5×105个/mL,每孔200 μL,于37 ℃、5% CO2培养箱中培养24 h;弃掉旧培养液,添加溶于含0.5% DMSO培养基的普洱茶初提组分或其分离组分(样品浓度设置在使RAW264.7细胞活力>50%的浓度范围内),再添加100 μL LPS(终浓度为1 μg/mL),混匀,继续培养24 h;取出96孔板,每孔吸取100 μL上清液转移至新96孔板中,加入等体积Griess试剂,反应10 min,酶标仪测定542 nm处吸光值,计算NO抑制率。将旧96孔板中剩余培养液弃掉,每孔加100 μL MTT溶液(0.05 μg/mL),置于37 ℃培养箱中培养1 h,小心吸去MTT溶液,每孔加入200 μL DMSO溶液,37 ℃恒温摇床振荡15 min,酶标仪测定550 nm处吸光值,计算细胞活力。以细胞活力>50%,NO抑制率≥50%,作为样品具有抗炎活性的筛选指标。


人结肠癌细胞HCT116、人肝癌细胞HepG2、人乳腺癌细胞MDA-MB-231培养参照Mosmann[13]的方法。经解冻复苏后,培养于37 ℃、5% CO2培养箱中。培养基为89%的DMEM培养基(含酚红)、10%胎牛血清及1%青霉素(100 U/mL)/链霉素(100 μg/mL)。胰蛋白酶消化细胞,每隔2~3 d继代一次。MTT比色法参照Mosmann[13]的方法。取人结肠癌细胞HCT116、人肝癌细胞HepG2、人乳腺癌细胞MDA-MB-231,接种于96孔板中,5×104个/mL,每孔100 μL,置于37 ℃、5% CO2培养箱中培养24 h;取出培养板,弃掉旧培养液,添加不同浓度的单体(浓度设置为800、600、400、200、100、50 μg/mL),每孔100 μL,混匀后继续培养24 h;取出培养板,吸去旧的培养液,每孔添加100 μL含0.25 mg/mL MTT的新鲜培养液(不含血清),置于37 ℃培养箱中培养2 h;吸去旧培养液,每孔添加DMSO液体200 μL,置于37 ℃的恒温摇床中振荡15 min;15 min后取出培养板,550 nm波长下测定吸光值,计算细胞增殖抑制率。

1.3 数据分析
所有实验平行3次,重复2~3次,采用Origin 9.0拟合计算细胞增殖抑制率的IC50值、NO抑制率的IC50值以及CD值。
2 结果与分析
2.1 普洱茶初提组分的抗癌、抗炎活性
为探究普洱茶挥发性组分的抗癌、抗炎活性,本研究采用SDE法初提普洱茶挥发性组分,通过小鼠肝癌细胞Hepa1c1c7模型测定诱导QR活性和小鼠巨噬细胞RAW264.7模型测定NO抑制率,结果如图2~图3所示。

图2 普洱茶挥发性初提组分诱导QR活性Fig.2 QR inducing activity of crude aroma extracted from Pu-erh tea
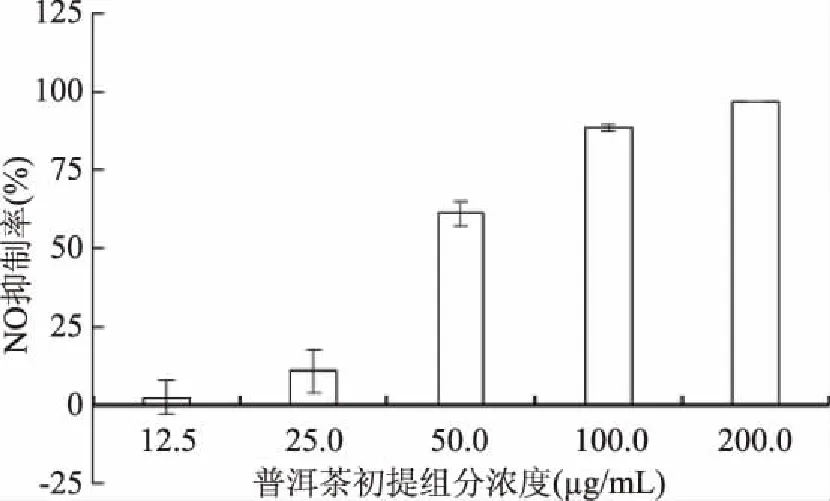
图3 普洱茶挥发性初提组分NO抑制率Fig.3 NO inhibitory activity of crude aroma extracted from Pu-erh tea
从图2可知,普洱茶挥发性初提组分在样品浓度为6.25~50.00 μg/mL范围内,小鼠肝癌细胞Hepa1c1c7的细胞活力>0.5,相对QR活性随样品浓度的增加而增大,通过Origin拟合,得到其CD值为28.07 μg/mL,说明其具有抗癌活性。
普洱茶挥发性初提组分在样品浓度为12.5~200.0 μg/mL内,小鼠巨噬细胞RAW264.7的细胞活力>50%。由图3可知,NO抑制率随样品浓度的增加而增大,通过Origin拟合,得到其IC50值为51.68 μg/mL,表明其具有抗炎活性。
再举一个例子 ,“the dog that will fetch a bone will carry a bone”,当它被翻译成中文时,狗和骨头不能按字面翻译,所以需要翻译其隐含义:“说别人坏话的人,也会说你的坏话”。
上述结果表明,普洱茶挥发性初提组分在样品浓度<51.68 μg/mL时,同时具有抗癌和抗炎活性。
2.2 普洱茶挥发性初提组分化学分离产物的抗癌、抗炎活性
为进一步追踪抗癌、抗炎活性组分,本研究进而采用化学法分离普洱茶SDE初提挥发性组分,得到中性、酸性和碱性组分,其诱导QR活性和抑制NO的结果如图4~图5所示。

图4 普洱茶中性、酸性、碱性组分诱导QR活性Fig.4 QR inducing activity of neutral,acid and alkaline components isolated from Pu-erh tea注:A;中性组分;B:酸性组分;C:碱性组分。
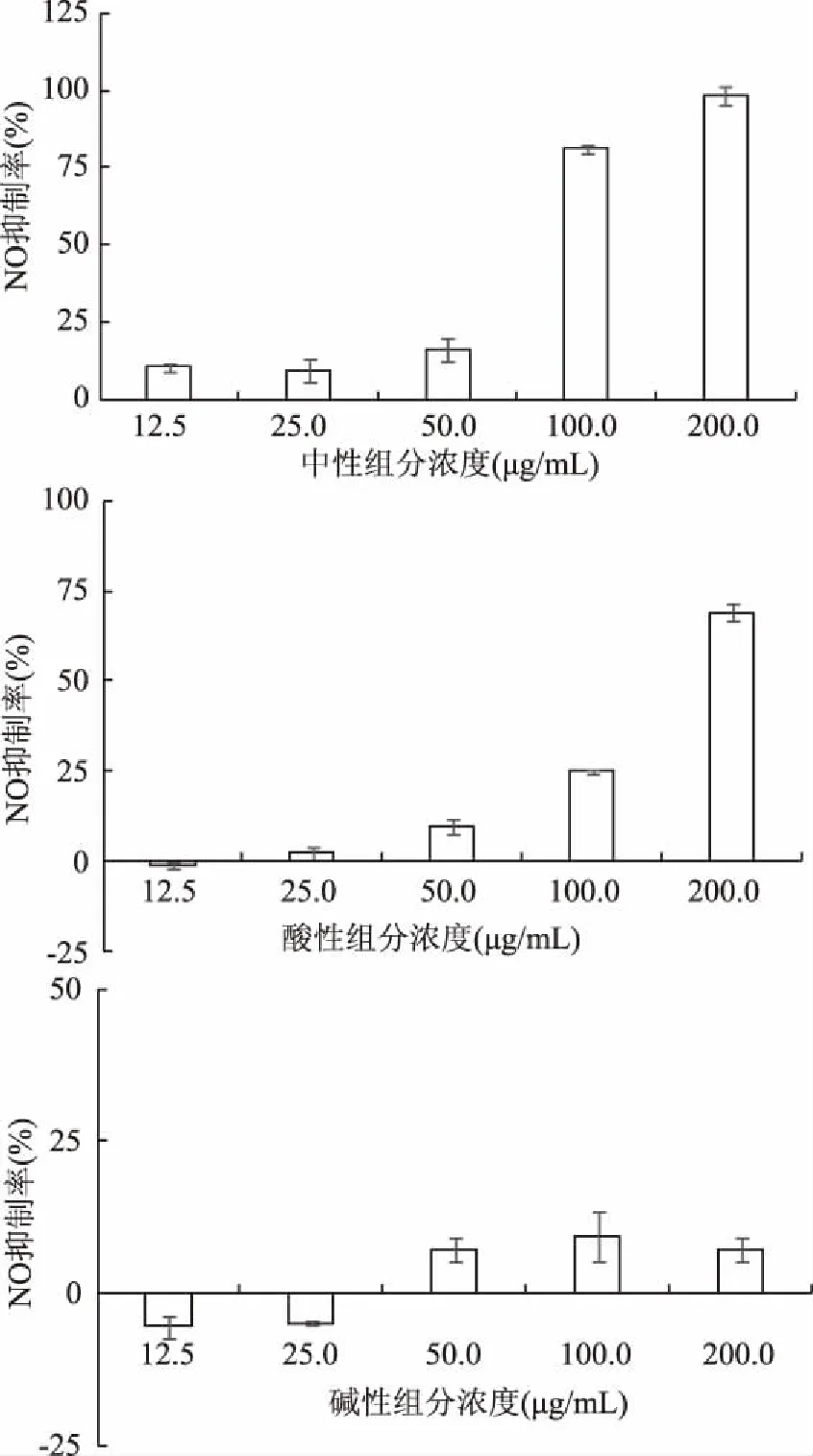
图5 普洱茶中性、酸性、碱性组分对RAW264.7细胞NO抑制率的影响 Fig.5 The NO inhibitory activity of neutral,acid and alkaline components isolated from Pu-erh tea evaluated by RAW264.7 cell model注:A:中性组分;B:酸性组分;C:碱性组分。
从图4结果可知,普洱茶中性分离组分在3.125~50.000 μg/mL的样品浓度范围内,小鼠肝癌细胞Hepa1c1c7的细胞活力>0.5,相对QR活性随样品浓度的增加而增大,其CD值为45.31 μg/mL,表明其具有较强的抗癌活性。普洱茶酸性和碱性分离组分,在3.125~50.000 μg/mL的样品浓度范围内,未能诱导QR活性倍增。将其最高浓度扩大1倍,即在100 μg/mL条件下,虽然小鼠肝癌细胞Hepa1c1c7的细胞活力>0.5,但其相对QR活性仍小于2,表明普洱茶酸性、碱性组分在此浓度范围内,未显示抗癌活性。
普洱茶化学法分离的中性、酸性和碱性组分在样品浓度为12.5~200.0 μg/mL的范围内,小鼠巨噬细胞RAW264.7的细胞活力均>50%。由图5可知,中性组分抑制NO的IC50值为73.32 μg/mL,酸性组分为151.92 μg/mL,但碱性组分的NO抑制率未达到50%。说明中性和酸性分离组分仍保持了较强的抗炎活性,而碱性组分未显示抗炎特性。
综上结果可知,普洱茶挥发性初提组分经化学法分离的中性、酸性和碱性3种产物中,只有中性组分同时具有诱导QR的抗癌活性和抑制NO的抗炎活性,其CD值为45.31 μg/mL,抑制NO的IC50值为73.32 μg/mL;酸性组分仅具有一定的抗炎活性,而未显示抗癌活性,其抑制NO的IC50值为151.92 μg/mL;而碱性组分在实验浓度范围内,均未显示抗癌、抗炎功能活性。
2.3 普洱茶中性组分TLC分离产物抗癌、抗炎活性
通过TLC法对同时具有抗癌、抗炎活性的普洱茶中性组分进行分离,得到F1~F6,对这6个组分进行抗癌功能特性研究,其诱导QR活性的结果如图6~图7所示。
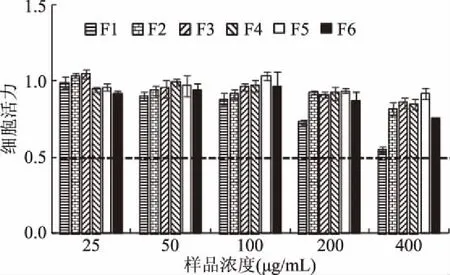
图6 普洱茶中性组分TLC分离组分对Hepa1c1c7细胞活力的影响Fig.6 Inhibitory effect of components isolated from neutral component of Pu-erh tea by TLC method against Hepa1c1c7 cell growth

图7 普洱茶中性组分TLC分离组分诱导QR活性Fig.7 QR inducing activities of components isolated from neutral component of Pu-erh tea by TLC method
由图6~图7可知,在25~400 μg/mL样品浓度范围内,细胞活力>0.5,F1~F5组分均未能诱导QR活性达到倍增,未显示抗癌活性;F6组分在25 μg/mL时的相对QR活性>2,具有较强的抗癌活性。进一步研究,由图8可知,通过Origin拟合,得到其CD值为12.8 μg/mL,表明此分离组分的抗癌活性强于初提和中性挥发性组分。

图8 普洱茶中性组分TLC分离F6组分诱导QR活性Fig.8 QR inducing activities of F6 isolated from neutral component of Pu-erh tea by TLC method
普洱茶中性挥发性组分TCL分离的6个组分,采用小鼠巨噬细胞RAW264.7炎症模型分析,在25~400 μg/mL的样品浓度范围内,其细胞活力虽>50%,但NO抑制率均未达到50%的抗炎指标,未显示抗炎活性(本文未列出)。
在一级TLC分离及抗癌、抗炎功能活性筛选的基础上,本研究进而选择具有较强诱导QR活性的F6组分,进行二级TLC分离,经紫外观察发现,其分离出4个组分,命名为F6-1~F6-4。将此4个组分进行抗癌活性测定,其诱导QR活性结果如图9~图10所示。

图9 普洱茶挥发性组分F6的TLC分离组分对Hepa1c1c7细胞的增殖抑制作用Fig.9 Inhibitory effect of components isolated from F6 in Pu-erh tea by TLC method against Hepa1c1c7 cell growth
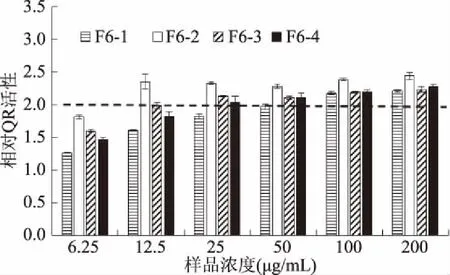
图10 普洱茶挥发性组分F6的TLC分离组分诱导QR活性Fig.10 QR inducing activities of components isolated from F6 in Pu-erh tea by TLC method
由图9~图10可知,普洱茶挥发性组分F6二级TLC分离的4个组分,在6.25~200.00 μg/mL的样品浓度范围内,小鼠肝癌细胞Hepa1c1c7的细胞活力>0.5,4个组分均可诱导QR活性倍增,依CD值由小到大依次为:F6-2:15.12 μg/mL,F6-4:34.12 μg/mL,F6-3:41.35 μg/mL,F6-1:54.51 μg/mL。此结果说明,这4个二级TLC分离产物均具有抗癌活性,其中F6-2的抗癌活性最强,且与一级TLC分离的F6抗癌活性相当。
2.4 GC-MS分析普洱茶挥发性组分
在系统追踪普洱茶挥发性组分抗癌、抗炎功能活性物质的同时,为探究各组分的物质组成,本研究采用GC-MS技术,对相关挥发性组分的组成和相对含量进行分析鉴定。
2.4.1 普洱茶挥发性初提组分和中性组分的组成及含量分析 普洱茶挥发性组分的抗癌、抗炎研究结果表明,其初提组分和化学分离的中性组分同时具有较强的抗癌、抗炎活性,对其通过GC-MS进行分析,2个组分的挥发性物质组分种类和含量结果如表1~表2所示。
由表1可知,普洱茶挥发性组分的数量,初提组分共鉴定出99种成分,化学分离的中性组分共鉴定出93种成分;按照化合物类别,初提和中性挥发性组分均归属于9类,从相对含量由多到少依次为:杂氧化合物、醇类、醛类、酮类、烷烃类、酯类、含氮类、酚类和酸类,表明初提与中性挥发性组分的化合物类别相对含量占比变化趋势一致。进而对普洱茶挥发性初提组分和中性组分中含量≥1%的物质组成进行分析,结果见表2。

表2 普洱茶挥发性初提组分和中性组分的主要组成(≥1%)Table 2 The main components of crude aroma and neutral component in Pu-erh tea(≥1%)
由表2可知,普洱茶挥发性初提组分和中性组分相对含量≥1%的成分及相对含量占比变化趋势完全一致。其中杂氧类主要为1,2,3-三甲氧基苯、1,2-二甲氧基苯和1,2,4-三甲氧基苯;酮类为植酮和β-紫罗酮,醇类为叶绿醇和α-松油醇,醛类为苯甲醛,其中1,2,3-三甲氧基苯在初提组分和中性组分中的相对含量均最高,分别为16.84%和13.54%。
2.4.2 普洱茶TLC分离挥发性组分的组成及含量分析 普洱茶中性挥发性组分经TLC分离获得的F6及其二级分离组分F6-2具有较强的抗癌活性,对其通过GC-MS进行的组成和相对含量分析结果如表3和表4所示。

表4 普洱茶TLC分离挥发性组分的主要组成(≥5%)Table 4 The main components of TLC products isolated from Pu-erh tea(≥5%)
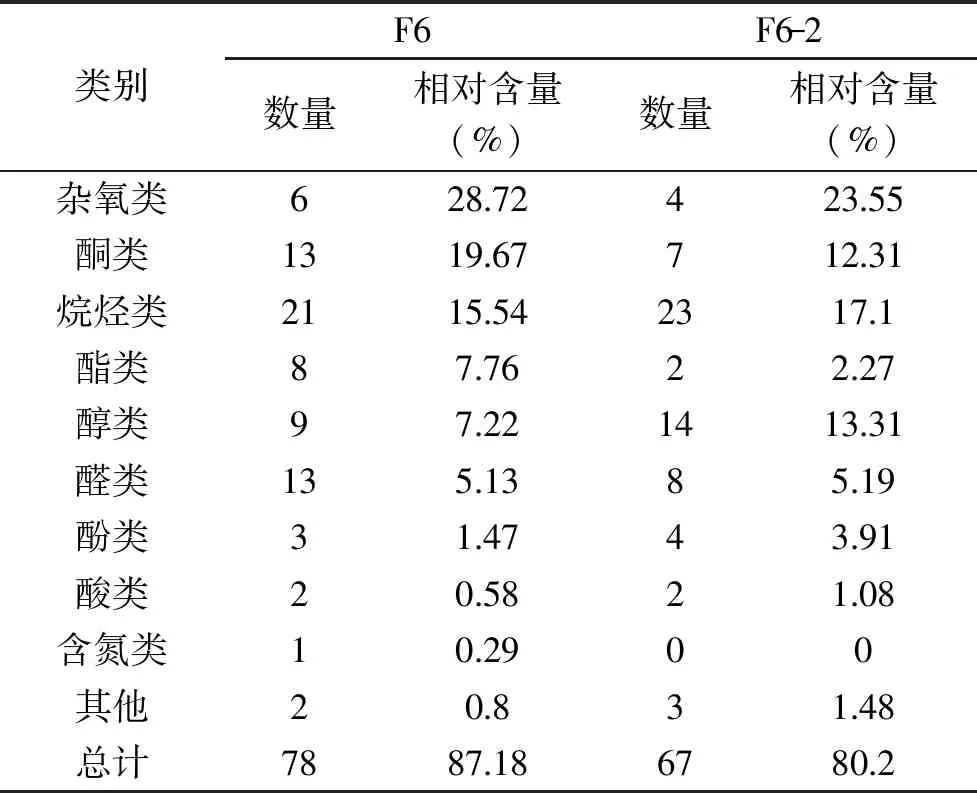
表3 普洱茶TLC分离挥发性组分的种类及含量Table 3 The classes and their relative contents of TLC products isolated from Pu-erh tea
由表3可知,从普洱茶中性组分TLC分离的F6组分中共鉴定出78种挥发性成分,从F6-2组分中共鉴定出67种挥发性成分。这两个组分的化合物归属于10个类别,除酯类、醇类和其他类物质外,其余挥发性化合物的相对含量和占比变化趋势均一致。
从表4可知,F6和F6-2作为抗癌活性最强的TLC分离产物,其相对含量≥5%的物质主要有,杂氧化合物:1,2,3-三甲氧基苯、1,2,4-三甲氧基苯等;酮类物质:植酮、四氢-2,2,6-三甲基-6-乙烯基-3-吡喃酮、4-(2,6,6-三甲基-2-环己烯-1-亚基)-2-丁酮等。
2.5 挥发性单体物质的抗癌、抗炎活性
由表5结果可知,这7种存在于普洱茶中的挥发性单体物质对人结肠癌细胞HCT116、人肝癌细胞HepG2和人乳腺癌细胞MDA-MB-231都有一定的增殖抑制作用,其中植酮对这3种癌细胞的IC50值皆>800.00 μg/mL,抗癌活性较弱;其余6种单体物质对人结肠癌HCT116细胞的IC50值小于其他两种细胞的IC50值,即对HCT116细胞的增殖抑制效果最强。β-紫罗酮在7种物质中,对4种癌细胞均表现出最强的抗癌活性,其中对Hepa1c1c7细胞的抗癌活性最强,其CD值为17.10 μg/mL。具有抗炎活性的单体为1,2,3-三甲氧基苯、1,2,4-三甲氧基苯、1,2-二甲氧基苯和β-紫罗酮,抗炎活性由强至弱为:1,2,4-三甲氧基苯:97.11 μg/mL、1,2,3-三甲氧基苯:134.99 μg/mL、β-紫罗酮:152.79 μg/mL、1,2-二甲氧基苯:169.62 μg/mL。综合可知,3种甲氧基苯类物质具有较强的抗炎活性。
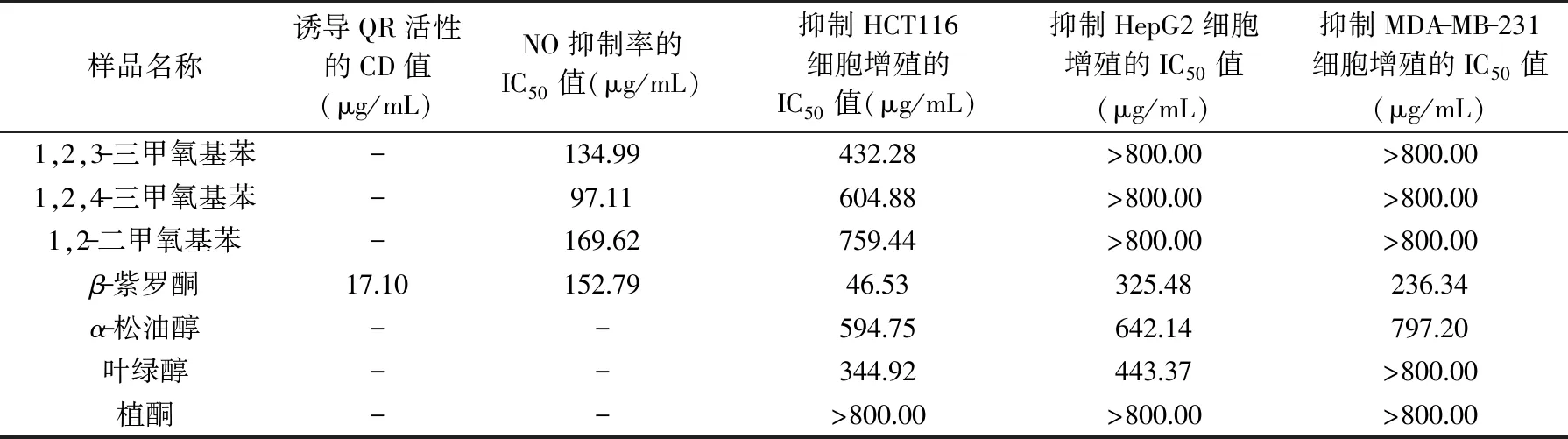
表5 挥发性单体物质的抗癌、抗炎活性Table 5 Anti-cancer and anti-inflammatory activities of main monomers in Pu-erh tea
上述研究结果说明,存在于普洱茶挥发性组分中的β-紫罗酮是普洱茶发挥抗癌、抗炎作用的主要物质组成之一。前人的研究已证明,β-紫罗酮是一种广泛存在于天然食物中的类异戊二烯成分[17],能够抑制多种癌细胞的增殖,具有抗癌、抗炎等多种生物活性。β-紫罗酮作用于前列腺癌细胞PC-3的IC50值为130 μmol/L[18],作用于结肠癌细胞HCT116的IC50值为60 μmol/L[19],作用于BV2细胞的抗炎活性在17 μmol/L时,抗炎活性的NO抑制率达到50%[20]。
本研究发现,存在于普洱茶挥发性组分中的1,2,3-三甲氧基苯、1,2,4-三甲氧基苯、1,2-二甲氧基苯等甲氧基苯类物质具有较强的抗炎和一定的抗癌活性。吕海鹏等[9]研究认为:1,2,3-三甲氧基苯、1,2,4-三甲氧基苯、1,2-二甲氧基苯、4-乙基-1,2-二甲氧基苯等是普洱茶挥发性成分中独有的、可区别于其他茶类的特征性成分。
综上可知,普洱茶挥发性组分及其一些单体成分具有抗癌、抗炎功能。但由于普洱茶挥发性组分种类多样,组成复杂,因此深入开展普洱茶不同挥发性组分间的互作,以及微量高效成分功能特性的研究,能够更全面、系统、深入揭示普洱茶挥发性组分的功能特性,让普洱茶这一特殊茶类更好地造福人类。
3 结论
本研究的普洱茶挥发性SDE法初提组分和化学法分离的中性组分同时具有较强的抗癌、抗炎活性,诱导QR的CD值为28.07、45.31 μg/mL,抑制NO的IC50值为51.68、73.32 μg/mL;GC-MS分析表明,这2类组分的9大类化合物类别相对含量占比变化趋势一致。
中性组分TLC分离组分中的F6和F6-2具有强的抗癌活性,诱导QR的CD值为12.8、15.12 μg/mL;GC-MS分析表明,其10大类化合物中,除酯类、醇类和其他类物质外,其余化合物类别的相对含量和占比变化趋势均一致,甲氧基苯类和酮类物质是其主要的功能活性物质。
本研究的7种单体物质对人结肠癌细胞HCT116、人肝癌细胞HepG2和人乳腺癌细胞MDA-MB-231都具有一定的增殖抑制作用,且对人结肠癌HCT116细胞的增殖抑制作用最强。其中,β-紫罗酮对4种癌细胞均表现出最强的抗癌活性,诱导QR活性的CD值为17.10 μg/mL,抑制HCT116细胞、HepG2细胞和MDA-MB-231细胞增殖的IC50值分别为46.53、325.48和236.34 μg/mL。甲氧基苯类物质1,2,4-三甲氧基苯、1,2,3-三甲氧基苯和1,2-二甲氧基苯皆具有较强的抗炎活性,抑制NO的IC50值分别为:97.11、134.99、169.62 μg/mL。

