美洲大蠊脱脂膏中总糖和还原糖含量的测定
,,,,,*
(1.大理大学药学与化学学院,云南大理 671000; 2.云南省昆虫生物医药研发重点实验室,云南大理 671000)
美洲大蠊(Peripianetaamericana)为昆虫纲有翅亚纲蜚蠊目蜚蠊科昆虫,俗称蟑螂,又称蜚蠊[1],其作为药用的历史悠久,是一种十分古老的昆虫,在蜚蠊科中是体积最大的昆虫,在《神农本草经》中最早被记载[1],在本草典籍《新修本草》和《本草纲目》也有重要记载[2]。目前以美洲大蠊为原料研发并用于临床的药物有“康复新液”[3]、“心脉隆注射液”[4]、“肝龙胶囊”[5]。美洲大蠊水解可得到13种氨基酸[6],此外粘多糖、肽、核苷等成分也是主要的活性成分[7-8],具有抗癌、抗肝纤维化、保肝、增强免疫[9]等药理作用,被广泛用于创伤的修复、肿瘤、十二指肠溃疡等疾病[10]。
美洲大蠊脱脂膏是配制“康复新液”的原料药,也是进一步分离其它活性部位的原料,其质量的优劣直接关系“康复新液”及其它制剂的质量。研究表明,脱脂膏中多糖是其主要活性成分之一[1]。多糖的含量测定多采用总糖含量减去还原糖含量[11-13]。其中还原糖是糖理化检测的重要指标,而目前美洲大蠊脱脂膏的质量标准中尚未建立总糖及还原糖的测定方法,脱脂膏中还原糖的含量测定尚缺乏报道。查阅相关资料,总糖的含量测定方法如苯酚-硫酸法及蒽酮比色法最为常用[14-15],DNS法常用于还原糖含量测定或样品水解后总糖的含量测定[16-17]。因此,本实验以美洲大蠊脱脂膏为原料,采用苯酚-硫酸法及蒽酮比色法测定总糖含量,优选出脱脂膏最优总糖测定方法,同时建立DNS法测定还原糖含量的方法,以期为美洲大蠊脱脂膏的质量控制提供依据。
1 材料与方法
1.1 材料与仪器
美洲大蠊 购自云南大理弥渡美蠊养殖基地;葡萄糖 分析纯,中国药品生物制品检定所;蒽酮 分析纯,天津市福晨化学试剂厂;二硝基水杨酸 分析纯,北京索莱宝科技有限公司;水 为超纯水;其他试剂 均为分析纯。
UV2500型紫外分光光度计 日本岛津公司;AL204-IC型电子分析天平 梅特勒-托利多仪器上海有限公司;HWS24型电热恒温水浴锅 上海一恒科技有限公司;4500A型多功能粉碎机 永康市艾泽拉电器有限公司。
1.2 实验方法
1.2.1 溶液的制备 美洲大蠊脱脂膏:取美洲大蠊干燥成虫粉碎过二号筛(24 目)收集粗粉,粗粉用70%乙醇溶液浸泡24 h,浸泡3次,过滤,将滤液浓缩至干得美洲大蠊浸膏。将制得的浸膏加纯化水分散均匀,于70 ℃水浴加热,油脂析出浮于水面,放冷去除凝固的油脂,将下层溶液继续浓缩至棕黑色膏状物即为脱脂膏[18]。
样品溶液:称取约1 g的美洲大蠊脱脂膏,加水超声1 min,超声频率50 kHz,溶解,转移、定容至100 mL容量瓶中,摇匀,备用。
1.2.2 苯酚-硫酸法测定总糖的含量
1.2.2.1 测定波长的选择 分别取1 mg/mL的葡萄糖标准溶液与样品溶液2.0 mL于25 mL具塞试管中,分别加5%苯酚溶液1.0、5.0 mL浓硫酸,100 ℃沸水浴加热20 min,快速冷却至室温,定容,摇匀,于400~600 nm范围内进行波长扫描,确定最佳测定波长。
1.2.2.2 葡萄糖标准曲线的绘制 分别移取1 mg/mL葡萄糖标准溶液0.1、0.5、1.0、1.5、2.0和2.5 mL于25 mL具塞试管中,加适量蒸馏水使总体积为3.0 mL,加入1.0 mL的5%苯酚溶液和浓硫酸5.0 mL,100 ℃沸水浴加热30 min,迅速冷却,定容,最佳测定波长下测定吸光度。以吸光度为纵坐标,浓度为横坐标绘制标准曲线。
1.2.2.3 苯酚用量的考察 移取2.0 mL样品溶液和2.0 mL蒸馏水于25 mL具塞试管中,分别加入0.5、1.0、1.5、2.0 mL 5%苯酚溶液,5.0 mL浓硫酸,100 ℃沸水浴中加热20 min,冷却至室温,定容,最佳测定波长下测定吸光度。
1.2.2.4 浓硫酸用量的考察 移取2.0 mL样品溶液和2.0 mL蒸馏水于25 mL具塞试管中,加入1.0 mL 5%苯酚溶液,分别加入3.0、4.0、5.0、6.0、7.0、8.0 mL浓硫酸,100 ℃沸水浴加热20 min,冷却至室温,定容,最佳测定波长下测定吸光度。
1.2.2.5 显色时间的考察 移取2.0 mL样品溶液和2.0 mL蒸馏水于25 mL具塞试管中,加入1.0 mL 5%苯酚溶液和5.0 mL浓硫酸,100 ℃沸水浴加热10、20、25、30、35、40和45 min,冷却至室温,定容,最佳测定波长下测定吸光度。
1.2.2.6 精密度实验 移取2.0 mL样品溶液六份和2.0 mL蒸馏水于25 mL具塞试管中,“1.2.2.2”项操作,测定吸光度,考察苯酚-硫酸法的精密度。
1.2.2.7 重复性实验 分别称取六份约1 g的脱脂膏样品于100 mL容量瓶中,按样品溶液制备方法制备美洲大蠊样品溶液,苯酚-硫酸法测定样品溶液的吸光度,考察方法的重复性。
1.2.2.8 稳定性实验 移取样品溶液2.0 mL按“1.2.2.2”项方法操作,每隔10 min测定一次吸光度,考察苯酚-硫酸法的稳定性。
1.2.2.9 加样回收率实验 取美洲大蠊脱脂膏适量于100 mL容量瓶中,平行称取九份,按总糖含量的高、中、低加入葡萄糖标准品,按“1.2.1”项配制美洲大蠊样品溶液,按“1.2.2.2”项操作测定吸光度,计算回收率。
1.2.3 硫酸-蒽酮法测定总糖的含量
1.2.3.1 测定波长的选择 移取样品溶液1.0 mL于10 mL具塞试管中,在冰水浴中加入0.5 mg/mL硫酸-蒽酮5.0 mL[19],100 ℃沸水浴加热显色10 min,迅速冷至室温,在450~700 nm范围内用紫外-可见分光光度计进行波长扫描,确定最佳测定波长。
1.2.3.2 葡萄糖标准曲线的绘制 分别移取1 mg/mL葡萄糖标准溶液0.1、0.2、0.4、0.6、0.8和1.0 mL于10 mL具塞试管中,加入蒸馏水使其体积为1.0 mL,在冰水浴中加0.5 mg/mL硫酸-蒽酮溶液4.0 mL,100 ℃沸水浴加热显色10 min,迅速冷却,最佳测定波长下测定吸光度。以吸光度为纵坐标,浓度为横坐标绘制标准曲线。
1.2.3.3 显色剂用量的考察 移取样品溶液0.5 mL于10 mL具塞试管中,分别在冰水浴中加入0.5 mg/mL硫酸-蒽酮溶液2.0、3.0、4.0、5.0、7.0、9.0和11.0 mL,100 ℃沸水浴加热显色10 min,迅速冷至室温,最佳测定波长下测定吸光度。
1.2.3.4 显色时间的考察 精密移取样品溶液0.5 mL于10 mL具塞试管中,于冰水浴中加入0.5 mg/mL硫酸-蒽酮溶液5.0 mL,100 ℃沸水浴加热显色5、8、10、12和15 min,迅速冷至室温,测定吸光度值。
1.2.3.5 精密度实验 移取0.4 mL葡萄糖标准溶液六份于10 mL具塞试管中,加蒸馏水使其为1.0 mL。按“1.2.3.2”项操作,测定吸光度,考察硫酸-蒽酮法精密度。
1.2.3.6 重复性实验 分别称取六份约1 g的脱脂膏样品于100 mL容量瓶中,按样品溶液制备方法制备美洲大蠊样品溶液,硫酸-蒽酮法测定样品溶液的吸光度,考察方法的重复性。
1.2.3.7 稳定性实验 移取样品溶液0.5 mL按“1.2.3.2”项方法操作,每隔10 min测定一次吸光度,考察硫酸-蒽酮法的稳定性。
1.2.3.8 加样回收率实验 取美洲大蠊脱脂膏适量于100 mL容量中,平行称取九份,按含量的高、中、低加入葡萄糖标准品,按“1.2.1”项配制溶液,按“1.2.3.2”项操作测定吸光度。计算加样回收率。
1.2.4 二硝基水杨酸法测定还原糖的含量
1.2.4.1 测定波长的选择 移取样品溶液1.0 mL于25 mL具塞试管中,加入6.3 mg/mL的DNS试剂3.0 mL[20],100 ℃沸水浴加热显色5 min,迅速冷至室温,加水至25 mL,摇匀,在400~700 nm范围内用紫外-可见分光光度计进行波长扫描,确定最佳测定波长。
1.2.4.2 葡萄糖标准曲线的绘制 分别移取1 mg/mL葡萄糖标准溶液0.1、0.2、0.4、0.6、0.8、1.0 mL于25 mL具塞试管中,加入蒸馏水使其总体积为2.0 mL,加6.3 mg/mL DNS溶液3 mL,100 ℃沸水浴加热显色10 min,迅速冷却,定容,摇匀,最佳测定波长下测定吸光度。以吸光度为纵坐标,浓度为横坐标绘制标准曲线。
1.2.4.3 显色时间的考察 移取样品溶液2.0 mL于25 mL具塞试管中,加入6.3 mg/mL DNS试剂3.0 mL,100 ℃沸水浴加热显色5、10、15、20、25和30 min,迅速冷至室温,定容,摇匀,测定吸光度。
1.2.4.4 显色剂用量的考察 移取样品溶液2.0 mL于25 mL具塞试管中,分别加入6.3 mg/mL DNS溶液1.0、2.0、3.0、4.0和5.0 mL,100 ℃沸水浴加热显色10 min,迅速冷至室温,定容,摇匀,测定吸光度。
1.2.4.5 稳定性实验 移取样品溶液2.0 mL于25 mL具塞试管中,加入6.3 mg/mL DNS试剂3.0 mL,100 ℃沸水浴加热显色10 min,迅速冷至室温,定容,摇匀,每隔10 min测定一次吸光度,考察方法的稳定性。
1.2.4.6 精密度实验 精密移取2.0 mL样品溶液于六份25 mL具塞试管中,加入6.3 mg/mL DNS试剂3 mL,100 ℃沸水浴加热显色10 min,迅速冷至室温,定容,摇匀,测定吸光度。
1.2.4.7 重复性实验 分别称取六份1 g的脱脂膏样品于100 mL容量瓶中,按样品溶液制备方法制备美洲大蠊样品溶液,测定样品溶液的吸光度,考察方法的重复性。
1.2.4.8 加样回收率实验 取美洲大蠊浸膏适量于100 mL容量中,平行称取九份,按含量的高、中、低加入葡萄糖标准品,按“1.2.1”配制溶液,按“1.2.4.2”操作测定吸光度。
1.2.5 样品中总糖及还原糖含量的测定 称取不同批号的脱脂膏1 g按“1.2.1”项配制溶液,苯酚-硫酸法及硫酸-蒽酮法测定不同批次美洲大蠊样品的吸光度,计算样品中总糖含量。DNS法测定样品溶液吸光度,并计算还原糖的含量。
2 结果与分析
2.1 总糖含量的测定
2.1.1 苯酚-硫酸法
2.1.1.1 测定波长的选择 苯酚-硫酸法测定美洲大蠊脱脂膏中总糖含量时,最大吸收波长如图1所示。

图1 光谱吸收曲线Fig.1 The curve of spectral absorption
苯酚硫酸法葡萄糖标准溶液在491 nm处有最大吸收峰,而样品溶液在489 nm有最大吸收,经多次实验发现,二者最大吸收波长并不能达到完全一致,原因可能是美洲大蠊脱脂膏配成的样品为淡黄色溶液,原料除糖类物质外还含有其他成分的混合物,因此可能会对吸收波长造成偏差,因此本实验综合考虑,最终以葡萄糖标准品的最大吸收波长491 nm为最终测定波长。
2.1.1.2 标准曲线的绘制 苯酚-硫酸法测定总糖含量的葡萄糖标准曲线如图2所示。线性回归方程为y=9.0383x+0.0807。葡萄糖标准品浓度在0.004~0.100 mg·mL-1范围内呈良好的线性关系,R2=0.9996。

图2 葡萄糖标准曲线Fig.2 The standard curve of glucose
2.1.1.3 浓硫酸用量对吸光度的影响 由图3可知,硫酸用量在3.0~5.0 mL时,吸光度呈上升趋势,当用量达到5.0 mL时,吸光度达到最大值;当用量继续增大时,吸光度值反而呈下降趋势,可能由于当浓硫酸用增大时,使溶液中单糖部分碳化,而使吸光度呈下降趋势。为了节省试剂,本实验最终选择浓硫酸的用量为5.0 mL。

图3 不同浓硫酸用量对吸光度的影响Fig.3 The effect of different concentrations of sulfuric acid on absorption
2.1.1.4 苯酚用量对吸光度的影响 苯酚主要与单糖脱水形成的衍生物结合成有色化合物。由图4可知,苯酚用量在0.5~1.0 mL范围内时,吸光度呈上升趋势;在1.0~2.0 mL范围内时,吸光度值反而有所下降,故选择反应完全时苯酚用量1.0 mL为最佳用量。

图4 不同苯酚用量对吸光度的影响Fig.4 The effect of different concentrations of phenol on absorption
2.1.1.5 显色时间对吸光度的影响 由图5可知,当显色时间为30 min时,吸光度达到最大值,反应较完全;而30 min之后吸光度随着加热时间增加而下降,可能是随着时间的延长,苯酚与单糖形成的有色中间产物不稳定而影响吸光度测定。为了使反应完全又不影响有色化合物的稳定性,选择30 min为最佳显色时间。

图5 不同显色时间对吸光度的影响Fig.5 The effect of different developing time on absorption
2.1.1.6 精密度实验 苯酚-硫酸法平行六次测定样品溶液的吸光度,并计算相对标准偏差。测定的吸光度值为0.533±0.006(n=6),相对标准偏差为1.1%。该方法测定美洲大蠊脱脂膏总糖精密度良好,能满足样品分析要求。
2.1.1.7 重复性实验 苯酚-硫酸法测定总糖含量为85.03±2.32 mg/g(n=6),相对标准偏差为2.7%,表明苯酚-硫酸法测定样品总糖含量的重复性较好。
2.1.1.8 稳定性实验 苯酚-硫酸法测定的吸光度值为0.725±0.021(n=6),相对标准偏差为2.9%。苯酚-硫酸法测定样品时在50 min内稳定性良好。
2.1.1.9 加样回收率实验 加样回收率结果如表1所示。苯酚-硫酸法测定总糖的加样回收率为98.72±1.96(n=9),相对标准偏差为2.0%。苯酚-硫酸法测定样品总糖的加样回收率良好,说明该分析方法准确可靠。

表1 加样回收实验Table 1 Results of recovery rate test
2.1.2 硫酸-蒽酮法
2.1.2.1 吸收波长的选择 硫酸-蒽酮法测定美洲大蠊脱脂膏中总糖含量时,最大吸收波长如图6所示。
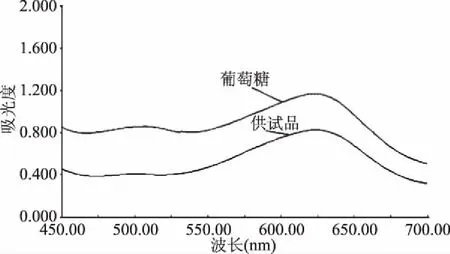
图6 光谱吸收曲线Fig.6 The curve of spectral absorption
硫酸蒽酮法测定时不同的含糖物质会导致测定条件有偏差,存在一定的波动性[21]。因此,本实验吸收波长的选择主要以葡萄糖标准品为参考依据,选择621 nm为最终测定波长。
2.1.2.2 标准曲线的绘制 硫酸蒽酮法测定总糖含量的葡萄糖标准曲线如图7所示。线性回归方程为y=5.9444x+0.0994。葡萄糖标准品浓度在0.02~0.20 mg·mL-1范围内有良好的线性关系,R2=0.9996。

图7 葡萄糖标准曲线Fig.7 The standard curve of glucose
2.1.2.3 显色剂用量对吸光度的影响 由图8可知,当显色剂用量在4.0 mL时,吸光度值达到最大;当显色剂用量在7.0 mL时,吸光度值下降明显,可能是由于随着硫酸用量的增加,其强氧化性影响了蒽酮与衍生物反应生成的蓝绿色糠醛衍生物的稳定性,导致吸光度值降低。因此选择4.0 mL为最佳显色剂用量。

图8 不同显色剂用量对吸光度的影响Fig.8 The effect of different dosage of chromogenic agent on absorption
2.1.2.4 显色时间对吸光度的影响 由图9可知,吸光度值随着显色时间的延长而升高,当显色时间为10 min时,吸光度值达到最大值,此时反应完全;之后吸光度值随着时间的延长而逐渐下降,可能是由于时间过长对有色复合物的稳定性有一定影响。故显色时间选择为10 min。

图9 不同显色时间对吸光度的影响Fig.9 The effect of different heating time on absorption
2.1.2.5 精密度实验 硫酸-蒽酮法平行六次测定样品溶液的吸光度,并计算相对标准偏差。测定的吸光度值0.592±0.009(n=6),相对标准偏差为1.5%。硫酸-蒽酮法测定美洲大蠊脱脂膏总糖精密度良好,能满足样品分析要求。
2.1.2.6 重复性实验 硫酸-蒽酮法测定总糖含量为(86.08±1.77) mg/g(n=6),相对标准偏差为2.1%。表明硫酸-蒽酮法测定样品总糖含量的重复性较好。
2.1.2.7 稳定性实验 硫酸-蒽酮法测定的吸光度值为0.722±0.006(n=6),相对标准偏差为0.8%。硫酸-蒽酮法测定样品时在50 min内稳定性良好。
2.1.2.8 加样回收率实验 加样回收率结果如表2所示。硫酸-蒽酮法测定总糖的加样回收率为97.74±2.52(n=9),相对标准偏差为2.6%,表明硫酸-蒽酮法测定样品总糖的加样回收率良好。

表2 加样回收率实验Table 2 Results of recovery rate test
2.1.3 样品中总糖的含量 样品中总糖的含量测定结果如表3~表4所示。苯酚-硫酸法和硫酸-蒽酮法分别测定五个不同批次的美洲大蠊脱脂膏中总糖含量,不同批次制得的美洲大蠊脱脂膏中总糖的含量相差明显,如苯酚-硫酸法测定总糖含量最大为81.2 mg/g,最小为58.5 mg/g。

表3 苯酚-硫酸法测定的样品总糖含量Table 3 Total sugar content results of samples
表4 蒽酮比色法测定的样品总糖含量Table 4 Total sugar content results of samples
2.1.4 苯酚-硫酸法与硫酸-蒽酮法总糖测定结果的比较 苯酚-硫酸法和硫酸-蒽酮法分别测定美洲大蠊脱脂膏中总糖的含量,并比较两种方法测定的优劣,结果见表5。

表5 美洲大蠊脱脂膏中总糖的两种测定方法的比较Table 5 Comparison of two methods for determination of total sugar in degreasing cream from Periplaneta americana
由表5可知,两种方法均可用于脱脂膏总糖含量的测定,但通过实验发现,硫酸-蒽酮法中硫酸-蒽酮溶液的加入需要在冰水浴中完成,操作繁琐。且加热显色后,不能用蒸馏水定容,否则待测液浑浊,测定误差大。因此本实验综合考虑,选用苯酚-硫酸法用于美洲大蠊脱脂膏总糖含量的测定。
2.2 还原糖含量的测定
2.2.1 二硝基水杨酸法
2.2.1.1 吸收波长的选择 结果如图10所示。DNS法测定美洲大蠊脱脂膏中还原糖含量时,葡萄糖标准溶液在494 nm有最大吸收,而样品溶液则在489 nm有最大吸收,两者最大吸收波长并不相同,可能是由于美洲大蠊脱脂膏水溶液为有色溶液,测定时可能存在自身因素的影响。相关文献报道,样品本身自带的颜色会对实验吸收波长有一定影响[20]。因此,本实验综合考虑选择葡萄糖标准溶液的吸收波长494 nm为最终测定波长。

图10 光谱吸收曲线Fig.10 The curve of spectral absorption
2.2.1.2 标准曲线的绘制 DNS法测定还原糖含量的葡萄糖标准曲线如图11所示。线性回归方程为y=36.765x-0.1333。葡萄糖标准品浓度在0.004~0.040 mg·mL-1范围内呈良好的线性关系,R2=0.9996。

图11 葡萄糖标准曲线Fig.11 The standard curve of glucose
2.2.1.3 显色时间对吸光度的影响 图12结果显示,当加热时间10 min反应完全,吸光度有最大值。当显色时间到15 min时吸光度值反而有所下降,可能由于显色时间过长影响有色复合物的稳定性。因此最终选择10 min为最终显色时间。

图12 不同显色时间对吸光度的影响Fig.12 The effect of different heating time on absorption
2.2.1.4 显色剂用量对吸光度的影响 由图13可知,当显色剂用量为3 mL时,吸光度呈最大值反应完全。从经济角度考虑选择3.0 mL为最佳用量。

图13 不同显色剂用量对吸光度的影响Fig.13 The effect of different dosage of chromogenic agent on absorption
2.2.1.5 精密度实验 DNS法测定样品还原糖吸光度为0.787±0.009(n=6),相对标准偏差为1.1%。表明DNS测定美洲大蠊脱脂膏还原糖精密度良好,能够满足样品分析要求。
2.2.1.6 重复性实验 DNS法测定脱脂膏还原糖含量分别为(35.07±0.22) mg/g(n=6),相对标准偏差为0.7%。表明DNS法测定样品还原糖含量的重复性良好。
2.2.1.7 稳定性实验 DNS法测定样品还原糖吸光度为0.717±0.006(n=6),相对标准偏差为0.8%。表明DNS法测定还原糖含量在50 min内显色稳定,该方法具有良好的稳定性。
2.2.1.8 加样回收率实验 加样回收率结果如表6所示。DNS法测定样品还原糖含量加样回收率为96.84±1.17(n=9),相对标准偏差为1.6%。表明DNS法准确可靠,可用于美洲大蠊脱脂膏还原糖含量测定。

表6 加样回收率实验Table 6 Results of recovery rate test
2.2.2 样品中还原糖的含量 样品还原糖含量测定结果如表7所示。DNS法对不同批次的样品的还原糖含量测定,不同批次制得的脱脂膏还原糖含量相差较大。可能由于美洲大蠊在养殖过程中饲料,环境等因素不同导致原料中所含还原糖含量有较大差异。

表7 样品还原糖含量的测定结果Table 7 Results of reducing sugar
3 结论
采用苯酚-硫酸法及硫酸-蒽酮法对美洲大蠊脱脂膏中总糖含量进行测定,优选出苯酚-硫酸法做为美洲大蠊脱脂膏总糖测定方法。最佳总糖测定条件为苯酚用量1.0 mL、硫酸用量5.0 mL、显色时间为30 min。最佳还原糖测定条件为显色剂用量3.0 mL、显色时间10 min。苯酚-硫酸法标准品浓度在0.004~0.100 mg/mL范围内呈良好的线性关系,平均加样回收率为98.7%,RSD为2.0%,R2=0.9996。二硝基水杨酸法标准品浓度在0.004~0.040 mg/mL范围内呈良好的线性关系,平均加样回收率为96.8%,RSD为1.6%,R2=0.9996。两种测定方法具有重现性好、试剂用量少、精密度高、对实验环境及设备要求低等优点,可分别作为美洲大蠊脱脂膏总糖及还原糖含量测定方法。
通过对5批美洲大蠊脱脂膏样品中总糖及还原糖的含量测定发现,不同批次间的总糖及还原糖含量均相差明显,可能与美洲大蠊养殖过程中饲料配比、养殖温度等因素有关。而糖是美洲大蠊脱脂膏中主要活性成分之一,直接关系到“康复新液”及其它制剂的质量,因此建立总糖及还原糖含量的测定方法,可对美洲大蠊脱脂膏质量标准的建立提供依据。

