虾夷扇贝内脏团对镉的富集特性及生理响应
高加龙, 章超桦,秦小明,郝记明,张 静,苏伟明
(广东海洋大学食品科技学院 // 国家贝类加工技术研发分中心(湛江) // 广东省水产品加工与安全重点实验室 //广东省海洋生物制品工程实验室 // 水产品深加工广东普通高等学校重点实验室,广东 湛江 524088)
随着现代工业的发展,包含重金属在内的各种污染物被源源不断地排入海洋环境,这些重金属,即使浓度小,也可在藻类和底泥中积累,被鱼和贝的体表吸附,产生食物链浓缩,从而造成公害。例如,汞(Hg)污染导致“水俣病”和镉(Cd)污染导致“痛痛病”等。镉是一种剧毒重金属,能够广泛诱导环境中的生物体产生毒性反应,其毒性包括干扰各种代谢过程、膜运输、蛋白质合成、DNA修复以及活性氧(ROS)的产生等[1-3]。活性氧的积累会造成组织生物膜、蛋白质及核酸的损伤。在正常生理学情况下,机体通过抗氧化防御机制防止活性氧的形成,通过清除活性氧修补损伤,限制活性氧产生的有害影响。抗氧化防御主要由过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)等酶类抗氧化剂及维生素类抗氧化剂构成[2,4]。目前针对贝类重金属胁迫影响的研究,主要集中在毒理学、抗氧化酶活性、功能基因研究和DNA损伤等[5-6]。在双壳类动物中,环境污染可增强氧化应激,从而干扰天然抗氧化酶系统。研究报道,镉、汞、鳗弧菌和副溶血弧菌可诱导栉孔扇贝(Azumapecten farreri)、文蛤和贻贝等双壳贝类中CAT、SOD的表达[7-9]。此外,热休克蛋白 70(HSP70)是热休克蛋白超家族的重要成员,具有细胞内分子伴侣和细胞外免疫调节功能,是受到热激、重金属、干旱、疾病、寄生虫感染等条件胁迫后产生的诱导蛋白[10]。
虾夷扇贝(Mizuhopecten yessoensis)是一种冷水性贝类,原产于日本北海道及本洲北部、俄罗斯千岛群岛的南部水域及朝鲜附近,目前已在渤海及黄海北部形成规模化和产业化养殖,是我国北方最重要的海水养殖贝类之一。虾夷扇贝易于蓄积重金属,尤其是镉[11]。然而,目前关于实验性金属污染后虾夷扇贝的生理反应和解毒过程的研究报道鲜见。因此,笔者以虾夷扇贝为对象,研究在重金属Cd胁迫下扇贝的生理指标响应及对 Cd的富集特征,以期为虾夷扇贝的健康养殖、栖息地环境监测和海洋环境保护等提供参考依据。
1 材料与方法
1.1 材料与试剂
鲜活虾夷扇贝(M.yessoensis),壳长(11.2 ±0.8)cm,购自日本东京筑地水产批发市场。
Trizol(Ambion公司,美国);PrimeScriptTM RT Master Mix (Perfect Real Time)、SYBR® Premix EX TaqTM II (Tli RNaseH Plus) Kit(Takara 公司,日本);CdCl2·2.5H2O为分析纯;硝酸、高氯酸为优级纯;镉标准储备液(国家标准物质研究中心);Ultra Clam贝类饲料(Fauna Marin公司,德国)。
1.2 仪器与设备
ABI 7300 Real Time PCR System、ABI 3130 Genetic Analyser(Applied Biosystems公司,美国);Biospec-nono 紫外分光光度计(岛津公司,日本);Thermo SOLAAR M6原子吸收分光光度计(Thermofisher公司,美国);C-MAG HP10电加热板(IKA公司,德国)。
1.3 方法
1.3.1 扇贝暂养及重金属暴露 购买的鲜活扇贝先在实验室的水族箱(90 cm × 45 cm × 45 cm)中用人工海水暂养7 d。暂养后随机分为3组,每组20只,1组作为对照组(Control),在不添加重金属的海水中饲养10 d;另2组分别在添加了200和400 µg/L CdCl2的人工海水中暴露10 d,每天完全换水并添加Cd至对应浓度。在暂养和暴露实验阶段海水温度均控制在(18 ± 1)℃,自然光照周期,供氧泵持续曝气,每天在海水中添加0.1 g/100 L的Ultra Clam作为饲料[12]。
1.3.2 扇贝组织收集 在暴露7 d和10 d后,分别从对照组和Cd处理组中随机选择5个扇贝。开壳取内脏团,于液氮中速冻后在-80 ℃保存,用于实时荧光定量 PCR测定;同时收集扇贝其余内脏团、外套膜、闭壳肌、腮和性腺组织,于-20 ℃保存,用于Cd含量测定。
1.3.3 扇贝镉含量测定 为了减少取样水分差异对测定结果造成的误差,用于Cd含量测定的各组织预先在80 ℃干燥箱中干燥24 h以上。准确称量已干燥的扇贝各组织0.30 g,置于三角烧瓶中,加入20 mL的硝酸+高氯酸(体积比7∶1)的混合酸,放置12 h,然后在电热板210 ℃加热消解2~3 h,不时补加混合酸至完全消解,再持续加热除酸后定容,经0.22 µm滤膜过滤后用原子吸收分光光度计测定[13]。
1.3.4 总 RNA提取和第一链 cDNA合成 采用Trizol法提取扇贝内脏团的总RNA,运用琼脂糖凝胶电泳验证RNA完整性,用Biospec-nono紫外分光光度计检测各 RNA浓度及纯度,参照PrimeScriptTM RT Master Mix (Perfect Real Time)说明书合成实时荧光定量PCR cDNA模板。
1.3.5 实时荧光定量PCR检测 以β-actin基因作为内参,cDNA为模板,ABI 7300 Real Time PCR进行 qRT-PCR。引物见表1,PCR反应体系参考SYBR® Premix EX TaqTM II说明书,20 µL 反应体系:10 µL 2 × SYBR® Premix Ex Taq,2 µL cDNA模板, 0.4 nmol/mL 引物,0.4 µL 50 × ROX reference dye,扩增程序为在95 ℃下变性30 s,然后在95 ℃下反应5 s,60 ℃下反应30 s,进行40次循环。为了评估PCR扩增的特异性,在qPCR周期结束时,收集65~95 ℃的荧光数据,在0.5 ℃增量下进行熔解曲线分析。最后用2-ΔΔCT方法计算基因的相对表达水平。

表1 本实验所用引物Table 1 Primers used in the present study
1.3.5 数据处理 所有测试平行重复3次,结果以X±S表示。采用SPSS 22.0软件对实验结果进行统计学处理,使用单因素方差分析(ANOVA)和Duncan多重比较判断组间差异的显著性,显著性水平为α= 0.05。
2 结果与分析
2.1 扇贝组织中镉的分布

图1 扇贝不同组织中镉的含量Fig.1 Cd bioaccumulation in tissues of scallops
图1是对照组的虾夷扇贝不同组织中Cd的含量,其内脏团含有62 µg/g(干基)的Cd,各组织Cd浓度高低依次为内脏团> 腮>外套膜> 性腺> 闭壳肌,内脏团中Cd浓度约为闭壳肌的108倍(P= 0.004)。与本研究结果相似的是,Evtushenko等[9]对日本海不同年龄的虾夷扇贝中的 Cd进行检测,发现1到8年龄扇贝内脏团中Cd质量分数从39 µg/g(干基)递增到400 µg/g(干基),而腮、外套膜和闭壳肌中则低于6 µg/g(干基)。可见,作为滤食性动物,扇贝可以大量富集环境中的Cd,且绝大多数Cd富集在内脏团中。因此,本研究选用扇贝内脏团作为对镉富集特性及生理响应的研究对象。
2.2 扇贝内脏团对镉的富集
当扇贝暴露在含有Cd的海水中,内脏团中Cd含量持续增加。暴露于400 μg/L Cd海水7 d和10 d后,扇贝内脏团中的Cd质量分数由62 µg/g(干基)分别增加到了180和217 µg/g(干基),约为对照组的3倍左右,且与对照组呈现显著性差异(P<0.05)(图2)。研究报道,菲律宾蛤仔、近江牡蛎和翡翠贻贝在含100 μg/L Cd的海水中暴露18 d后,组织中Cd含量分别为对照的20、17和25倍[14]。与以上3种双壳贝类相比,本研究中虾夷扇贝Cd富集倍数相对较低的原因可能是暴露天数相对较短(10 d),也可能是成年扇贝已经在栖息环境中富集了相对较高浓度的Cd(62 µg/g,干基)。

图2 不同浓度镉暴露下扇贝内脏团中镉的富集Fig.2 Cadmium bioaccumulate in the digestive glands of scallops exposed to different concentrations of Cd
2.3 Cd暴露后扇贝内脏团诱导蛋白基因表达分析
越来越多的证据表明,镉的积累通过过量产生ROS介导的氧化应激的诱导对生物体具有重大的负面影响[15]。为了研究镉胁迫下扇贝内脏团的生理响应,对扇贝内脏团中CAT、SOD、GPx和HSP70的转录表达量进行了实时定量PCR分析。每个扩增产物(包括参比基因)的熔解曲线只有一个峰,经琼脂糖电泳和ABI 3130 Genetic Analyser测序证实为目的产物,且β-actin mRNA的表达在实验期间基本稳定。
图3可见,Cd处理可诱导扇贝内脏团CATmRNA的表达。在含200 μg/L Cd的海水中暴露7 d后CAT的表达水平显著升高,10 d后表达量则显著回落,7 d后的表达量高于10 d后和对照组的5倍(P<0.05)。而在含400 μg/L Cd的海水暴露时,CAT mRNA的表达在7 d后也明显增加(P<0.05),但10 d后未见明显下降(P> 0.05)。

图3 镉暴露下扇贝内脏团中CAT mRNA的相对表达量Fig.3 The relative mRNA expression of CAT in the digestive gland of M.yessoensis after Cd exposure
扇贝SODmRNA表达水平如图4所示,在含200 μg/L Cd的海水中暴露7 d后表达量达的最高值,比对照组高28倍(P<0.05),在10 d后表达水平则显著降低(P<0.05)。而在含400 μg/L Cd的海水处理10 d前扇贝SODmRNA表达无显著变化(P> 0.05)。
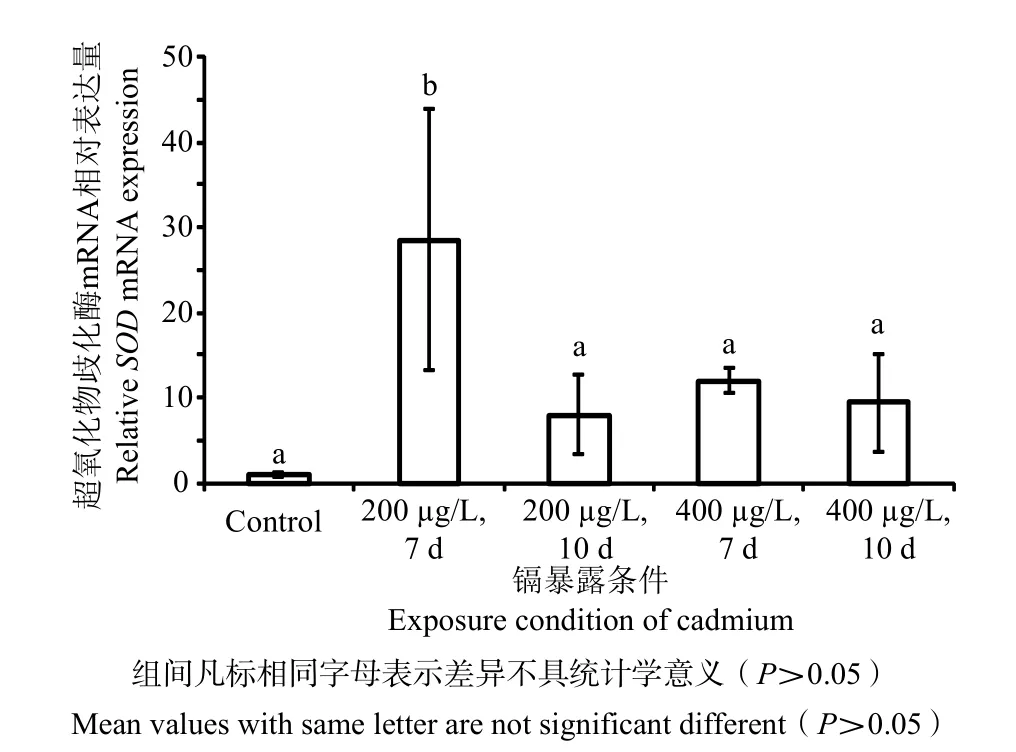
图4 镉暴露下扇贝内脏团中SOD mRNA的相对表达量Fig.4 The relative mRNA expression of SOD in the digestive gland of M.yessoensis after Cd exposure
在含200 μg/L Cd海水中暴露,虾夷扇贝GPx的mRNA表达明显增强。在暴露7 d和10 d后表达量上升(分别比对照组增加22倍和17倍)(图5)。在含Cd 400 μg/L海水中暴露,也导致了虾夷扇贝GPxmRNA在暴露7 d和10 d 后表达上升(分别比对照增加9和8倍),但差异无显著性(P> 0.05)。

图5 镉暴露下扇贝内脏团中GPx mRNA的相对表达量Fig.5 The relative mRNA expression of GPx in the digestive gland of M.yessoensis after Cd exposure
虾夷扇贝HSP70基因表达如图6所示, Cd暴露后扇贝HSP70mRNA表达水平升高,200 μg/L暴露7 d组呈显著性差异(P<0.05),400 μg/L的Cd暴露10 d后表达量达几组中的最高值,比对照组高 26 倍(P<0.05)。

图6 镉暴露下扇贝内脏团中HSP70 mRNA的相对表达量Fig.6 The relative mRNA expression of HSP70 in the digestive gland of M.yessoensis after Cd exposure
3 讨论
潮间带滤食性无脊椎动物在其组织,特别是在内脏团中积累高水平的微量金属,。内脏团不仅仅是用于消化的组织,也是对外来危害物质解毒和防御的组织[16]。因此,选择内脏团来研究生物对 Cd的氧化应激反应。Cd暴露诱导扇贝内脏团中CAT表达显著增加,说明CAT在Cd的解毒和免疫应答中起着重要作用,这在许多双壳贝类的消化系统中得到了证实[17-18]。SOD存在于所有有氧细胞中,被认为对活性氧的毒性起着重要的保护作用。SOD在无脊椎动物中的表达可由热刺激、重金属暴露、微生物和有机污染物等各种挑战诱导[8,19]。本研究中Cd诱导扇贝内脏团中SODmRNA的表达增加,提示SOD是保护生物体免受Cd毒害的抗氧化防御因子之一[20]。同样,200 μg/L Cd诱导虾夷扇贝GPx大量表达,说明扇贝GPx也参与抗氧化防御。GPx通过催化与谷胱甘肽(GSH)的反应去除H2O2,除了H2O2之外,该酶还催化其他氢过氧化物的还原,具有比过氧化氢酶更宽的保护范围[21]。
Cd引起不同水平的生物系统的显著代谢改变和损伤,以防止和修复镉引起的细胞成分的损伤,对 ROS的防御机制的损伤导致 ROS浓度的增加[22]。这一事实可以解释Cd暴露后抗氧化酶CAT、SOD和GPx基因转录的增加。在本研究中,Cd处理对CAT、SOD和GPx的表达均有影响,在镉浓度为200 μg/L时,暴露7 d时3种酶的mRNA表达均显著增加,但无论Cd处理为400 μg/L或暴露于10 d时,3种酶的mRNA表达水平均却显著降低。类似的结果表明,CAT活性的变化是急性应激期间对污染物的短暂反应,但在慢性污染生物体中并不明显[23],可能是CAT、SOD和GPx参与了抗氧化损伤的一线防御[24]。高剂量Cd或长期暴露会对扇贝造成危害,并造成不可修复的损害,在本研究中也发现,长期暴露高剂量Cd(400 μg/L)的扇贝死亡率相对较高。HSP70被称为应对环境胁迫的经典反应蛋白,其含量高低对生物机体的损伤程度具有一定的指示作用[10],当机体遇到重金属胁迫等刺激时, HSP70 可通过防止蛋白的凝聚及变性, 维持细胞内环境稳定, 增强机体抗刺激及生存能力。本研究中扇贝在Cd胁迫下HSP70mRNA表达升高,在200 μg/L暴露7 d和400 μg/L暴露10 d条件下呈显著差异,证实了这类蛋白在扇贝Cd暴露保护中起重要作用。然而扇贝中HSP70表达量与暴露时间和重金属浓度并无线性关系,陈晓聪等[25]对菲律宾蛤仔的研究也出现相似结果,在2.5、5.0、7.5和10.0 μg/L汞中暴露后菲律宾蛤仔腮中HSP70mRNA表达量随着暴露浓度增加呈先升高后降低最后又升高的趋势,而在2.5和7.5 μg/L汞暴露48 h后mRNA表达量反而低于暴露24 h后的。
本研究是在实验室内模拟了扇贝的急性Cd胁迫效应,能够高效可控的探讨贝类受毒性损伤的机理,可为扇贝的综合利用开发及海洋环境的生物修复提供一些理论依据。但实验室不能很好地模拟海域现场的温度、盐度和洋流特征等,而且在作用浓度和时间的设计上也很难模拟现场的情况,因此,今后考虑将实验室模拟实验和海域现场调查相结合,以便更真实反映海域现场的作用模式和毒性机理,更好指导贝类品质的控制,减少贝类资源衰退及防治海洋环境污染。
4 结论
虾夷扇贝各组织易于富集环境中的Cd,尤其内脏团,是富集重金属的主要组织。随着镉暴露时间延长,扇贝内脏团中Cd浓度急剧升高,内脏团中抗氧化酶CAT、SOD和GPx以及热休克蛋白HSP70在Cd暴露后的基因表达量也显著增加,说明其对Cd暴露的扇贝具有防御和保护作用。

