凡纳滨对虾野田村病毒RT-PCR检测方法的建立及应用
雷 燕,肖 洋,王 娟,张文文,胡芳源,唐绍林
(1.广州利洋水产科技股份有限公司, 广东 广州 510515;2.广州金水动物保健品有限公司, 广东 广州 510515)
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,是我国重要养殖虾种,为世界上养殖产量最高的三大优良虾类之一[1]。然而随对虾养殖业的发展,养殖环境恶化,凡纳滨对虾养殖中的病害问题日益严重。近年来,“偷死病”[2-5]是困扰凡纳滨对虾养殖的主要病害之一,导致严重的经济损失。2014年,中国水产科学研究院黄海水产研究所科研人员通过组织病理学分析、人工感染实验、疑似病原基因进化分析、病毒分离纯化和荧光原位杂交等手段,证实新型野田村病毒(Litopenaeus vannamei nodavirus,LVNV)是导致凡纳滨对虾“偷死病”病原之一[6-7]。凡纳滨对虾野田村病毒隶属于野田村病毒科(Nodaviridae)的 α野田村病毒属(Alphanodavirus),是近年来发现的一种新兴病原体。感染野田村病毒的凡纳滨对虾临床症状主要为肝胰腺萎缩和发白,空肠空胃,软壳,生长缓慢,多数虾腹部肌肉发白和坏死[7]。据调查,该病毒主要引起60 ~ 80 d的虾发病,养殖环境较差的池塘死亡率高达80%[7]。
对于野田村病毒的传染源、传播途径和感染方式尚无明确结论,亦无针对性治疗方法。为及早发现养殖凡纳滨对虾是否感染野田村病毒,及时对临床发病病例进行针对性处理,有必要建立一种准确、快速、灵敏、特异的检测方法。目前,针对水产动物病原检测的方法有原位杂交、ELISA、胶体金试纸条、PCR及LAMP等,在实际检测过程中,原位杂交和ELISA耗时长,灵敏度低;胶体金试纸条虽检测快,但灵敏度偏低;LAMP则存在假阳性较高的情况。因PCR检测方法有较高的特异性和敏感性,已广泛应用于水产动物病原微生物的检测和诊断。张达云等[8]建立了对虾偷死野田村病毒的检测方法,但尚未应用于对临床病料进行检测。潘晓艺等[9]建立了罗氏沼虾野田村病毒的 RT-PCR检测方法,但该方法对凡纳滨对虾野田村病毒无特异性。笔者建立针对凡纳滨对虾野田村病毒的特异性RT-PCR检测方法,为临床对该病的准确诊断检测提供一种快速、敏感、准确的技术手段,以尽早检测,及时处理,减少损失。
1 材料和方法
1.1 材料
野田村病毒阳性材料采自福建省漳州市某凡纳滨对虾养殖场,由广州利洋水产科技股份有限公司水产动物疾控中心实验室(下称“本实验室”)收集、PCR扩增和测序鉴定并保存。健康凡纳滨对虾采自广东省广州市。白斑症病毒(White spot syndrome virus,WSSV)、对虾杆状病毒(Baculovirus penaei,BP)、传染性皮下及造血器官坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)、肝胰腺细小病毒(Hepatopancereatic parvovirus,HPV)、黄头病毒(Yellow head virus,YHV)、传染性肌肉坏死病毒(Infectious myonecrosis virus,IMNV)、桃拉病毒(Taura syndrome virus,TSV)阳性材料由本实验室收集,并经PCR扩增和测序鉴定,保存。凡纳滨对虾野田村病毒重组质粒由本实验室构建保存。临床样品分别采自福建、广东、海南、广西、江苏、浙江、山东等地凡纳滨对虾养殖场。
大肠杆菌 DH5α感受态细胞、2×Taq PCR MasterMix、普通琼脂糖凝胶DNA回收试剂盒、高纯度质粒小量抽提试盒等购自天根生化科技(北京)有限公司,由本实验室繁殖保存。pMD19-T载体、RNAiso Plus RNA提取试剂、PrimeScriptTMRT Reagent Kit、DL2000 DNA分子标准购自宝生物工程(大连)有限公司。其他试剂均为国产分析纯。
1.2 引物设计与合成
根据GenBank中野田村病毒的基因序列(登录号:KM112247)设计 1对特异性的引物序列。上游引物:5′ -TTGAAGGCTATCTCGTGACAG-3′;下游引物:5′ -ATTAGCTTCGTATTTGCTGGC-3′,预扩增片段长度为413 bp,引物由华大基因科技股份有限公司合成。
1.3 RNA的提取
取野田村病毒阳性凡纳滨对虾的鳃和肌肉组织,加入600 μL 灭菌双蒸水,充分匀浆,于- 20 ℃冰箱冻融3次,以6 000 r/min低速离心,取上清液,用RNA抽提试剂RNAiso Plus提取上清液中的病毒RNA,所提RNA加入60 μL灭菌的焦碳酸二乙酯(DEPC)处理水溶解,保存于- 80 ℃下,备用。待检凡纳滨对虾及健康凡纳滨对虾组织样品也按照上述方法取样,研磨处理后抽提RNA。
1.4 RT-PCR检测及测序验证
反转录(RT)反应体系(10 μL):阳性样品的病毒 RNA 模板 7 μL,5×PrimeScript Buffer 2 μL,PrimeScript RT Enzyme Mix I 0.5 μL,Random 6 mers 0.5 μL。反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃下保存,得cDNA产物。
扩增体系(20 μL):2×Taq PCR MasterMix10 μL、灭菌双蒸水 6 μL、cDNA 模板 3 μL 和 10 μmol/L上下游引物各 0.5 μL。反应参数:95 ℃ 5 min,95 ℃30 s,55 ℃ 35 s,72 ℃ 30 s,共 30 个循环;72 ℃ 10 min,4 ℃保存。用12 mg/mL琼脂糖凝胶电泳检测扩增结果。用胶回收试剂盒纯化目的条带,与pMD19-T 载体于16 ℃下连接4 h以上,连接产物转化至E.coliDH5α感受态细胞,涂布于含50 µg/mL氨苄青霉素(Amp+)的LB固体培养基上,倒置于37 ℃恒温培养箱中培养12 h,从培养皿上挑取阳性重组质粒菌落接种于 5 mL含 50 µg/mL Amp+的LB液体培养基中,37 ℃下震荡培养12 ~14 h,用高纯度质粒小提试剂盒提取质粒。对重组质粒用F/R引物进行PCR 鉴定。重组质粒送华大基因科技股份有限公司测序,结果提交NCBI 中的BLAST进行序列比对,利用DNAStar5.0、cluxtal X等生物信息学软件进行序列分析。
1.5 RT-PCR反应条件的优化
参考文献[8-9]进行。通过调整 Taq酶浓度、dNTPs浓度、Mg2+浓度、引物浓度、模板浓度、退火温度、延伸时间等,对PCR反应体系和反应程序进行优化,以获得最优的反应体系和反应程序。
1.6 RT-PCR特异性试验
参考文献[8-9]进行。分别提取健康虾和野田村病毒阳性虾、WSSV阳性虾、IHHNV阳性虾、BP阳性虾、HPV阳性虾、YHV阳性虾、IMNV阳性虾和TSV阳性虾的核酸,作为模板,按照1.5中最优的反应体系和反应程序进行 RT-PCR,观察记录反应的特异性。
1.7 RT-PCR敏感性试验
参考文献[6-7]进行。对构建的重组质粒的浓度进行测定后,按 10倍递增稀释成 1 ng/mL、100 pg/mL、10 pg/mL、1 pg/mL、100 fg/mL、10 fg/mL、1 fg/mL,再以各浓度梯度的质粒作为反应的模板,根据1.5中已获得的最佳反应体系和反应程序进行PCR,反应结束后取8 μL PCR产物用12 mg/mL琼脂糖凝胶电泳检测扩增结果,检测所建立方法可检出的最低模板量。
1.8 临床样品检测试验
应用本研究建立的野田村病毒特异性 RT-PCR检测方法,对收集自福建、广东、海南、广西、江苏、浙江、山东等地的386份临床样品进行处理和RT-PCR检测,检验新建立的 RT-PCR检测方法的临床实用性。
2 结果
2.1 RT-PCR检测方法的建立
利用设计合成的针对于野田村病毒特异性引物,对野田村病毒阳性凡纳滨对虾样品进行RT-PCR扩增,得到与目的条带大小相符的特异性片段(图1)。将PCR阳性产物分别回收、连接、转化、克隆和测序,得到一条长度为413 bp的基因序列,序列比对结果显示,其与GenBank中获得的野田村病毒基因的序列同源性为99.8%。
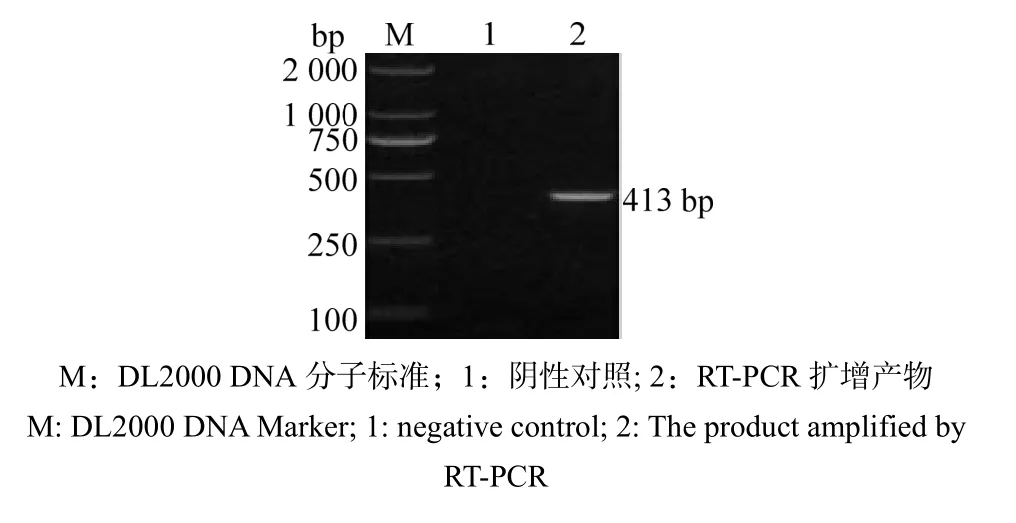
图1 野田村病毒阳性凡纳滨对虾样品的RT-PCR检测结果Fig.1 Electrophoresis of RT-PCR detection of nodavirus in positive Litopenaeus vannamei
2.2 RT-PCR反应条件的优化
比较不同反应体系和反应程序下扩增产物的电泳结果(图2 ~ 5),图2、3可见,Mg2+和引物用量对PCR反应结果无影响,图4、5可见,5 U/µL的 Taq酶使用量大于 0.5 µL时,退火温度高于52.7 ℃时,PCR扩增结果一致,但为防止出现非特异性扩增,选择 Taq酶使用量 0.5 µL,退火温度58 ℃,因此,最终确定反应体系(20 μL)为:2×Taq PCR MasterMix 10 μL,灭菌双蒸水 7 μL,cDNA 模板 2 μL,10 μmol/L 上下游引物各 0.5 μL;反应程序为:95 ℃ 5 min,95 ℃ 30 s,58 ℃ 35 s,72℃ 30 s,共30个循环;72 ℃ 10 min,4 ℃条件下保存。

图2 不同引物下PCR扩增结果Fig.2 PCR amplification at different primer level

图3 不同Mg2 +下PCR扩增结果Fig.3 PCR amplification at different Mg2+ level

图4 不同Taq酶下PCR扩增结果Fig.4 PCR amplification at different Taq level

图5 不同退火温度下PCR扩增结果Fig.5 PCR amplification at different annealing temperature
2.3 RT-PCR特异性试验
分别提取健康虾和野田村病毒阳性虾、WSSV阳性虾、IHHNV阳性虾、BP阳性虾、HPV阳性虾、YHV阳性虾、IMNV阳性虾和TSV阳性虾的核酸,作为模板,按照1.5中所获得最优的反应体系和反应程序进行(RT-)PCR,对新建方法进行特异性分析,结果表明,仅野田村病毒阳性样品可扩增出与试验预期大小相符的目的条带,健康虾样品及其他对照组样品均未扩增出任何条带(图6)。

图6 特异性扩增结果Fig.6 Result of specific amplification
2.4 RT-PCR敏感性试验
对不同浓度的质粒模板进行PCR扩增,检验新建方法的敏感性,结果表明,该RT-PCR检测方法可检出的最低质粒模板浓度为100 fg/mL(图7)。
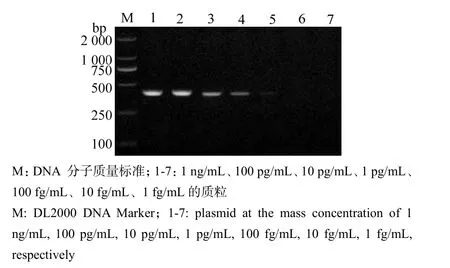
图7 敏感性试验结果Fig.7 Result of sensitivity detection
2.5 临床检测结果
用建立的针对野田村病毒的特异性RT-PCR检测方法,对386份采自福建、广东、海南、广西、江苏、浙江、山东等地养殖场的临床发病凡纳滨对虾样品进行野田村病毒RT-PCR检测,结果见表1。

表1 不同地区临床凡纳滨对虾样品野田村病毒的RT-PCR检测结果Table 1 Detection results of nodavirus in clinical samples collected from different areas
3 讨论
目前,世界范围内危害养殖凡纳滨对虾的主要病原有白斑症病毒(WSSV)、对虾杆状病毒(BP)、传染性皮下及造血器官坏死病毒(IHHNV)、肝胰腺细小病毒(HPV)、黄头病毒(YHV)、传染性肌肉坏死病毒(IMNV)、桃拉病毒(TSV)、虾肝肠胞虫(EHP)和肝胰腺坏死性细菌(AHPND)等,为及时发现和监测这些病原体,均已建立针对性的快速检测技术[10-14]。对于凡纳滨对虾野田村病毒,其危害严重程度、流行程度及传播方式尚不清楚,亦无针对性的治疗措施。
RT-PCR 检测技术作为水产动物病原检测的一种常规高灵敏的病原检测手段,已应用于许多病原微生物检测。本研究参照GenBank中凡纳滨对虾野田村病毒的基因序列,设计合成了1对预扩增片段长为413 bp的特异性检测引物,建立的针对凡纳滨对虾野田村病毒的特异性RT-PCR 检测方法,可以从 100 fg/mL重组质粒中扩增出特异性的目标片段,对健康虾、WSSV阳性虾、BP阳性虾、IHHNV阳性虾、HPV阳性虾、YHV阳性虾、IMNV阳性虾和TSV阳性虾的检测均呈阴性,证明该 RT-PCR检测方法对凡纳滨对虾野田村病毒有高度特异性和灵敏度。本研究建立的RT-PCR检测方法,相对于其他检测方法,有操作简单、检测时间短等优越性,可在4 h内完成大量样品的检测,适用于对大量临床样品的快速检测。
对采集的386份临床样品检测结果显示,野田村病毒在福建地区的检出率较高,可能与样品的采集时间和野田村病毒的流行水温有关,福建地区的样品主要采集于3月份,池塘水温24 ℃。进一步对阳性样品测序比对,结果准确,表明该方法可应用于临床病料的检测。本研究建立的RT-PCT检测方法,可为凡纳滨对虾野田村病毒的流行情况和传播途径的调查提供可靠的技术手段,为临床对该病的预防控制提供理论依据。

