东营市北部海域沉积物和贝类中石油烃分布与污染评价❋
窦 祥, 张汉珍, 李广经, 崔鸿武, 孟范平❋❋
(1.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100; 2.东营市海洋与渔业环境监测中心,山东 东营 257091)
随着经济的发展,人类对能源的需求不断扩大,石油已成为人类最主要的能源之一。在石油的开采、加工和利用过程中,可能使石油进入海洋环境中,从而引起海洋水质的污染和破坏。石油烃 (TPHs) 是近岸海域的主要污染物之一,其中含有多种难以被微生物降解的致癌物质,其亲脂性使之易在海洋生物的脂肪内富集,并可通过食物链的传递直接危害人体健康[1-2]。有研究发现,双壳类、甲壳类动物对TPHs的积累能力明显高于鱼类和头足类[3]。东营市位于山东半岛西北部、渤海湾南岸。境内有19条主要河流,其中,黄河是流经东营市的最大河流,在该市东部流入渤海。在东营市北部,主要入海河流为潮河、马新河、沾利河、草桥沟和挑河。石油产业是东营市的经济主体,石油开采、炼化等行业的废水通过雨水冲刷排到河中,使河水普遍受到油类物质污染[4]。蔡学军等根据1993—2003年监测资料的评价结果表明[5],三角洲地区19条主要河流中,除黄河外,其他河流均已受到不同程度污染,而潮河等属于严重污染,其中,79%的河流受石油类污染,石油类最大超标15.6倍。2012年有研究报道[4],草桥沟等河流的油类污染最为严重,超标率 (与《地表水环境质量标准》(GB3838-2002)[6]三类标准相比) 为100%。
东营市周边拥有丰富的滩涂和浅海资源,是黄渤海经济鱼虾类的产卵场和幼体育肥场,也是全国著名的贝类主产区。国家海洋局2008年将该市北部的滩涂及-5 m浅海区域 (118°07′30″E~118°25′00″E,38°02′49″N~38°16′44″N) 设立为“东营河口浅海贝类生态国家级海洋特别保护区”(以下简称“贝类保护区”),面积 396.23 km2。因此,该海域既有重要的海洋经济地位,又有较高的生态敏感性。周围陆域产生的石油类污染物能否通过河流输送入海并对海洋环境和生物质量造成影响值得关注。本研究拟根据2016年10月的监测结果,分析东营市北部海域表层沉积物和双壳类中TPHs的含量范围、空间分布和影响因素, 以便为该海域的海洋环境管理以及TPHs污染控制提供科学依据。
1 材料与方法
1.1 站位布设与样品采集
2016年10月,在东营市北部海域布设14个站位,其中6个站位位于贝类保护区内(见图1)。各采样站位的海洋和陆地污染源分布情况见表1。按照《海洋监测规范》(GB 17378.5-2007)[7],在每个站位上,利用抓斗式采泥器采集适量表层 (0~20 cm) 沉积物样品,现场去除其中的砾石、动植物残体等杂物后,装入预先经硝酸溶液 (1∶3,v/v) 浸泡过并用去离子水淋洗干净的棕色广口玻璃瓶中。采用DZS-718型便携式多参数水质分析仪 (上海雷磁) 现场测定氧化还原电位 (Eh)。同时,采用单船底拖网方式采集双壳类动物 (文蛤(Meretrixmeretrix)样品10个,毛蚶(Scapharcasubcrenata)样品7个,四角蛤蜊(Mactraveneriformix)样品6个),用聚乙烯袋盛装。具体位置详见表1,沉积物和生物样品均冷藏保存 (4 ℃下) 并在上岸后立即运回实验室。室内测量每个站位双壳类动物的壳长,然后解剖分离出软组织,一部分用于含水率和肥满度测定,另一部分在-80 ℃保存,用于石油烃 (TPHs) 分析。
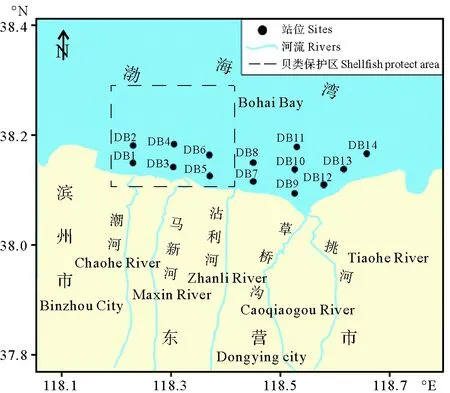
图1 采样站位分布图Fig.1 Map of the sampling sites in the northern coast of Dongying city
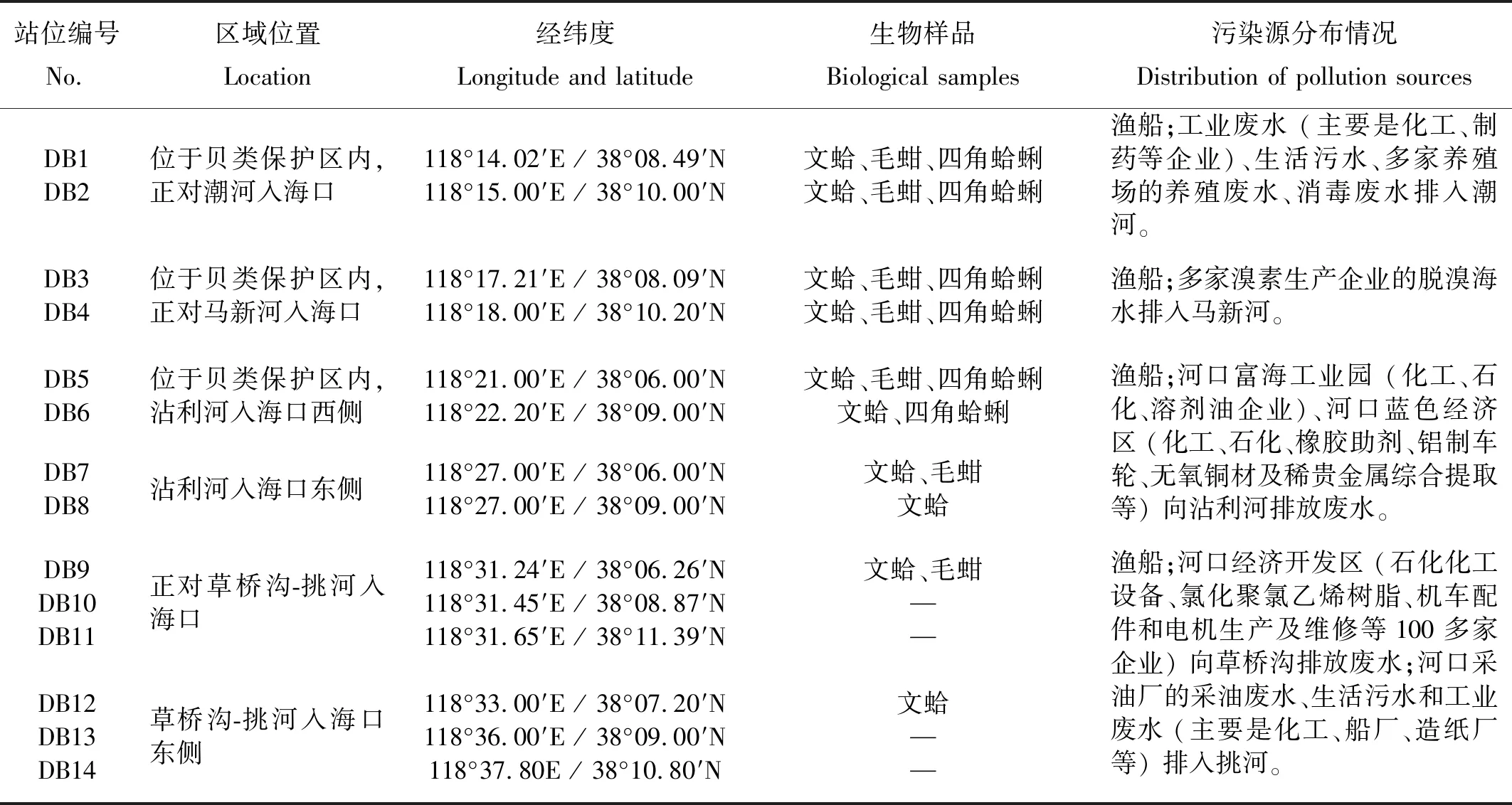
站位编号 No.区域位置Location经纬度Longitude and latitude生物样品Biological samples污染源分布情况Distribution of pollution sourcesDB1DB2位于贝类保护区内,正对潮河入海口118°14.02′E / 38°08.49′N118°15.00′E / 38°10.00′N文蛤、毛蚶、四角蛤蜊文蛤、毛蚶、四角蛤蜊渔船;工业废水 (主要是化工、制药等企业)、生活污水、多家养殖场的养殖废水、消毒废水排入潮河。DB3DB4位于贝类保护区内,正对马新河入海口118°17.21′E / 38°08.09′N118°18.00′E / 38°10.20′N文蛤、毛蚶、四角蛤蜊文蛤、毛蚶、四角蛤蜊渔船;多家溴素生产企业的脱溴海水排入马新河。DB5DB6位于贝类保护区内,沾利河入海口西侧118°21.00′E / 38°06.00′N118°22.20′E / 38°09.00′N文蛤、毛蚶、四角蛤蜊文蛤、四角蛤蜊渔船;河口富海工业园 (化工、石化、溶剂油企业)、河口蓝色经济区 (化工、石化、橡胶助剂、铝制车轮、无氧铜材及稀贵金属综合提取等) 向沾利河排放废水。DB7DB8沾利河入海口东侧118°27.00′E / 38°06.00′N118°27.00′E / 38°09.00′N文蛤、毛蚶文蛤DB9DB10DB11正对草桥沟-挑河入海口118°31.24′E / 38°06.26′N118°31.45′E / 38°08.87′N118°31.65′E / 38°11.39′N文蛤、毛蚶——渔船;河口经济开发区 (石化化工设备、氯化聚氯乙烯树脂、机车配件和电机生产及维修等100多家企业) 向草桥沟排放废水;河口采油厂的采油废水、生活污水和工业废水 (主要是化工、船厂、造纸厂等) 排入挑河。DB12DB13DB14草桥沟-挑河入海口东侧118°33.00′E / 38°07.20′N118°36.00′E / 38°09.00′N118°37.80E / 38°10.80′N文蛤——
注:- 未采到生物样品。-:No biological samples were collected.
1.2 沉积物样品室内分析
硫化物测定:采用亚甲基蓝分光光度法[7]测定湿样中硫化物的含量,然后根据含水率转化为干基含量 (×10-6)。
细颗粒 (<63 μm) 组分 (FGS) 含量:取自然风干样品,采用MS2000型激光粒度分析仪 (英国马尔文公司) 测定不同角度上的散射光强度,由此得到样品中粉砂、黏土 (即FGS) 的质量分数。
有机质 (OM):取风干且磨细过筛 (80目) 的样品,采用重铬酸钾氧化还原—容量法[7]测定,单位为10-2。
TPHs:采用荧光分光光度法[7]测定。称取(1±0.000 1) g风干且磨细过筛的样品于10 mL具塞比色管中,加脱芳石油醚至标线,加塞振荡2 min,放置1 h后,再强烈振荡2 min,静置5 h (其间不时摇动) 得到浸取液,于激发波长310 nm、发射波长360 nm条件下测定荧光强度,据此计算TPHs含量 (×10-6,干基)。分析样品同时,通过测定近海海洋沉积物标准物质 (GBW(E)080913,国家海洋环境监测中心) 进行质量控制,TPHs的加标回收率为82.58%~87.18%,在标准物质允许的误差范围之内。
1.3 双壳类样品室内分析
肥满度 (或条件指数,CI):采用Moschino and Marin[8]的方法测定。每个站位随机选取10只生物个体,分别测定其软组织和壳的干重 (40 ℃下烘至恒重),则两者的比值即为CI值。
TPHs:采用荧光分光光度法[9]测定。将每个站位的生物软组织解冻后切细混匀,称取(2±0.000 1) g样品于100 mL皂化瓶中,加入6 mol·L-1的NaOH溶液20 mL,室温下避光皂化10 h (期间每隔1 h摇动数次),再加入20 mL无水乙醇,充分摇匀,4 h后将皂化液用CH2Cl2(每次10 mL) 萃取2次,将两次有机相合并后于50 ℃水浴中旋蒸至0.5 mL,N2吹干,准确加入10.0 mL脱芳石油醚溶解残留物。用荧光分光光度计 (F-4600型,日本日立) 在激发波长310 nm、发射波长360 nm条件下测定相对荧光强度 (扣除分析空白值),由标准曲线查得TPHs浓度,根据样品质量及干/湿比,计算TPHs含量 (×10-6,干基)。同时,为便于与《海洋生物质量》(GB18421-2001)[10]标准进行比较,根据软组织湿样的含水率,将TPHs含量转化为湿基含量。样品分析过程中,采用国家海洋环境监测中心生产的标准油为标准物质,各站位样品的加标回收率在87.5%~96.9%之间。
1.4 数据统计分析
各站位沉积物、生物样品的TPHs含量以及OM、Eh、硫化物均以平行双样测定结果的平均值表示;壳长、CI值以10只个体测定结果平均值表示。数据统计分析采用SPSS19.0软件,利用双变量 Pearson相关性分析研究沉积物TPHs、软组织TPHs、粒度、OM、Eh、硫化物、CI、壳长之间的相关性 (统计显著性水平为p<0.05和p<0.01)。当样品中TPHs含量未检出时,采用检出限的50%进行计算。
2 结果与讨论
2.1 沉积物基本性质
由图2可知,研究区域的沉积物中FGS的含量范围为35.37%~94.72%,平均为55.73%,其中,DB10、DB11和DB14站位的FGS含量较高。沉积物中OM、硫化物的含量均较低,分别为0.04×10-2~0.33×10-2和0.29×10-6~15.05×10-6,远低于《海洋沉积物质量》(GB18668-2002)[11]一类标准 (2×10-2与300×10-6),表明附近陆域输入的有机物质总体上较少。Eh范围为-156.43~148.54 mV,大多数站位为正值,表明研究区域沉积环境总体上处于氧化状态,两个站位 (DB10和DB14) 的Eh为负值,可能是由于相对较多的有机质输入造成沉积环境中溶解氧被过多消耗,而表现出较强还原性。
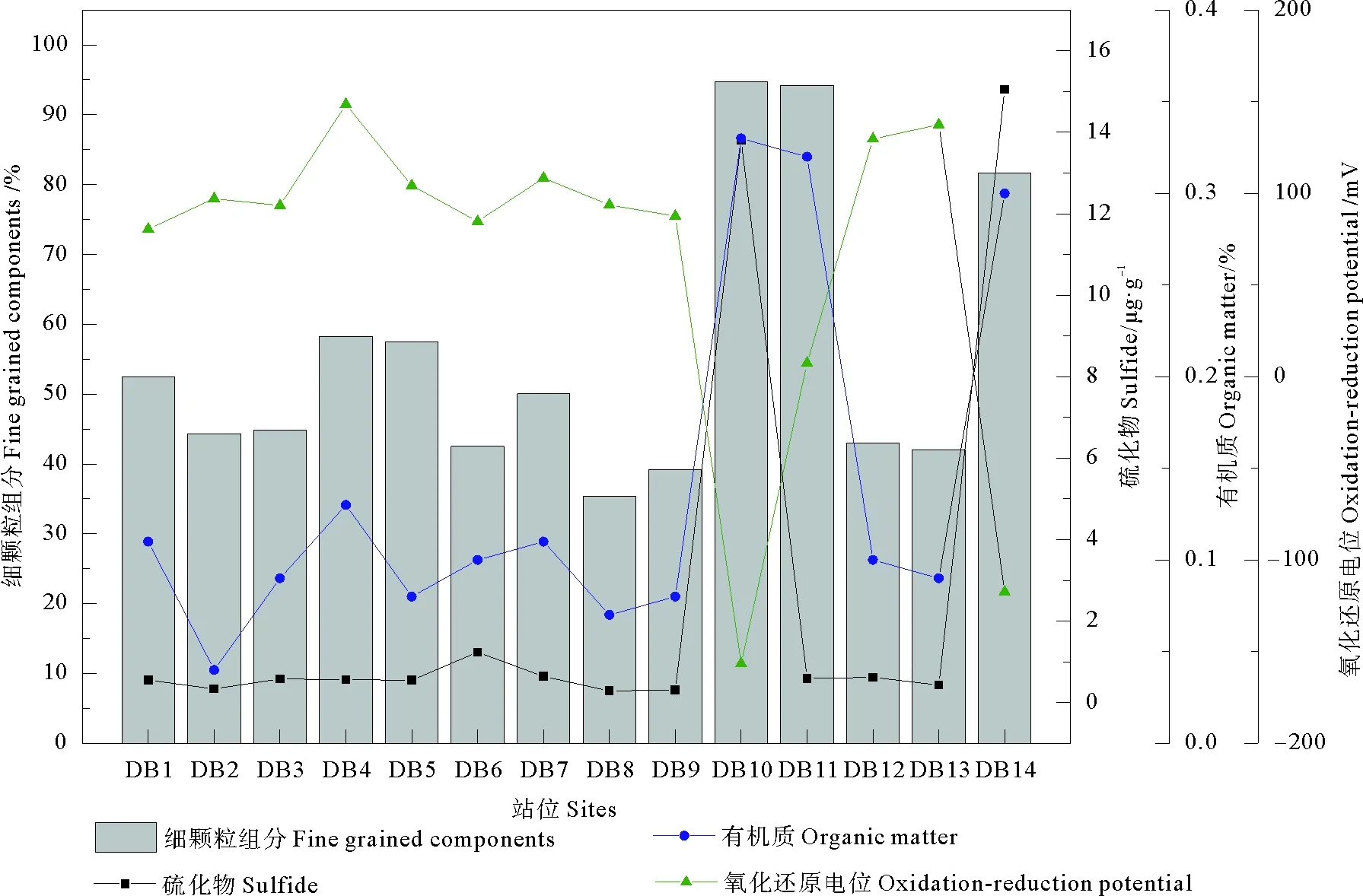
图2 研究区域14个站位沉积物的理化特征
2.2 沉积物中TPHs的含量及其空间分布
研究区域沉积物中TPHs含量范围为ND~125.60×10-6,平均为20.27×10-6(见图3),远低于《海洋沉积物质量》(GB18668-2002)[11]一类标准 (500×10-6)。国外有研究指出[12],在未受污染的河口沉积物中,TPHs浓度几乎均小于10×10-6。研究区域内仅有3个站位 (DB10、DB11、DB14) 的TPHs含量高于该临界值,而贝类养殖区内6个站位的TPHs含量均低于该临界值,这对于贝类养殖区的健康发展以及贝类产品的食用安全非常有利。
TPHs含量的空间变化明显,横向上总体呈现“东高西低”趋势。DB1~DB8站位的TPHs均在3.0×10-6以下 (除DB1外),而位于草桥沟-挑河入海口处的DB10、DB11、DB14站位的TPHs含量则是其它站位的10~50倍。纵向上,由于所设置的14个站位距离岸边较近,并不存在明显的“近岸高、远岸低”趋势。与文献报道的国内外其他海域相比 (见表2),本研究区域沉积物中TPHs含量处于较低水平,仅高于波斯湾北部沿岸及红树林区域的沉积物[13]。
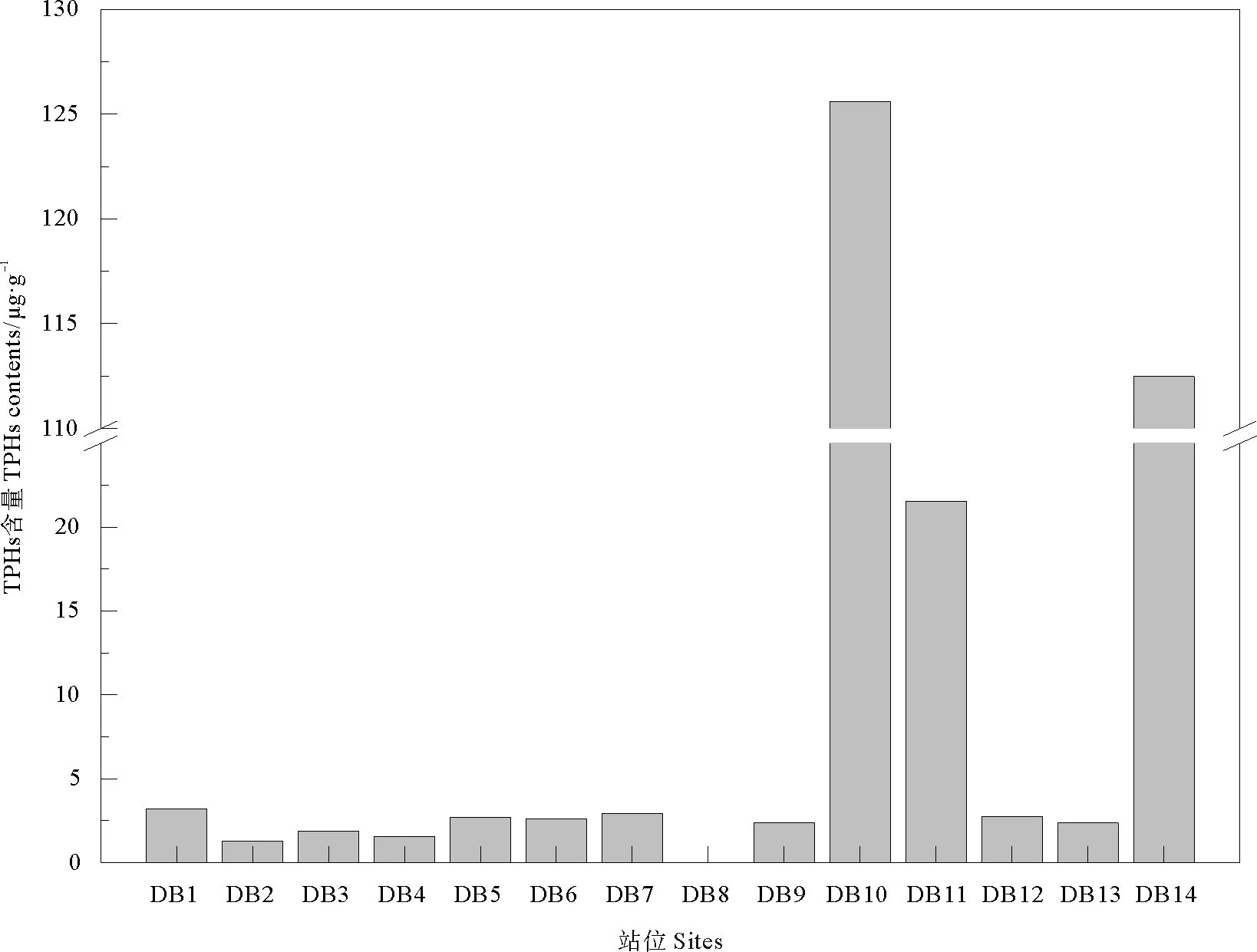
图3 东营市北部海域沉积物中TPHs含量
2.3 影响沉积物TPHs分布的因素分析
在不考虑自然因素影响的情况下,近岸海域沉积物中的污染物既可能来自陆源污染源,也可能来自海洋污染源。在陆域范围内,东营市北部海域的入海河流有5条。2016年3—11月,笔者曾在这些河流入海口处进行9期河水采样分析(12、1和2月因河水结冰而无法采样,具体监测数据未列出,将另文发表),根据河水中石油类浓度以及同步测量的河水流量,计算得到石油类入海通量依次为:潮河(16.85 t·a-1)、挑河(6.55 t·a-1)、草桥沟(2.31 t·a-1)、沾利河(1.76 t·a-1)、马新河 (1.32 t·a-1),合计为28.79 t·a-1。可见,研究区域西部毗邻的潮河向海输送的石油类数量最大,占总量的58.53%,而挑河和草桥沟的石油类输送量之和仅约为潮河的一半。这与2.2节提到的沉积物TPHs含量“东高西低”分布特征并不一致。就海洋污染源而言,该海域的主要功能是海水养殖, 作为主要运输工具的渔船会向海洋中排放含油废水,由于这些渔船主要在研究区域的西半部活动,TPHs应在这些位置的沉积物中有较多积累,但是实测结果并非如此。

表2 东营市北部海域与其它近海海域中沉积物、双壳类中TPHs含量的比较
注:ND 未检出;dw 干基含量;ww 湿基含量。ND:not detected;dw:dry weight;ww:wet weight.
相反,本研究发现,研究区域的沉积物基本性质与TPHs积累存在密切关系(见表3)。其中,FGS含量与TPHs之间呈显著正相关 (r=0.770,p<0.01)。这是因为,细颗粒是最具化学活性的沉积相[30],其比表面积相对较大,容易吸附TPHs[21]。再者,同粗颗粒物质相比,细颗粒之间孔隙度较小,吸附到沉积物表面石油类等有机物不易被氧化分解[31],因而容易保持稳定。同样,在还原性 (即Eh较低) 条件下,沉积物表面的有机污染物因不易降解而能较长时间存在和积累[32],使沉积物中OM含量达到较高水平,这进一步增强了沉积环境的还原性,并促进硫酸盐向硫化物的转化。这是TPHs与Eh呈显著负相关 (r=-0.961,p<0.01) 而与OM (r=0.829,p<0.01)、硫化物 (r=0.986,p<0.01) 呈显著正相关的原因。在南非Buffalo河口的调查研究中,也发现沉积物TPHs含量与OM之间的显著相关性[33]。由此认为,当人为活动产生的石油类污染物入海后,其在沉积物中的积累量因沉积物理化性质的不同而不同。

表3 沉积物TPHs含量与FGS、OM、Eh、硫化物的相关系数 (r)Table 3 Pearson’s correlation coefficients (r) between TPHs and FGS, OM, Eh and sulphide in sediments from the studied area
注:**p<0.01.
2.4 TPHs在双壳类中的蓄积及其影响因素分析
根据表4,在采集到的3种双壳类动物中,文蛤(10个站位)、毛蚶 (7个站位)、四角蛤蜊 (6个站位) 的壳长平均值分别为3.80、3.62和3.41 cm;CI平均值分别为8.26%、13.49%、6.75%。在该海域内,四角蛤蜊对TPHs的蓄积性最高 (平均含量为188.47×10-6(dw) 或46.40×10-6(ww) );其次为毛蚶 (平均含量为118.05×10-6(dw) 或38.06×10-6(ww) );而文蛤积累的TPHs最低 (平均含量为86.23×10-6(dw) 或18.73×10-6(ww) )。
与我国《海洋生物质量》(GB18421-2001)[10]一类标准 (15×10-6,ww)相比,文蛤TPHs在8个站位超标,毛蚶和四角蛤蜊的TPHs含量则在所有站位超标,三者的TPHs最大值 (分别出现在DB2、DB7、DB2站位) 分别为标准值的1.77、4.61和4.55倍。根据崔毅的研究[3],1989年该区域双壳类TPHs的含量范围为 (4.12~11.12)×10-6,平均8.45×10-6(ww)。与其相比,本次调查所测得的文蛤、毛蚶和四角蛤蜊的TPHs含量分别达到当年最大值的1.24~2.39倍、2.26~6.22倍和2.48~6.14倍。与国内外其它近岸海域相比 (见表2),该海域3种双壳类的TPHs含量也处于较高水平,仅次于北部湾的波纹巴非蛤和文蛤[26-27],但比其它海域的双壳类高数倍至一个数量级。由此认为,工业化和城市化的发展对东营市北部海域的贝类造成了严重污染影响。
在贝类保护区之外的8个站位上,文蛤、毛蚶、四角蛤蜊较少被采到,主要是因为近年来当地海洋渔业部门开展的贝类人工增殖放流活动均集中在贝类保护区内。3种双壳类中,文蛤在保护区外的分布较广(在4个站位采到),可能是因为该物种具有顺潮流迁移的习性,但是较慢的速度使其只能迁移较短距离[34]。此外,某些站位(DB10、DB11、DB14)沉积物中较高含量的TPHs也会抑制贝类生长。双壳类属于滤食性生物,其对饵料中各种成分(包括油分)几乎不加选择地摄入[35],而其自身用于烃类物质代谢的混合氧化系统存在缺陷,造成TPHs中不易降解且毒性较大的多环芳烃(PAHs)组分在生物体内积累[36]而对双壳类产生较大毒害。
相关性分析表明,对于有双壳类动物分布的站位,任一物种的TPHs积累量与沉积物TPHs含量之间无显著相关性 (p>0.05),可能是因为该区域不同站位间(不包括DB10、DB11、DB14站位)的沉积物TPHs含量差异不明显所致。当然,贝类的TPHs积累量较高也可能与海水的TPHs污染有关。虽然本研究未对海水TPHs进行监测,但是,已有研究证明[37-38],双壳类对海水TPHs具有明显富集能力,在TPHs浓度为0.1、0.2和0.4 mg·L-1的海水中培养15 d后,菲律宾蛤仔对石油烃的生物富集系数 (BCF) 分别达到231.2、137.15和113.30。今后应通过进行海水、沉积物、生物体的TPHs同步测定及统计分析,进一步识别影响该区域双壳类TPHs积累的主要因素。
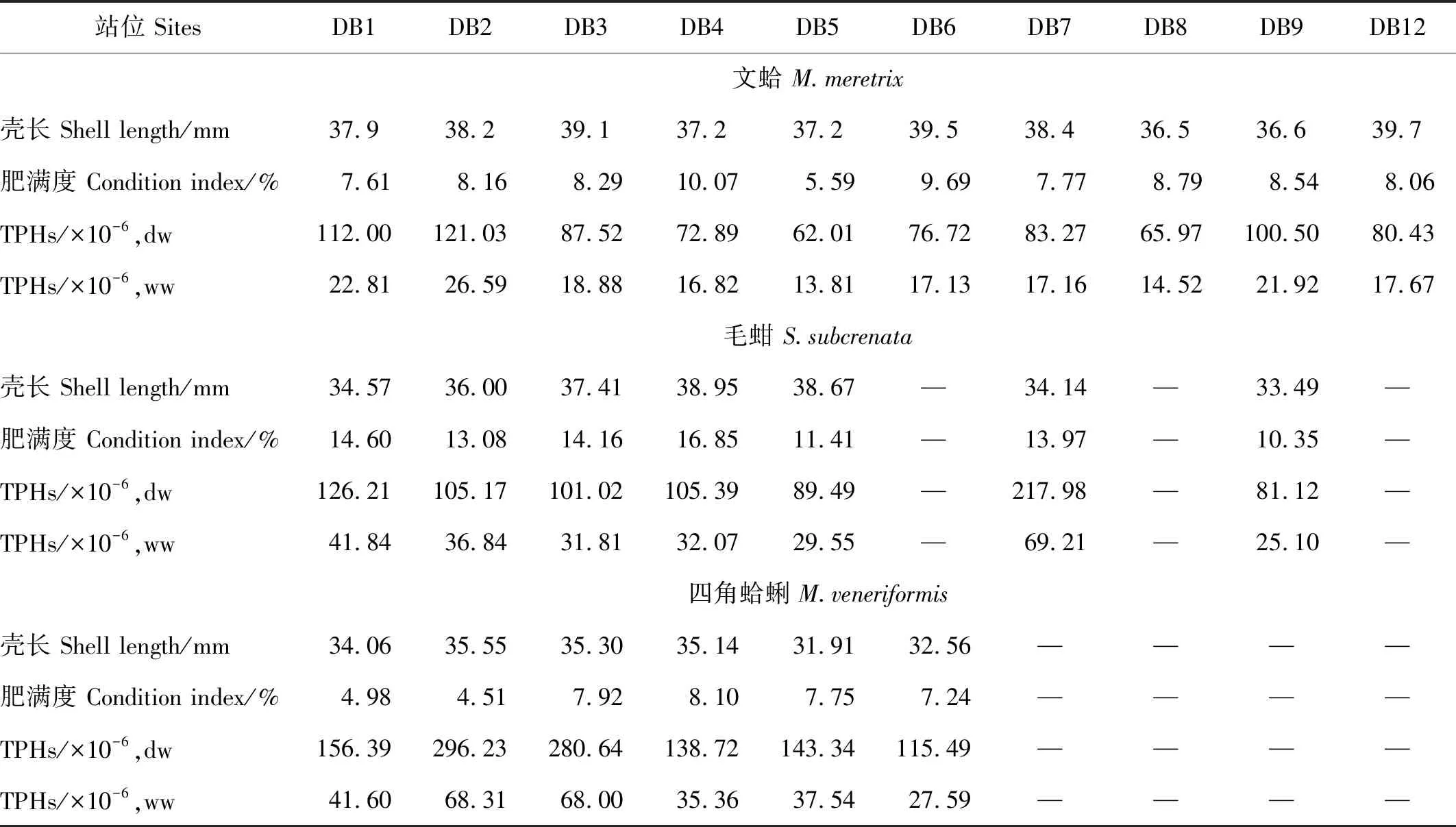
表4 研究区域3种双壳类的生长特征及其软组织中TPHs含量
注:—未采到双壳类样品;dw 干基含量;ww 湿基含量。—:No bivalve samples were collected;dw:dry weight;ww:wet weight.
3 结论
(1) 东营市北部海域沉积物中TPHs含量在ND~125.60×10-6之间,与国内外其它海域相比处于较低水平,也符合《海洋沉积物质量》(GB18668-2002) 一类标准。TPHs空间分布总体呈现“东高西低”趋势。
(2) 人为活动排放的TPHs在沉积物中的积累量与沉积物的理化性质有密切关系。较高含量的FGS、OM、硫化物以及还原性条件有利于TPHs的积累。
(3) 四角蛤蜊、毛蚶和文蛤的软组织中TPHs的平均含量分别为46.40×10-6(ww)、38.06×10-6(ww)和18.73×10-6(ww)。绝大多数站位双壳类的TPHs含量比30年前的文献报道值有成倍增加,既明显超过《海洋生物质量》(GB18421-2001)一类标准,也高于国内外大多数海域双壳类的TPHs污染水平,表明该海域双壳类已受到人为排放石油类的污染压力。
(4) 在TPHs含量较高的DB10、DB11、DB13、DB14站位上少有或没有双壳类分布,其它站位的TPHs生物富集量与沉积物TPHs含量无显著相关性。

