雷公藤甲素对内毒血症大鼠血管低反应性的影响
宗佳琪,王烁阳,苏 萍,郭马娣,刁光华,王 静,周萍萍,王海华
(1.皖南医学院生理教研室,安徽 芜湖 241002;2.皖南医学院临床医学院,安徽 芜湖 241002)
内毒血症是革兰氏阴性菌侵入血液,并在其中大量繁殖、崩解后释放出大量炎症因子所致,脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁的主要成分。LPS可以刺激体内巨噬细胞、中性粒细胞和内皮细胞,产生一系列的炎症细胞因子如肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白细胞介素-6(interleukin-6,IL-6)。这些炎症因子促使全身血管对缩血管物质和舒血管物质的反应降低,即血管低反应性,若不积极进行治疗,将发展成持续低血压、致死性感染性休克、全身器官衰竭,最终导致死亡[1-2]。临床上,通常采用抗生素和糖皮质激素作为治疗内毒血症的常规手段,但治疗效果不佳[3-4]。因此,本研究旨在为治疗内毒血症导致的血管低反应性提供新的干预策略。雷公藤甲素(triptolide,TP)具有各种药理活性,如抗炎、免疫抑制、抗菌作用,是从中药雷公藤中提取出来的二萜类成分[5]。研究证实,TP通过减轻LPS刺激的Toll样受体4(toll-like receptor-4,TLR4)、核因子-κB(nuclear factor kappa B,NF-κB)等蛋白的表达,从而减轻小鼠急性肺损伤[6]。TP能改善链脲佐菌素诱导的糖尿病心肌病大鼠心脏的收缩功能和心肌能量代谢[7]。然而,TP是否能够调节LPS内毒血症大鼠模型的胸主动脉血管张力仍不清楚。因此,通过复制内毒血症大鼠模型观察TP对其血液流变性及血管张力的作用,从而为内毒血症的临床治疗提供新的实验依据。
1 材料
1.1 主要试剂 TP(T819207,纯度≥98%):上海麦克林生化科技有限公司;LPS[L82749(026:B6)]、氯化乙酰胆碱(acetylcholine,ACh;纯度≥99%)、去氧肾上腺素(phenylephrine,Phe;纯度≥98%)、左旋硝基精氨酸甲酯(N-nitro-L-arginine-methyl-ester,L-NAME;纯度≥99%)、亚甲蓝(methylene blue,MB;纯度≥99%):美国Sigma公司;K-H液(NaCl 118.4 mmol/L,KCl 4.7 mmol/L,NaHCO324.5 mmol/L,MgSO4·7H2O 1.1 mmol/L,KH2PO41.2 mmol/L,CaCl2·2H2O 2.55 mmol/L,C6H12O6·H2O 11.1 mmol/L):国产分析纯。
1.2 主要仪器 体外组织灌流装置(PL3508B5/C-V)和Power Lab系统:澳大利亚埃德仪器公司。
2 方法
2.1 内毒血症大鼠模型复制 60只SD雄性大鼠,体质量为(220±20)g,SPF级,购自安徽省合肥市蜀山实验动物繁殖中心[动物生产许可证号为SCXK(鲁)2014-0007],室温24 ℃下适应性喂养7 d。用LPS 10 mg/kg腹腔注射复制内毒血症大鼠模型。内毒血症模型复制成功的标准:注射LPS 6 h后,动物没有死亡,并表现出盘缩成团、萎靡不振、腹泻、活动力低下,伴有发绀、震颤以及血压明显下降。
2.2 实验动物分组及处理 将大鼠随机分为6组(n=6):正常组(NC组)、内毒血症模型组(LPS组)、TP低浓度干预组(LPS+TP-L组)、TP中浓度干预组(LPS+TP-M组)、TP高浓度干预组(LPS+TP-H组)和多黏菌素B组(LPS+PMX-B组)。
TP用0.1% DMSO溶解,TP低剂量(25 μg/kg)、中剂量(50 μg/kg)、高剂量(100 μg/kg)干预组在复制内毒血症模型组前15 min进行腹腔注射,LPS+PMX-B组(0.2 mg/kg)以尾静脉注射。所有大鼠均随机直接复制模型和给药后进行相应的实验。所有动物实验均经学校伦理委员会批准进行。
2.3 大鼠平均动脉压(mean arterial blood pressure,MABP)和血流动力学指标测定 采用25%乌拉坦4 mg/kg腹腔注射麻醉大鼠并固定,从大鼠右颈总动脉插管监测MABP,继而将插管插入心室,测量大鼠血流动力学指标:心率(heart rate,HR)、左室舒张压(left ventricular diastolic pressure,LVDP)、左心室内压最大上升/下降速率(maximal rate of the increase/decrease of left ventricular pressure,±dp/dtmax),待以上指标稳定后,记录30 min数据并进行统计学分析。
2.4 胸主动脉环的制备 大鼠采血后,开胸迅速取出其胸腹段主动脉,置入4 ℃预冷的K-H液(pH 7.4)中。按照文献[8]的方法将其分成3~4 mm的血管环4段,采用棉签轻轻摩擦以去除内皮,制备去内皮血管环。通过PL3508B5/C-V体外组织灌流装置和Power Lab系统记录血管环张力变化,并检测其内皮完整性。内皮完整的血管环记为E+,去内皮的血管环记为E-。
2.5 血管环收缩和舒张功能的测定 累计加入10-8~10-5mol/L Phe刺激血管环(E+和E-),观察并记录其对血管环收缩反应的影响;用10-6mol/L Phe预收缩血管环(E+),待其收缩达到平台期后累计加入10-8~10-4mol/L ACh,观察并记录其对血管环舒张反应的影响;分别用10-4mol/L的非特异性一氧化氮合酶(nitric oxide synthase,NOS)抑制剂L-NAME或10-5mol/L的鸟苷酸环化酶(guanylate cyclase,GC)抑制剂MB孵育血管环(E+)20 min,再累计加入10-8~10-5mol/L Phe刺激,观察并记录其对E+血管环收缩反应的影响。整理数据,按以下公式计算血管收缩率和血管舒张率:血管舒张率=(Phe刺激后最大收缩张力-累加ACh后的张力)/(Phe刺激后最大收缩张力-基础张力)×100%;血管收缩率=(累加Phe刺激后的收缩张力-基础张力)/空白组收缩张力均值×100%。
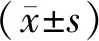
3 结果
3.1 各组大鼠MABP比较 与NC组比较,LPS组大鼠MABP明显降低(P<0.05);LPS+TP-H组与PMX-B组大鼠MABP无明显改变(P>0.05);与LPS组比较,LPS+TP-M组、LPS+TP-H组与LPS+PMX-B组大鼠MABP均明显升高(P<0.05)。见图1。

注:A. NC组;B. LPS组;C. LPS+TP-L组;D. LPS+TP-M组;E. LPS+TP-H组;F. LPS+PMX-B组;与NC组比较,*P<0.05;与LPS组比较,#P<0.05

3.2 各组大鼠血流动力学比较 与NC组比较,LPS组大鼠HR、LVDP和±dp/dtmax均显著降低(P<0.05);与LPS组比较,LPS+TP-L组、LPS+TP-M组、LPS+TP-H组和LPS+PMX-B组大鼠HR和±dp/dtmax均显著升高(P<0.05),LPS+TP-H组和LPS+PMX-B组大鼠LVDP均显著升高(P<0.05)。见图2。

注:A. NC组;B. LPS组;C. LPS+TP-L组;D. LPS+TP-M组;E. LPS+TP-H组;F. LPS+PMX-B组;与NC组比较,*P<0.05;与LPS组比较,#P<0.05

3.3 TP对血管环张力的影响
3.3.1 TP对Phe诱导的主动脉环(E+)收缩反应的影响 与NC组比较,不同浓度Phe使LPS组主动脉环的收缩率明显降低(P<0.05);与LPS组比较,TP干预组和LPS+PMX-B组主动脉环的收缩率明显上升并呈浓度依赖性递增(P<0.05)。见图3。

注:与NC组比较,*P<0.05;与LPS组比较,#P<0.05

3.3.2 TP对Phe诱导的去内皮主动脉环(E-)收缩反应的影响 与NC组比较,在不同浓度Phe刺激下,LPS组去内皮血管环的收缩率明显降低(P<0.05);与LPS组比较,TP干预组对不同浓度Phe刺激的去内皮血管收缩率无显著变化(P>0.05)。见图4。
3.3.3 TP对ACh诱导的主动脉环(E+)舒张反应的影响 与NC组比较,在不同浓度ACh刺激下,LPS组大鼠主动脉环的舒张率明显降低(P<0.05);TP干预组大鼠主动脉环舒张率呈浓度依赖性递增,与LPS组比较,LPS+TP-M组、LPS+TP-H组和LPS+PMX-B组各浓度ACh引起的主动脉环舒张率均显著升高(P<0.05)。见图5。
3.3.4 TP对Phe诱导的L-NAME和MB预处理主动脉环(E+)收缩反应的影响 L-NAME和MB孵育20 min后,各组主动脉环在Phe的刺激下,收缩幅度均显著升高(P<0.05);而经L-NAME预处理前后,LPS组主动脉环对10-5mol/L Phe引起的收缩率差值显著高于LPS+TP-H组和NC组[LPS组(61.55%±14.54%)vsLPS+TP-H组(43.09%±9.75%),P=0.023;LPS组(61.55%±14.54%)vsNC组(36.75%±17.98%),P=0.018]。而经MB预处理前后,LPS组主动脉环对10-5mol/L Phe引起的收缩率差值显著高于LPS+TP-H组和NC组[LPS组(49.59%±11.49%)vsLPS+TP-H组(32.27%±3.87%),P=0.023;LPS组(49.59%±11.49%)vsNC组(29.74%±11.39%),P=0.044]。见表1、表2。

注:与NC组比较,*P<0.05;与LPS组比较,#P<0.05


注:与NC组比较,*P<0.05;与LPS组比较,#P<0.05

图5 TP对ACh诱导的主动脉环(E+)舒张反应的影响
注:与NC组比较,*P<0.05;与LPS组比较,#P<0.05;与LPS+TP-L组比较,◇P<0.05;与LPS+TP-M组比较,◆P<0.05;与LPS+TP-H组比较,□P<0.05;与LPS+PMX-B组比较,▲P<0.05;与NC+L-NAME组比较,△P<0.05;与LPS+L-NAME组比较,◎P<0.05
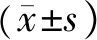
表2 TP对Phe诱导的MB预处理主动脉环(E+)收缩率的影响
注:与NC组比较,*P<0.05;与LPS组比较,#P<0.05;与LPS+TP-L组比较,◇P<0.05;与LPS+TP-M组比较,◆P<0.05;与LPS+TP-H组比较,□P<0.05;与LPS+PMX-B组比较,▲P<0.05;与NC+MB组比较,△P<0.05;与LPS+MB组比较,◎P<0.05
4 讨论
内毒血症病情凶险,临床治疗效果不佳,并且具有发病率及病死率高的特点[9]。因此,寻找一种新的治疗方案相当重要。本研究采用腹腔注射LPS这一经典的实验方法来复制内毒血症大鼠模型,方便且成功率高。实验结果表明,用LPS刺激大鼠6 h后,MABP、HR、LVDP、±dp/dtmax较NC组显著下降,这与内毒血症的病程发展相一致[10]。全身性不可逆的血压降低是内毒血症的主要症状,而血压的调节又与血管的张力息息相关。因此,本研究采用体外胸主动脉血管环灌流来探究TP对LPS诱导的内毒血症大鼠血管张力的影响及其可能的机制。
TP是从中药雷公藤提取出来的有效活性成分,其来源广泛,具有抗炎、抗生育、免疫抑制等药理作用,但对血管的作用尚不明确[11]。本实验结果表明,与LPS组比较,TP干预组大鼠动脉血压和心功能等血流动力学指标均明显改善,主动脉环对Phe的收缩率亦明显恢复,与LPS+PMX-B组的变化趋势相似。而去内皮血管环实验显示,TP干预组对Phe的收缩率与LPS组无显著差异。与NC组比较,LPS组血管环对ACh的舒张率显著降低,而TP干预组随着浓度的升高主动脉血管环对ACh的舒张率明显升高,由此推测TP对LPS诱导的内毒血症大鼠有保护作用。后续的血管环实验结果显示,经NOS阻断剂L-NAME孵育20 min后,LPS组主动脉环对10-5mol/L Phe引起的收缩率的差值高于LPS+TP-H组和NC组,提示TP可能降低LPS刺激的NOS过量产生,从而减少NO的过量产生,改善血管环的收缩率。再者,经GC抑制剂MB孵育20 min后,LPS组主动脉环对10-5mol/L Phe引起的收缩率的差值高于LPS+TP-H组和NC组, 提示TP干预组可能是通过GC-cGMP途径,改善主动脉平滑肌的收缩率。
NO是一种舒血管的物质,它由血管内皮细胞产生。NO作为气体很容易扩散进入平滑肌细胞,使鸟苷酸环化酶(guanylate cyclase,GC)被激活,使三磷酸鸟苷(guanosine triphosphate,GTP)转变为环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)。细胞内cGMP的含量增多可以激活蛋白激酶G,这是一种可以在很多部位引起蛋白质磷酸化的磷酸化酶,最终结果导致Ca2+外流、膜超极化以及降低收缩结构对Ca2+的敏感性,继而松弛血管平滑肌,导致血管舒张[12]。主动脉血管环对Phe诱导的血管收缩的机制是通过升高血管平滑肌细胞内Ca2+水平来实现的。有研究表明,LPS刺激产生的炎症因子可使NOS过量产生,从而导致NO的过量产生,进而降低细胞内Ca2+水平,从而导致血管的低反应性[13]。
综上所述,本研究初步探明TP对内毒血症大鼠的血管具有保护作用,可能是通过改善内皮功能而实现的,确切机制有待进一步探究。

