L-肉碱的代谢及其在鱼类养殖应用中的研究进展
于 婷,王秋举,陈秀梅,马 悦,王 宁,张东鸣,2
(1.吉林农业大学生命科学学院,吉林长春 130118;2.通化师范学院生命科学学院,吉林通化 134002)
L-肉碱(又名维生素Bt)自1905年被首次发现,经过长期研究,人们对L-肉碱的功能已越来越清晰。目前,L-肉碱已经应用到养殖、食品、生物制药等多种行业中,成为老年人、孕妇、病人等一些特殊人群的必需营养物质。L-肉碱最基本的功能是协助长链脂肪酸从细胞质穿过线粒体,促进脂肪酸进一步氧化供能。除此以外,L-肉碱还可以加快三羧酸循环代谢速率、蛋白合成等过程,在节约蛋白质、增强运动耐受力、繁殖力、抗氧化和免疫方面发挥重要作用。本文概述了L-肉碱结构、来源、合成、转运、代谢等,并综述了L-肉碱对鱼类生长、脂代谢、抗氧化及免疫方面的研究进展,为阐明L-肉碱发挥多种功能的机制提供理论参考,为推广L-肉碱在水产养殖业中的科学应用提供理论根据。
1 L-肉碱的概述
1.1 L-肉碱的结构、理化特性 L-肉碱(C7H15NO ),化学名称又叫L-3-羟基-4-三甲基胺丁酸,相对分子质量为161.2。L-肉碱是一种白色粉末,无味,易溶于水,微溶于乙醇,难溶于有机溶剂,无毒副作用。肉碱有左旋(L型) 和右旋(D型)2种异构体,只有L-肉碱在生物体内具有生理功能。L-肉碱结构见图1,其分子结构中含有一个可供脂肪酸酯化的羟基,所含饱和键和极性官能团有良好的水溶性和吸湿性,性质稳定(200℃以上仍稳定存在)。

图1 L-肉碱分子结构
1.2 L-肉碱的来源及分布 动物体L-肉碱的来源有2条途径,即膳食中摄取及自身合成。L-肉碱主要来源是从膳食中获取,正常饮食的人群每天从膳食中摄取约2~12 μmol/kg体重的L-肉碱,约占机体总L-肉碱含量的2/3。膳食中红肉含有的L-肉碱最丰富,尤其是羊肉和牛肉,鱼肉、猪肉、家禽乳制品也含有一定量的L-肉碱。蔬菜及水果中L-肉碱含量很少,甚至检测不到,但鳄梨和芦笋中L-肉碱含量高于其他水果和蔬菜[1]。L-肉碱存在于几乎所有生物体内,包括动物、植物及大多数微生物[2]。其中动物体内的L-肉碱含量最高,尤其是心脏和骨骼肌中。血浆中总L-肉碱浓度约为30~70 μmol/L,而肌肉和肝脏等组织中的L-肉碱浓度比血浆浓度高25~50倍[3]。
内源性L-肉碱的合成量约为每天1.2 μmol/kg,如50 kg的成年人每天合成L-肉碱的量约为60 μmol,占机体总L-肉碱的1/3。由于L-肉碱主要存在于动物产品中,严格的素食主义者和乳清素食者每天从膳食中能获得的L肉碱很少(<0.1 μmol/kg)。因此,素食主义者还需要通过自身合成超过90%的L-肉碱才能维持机体的健康[4]。
L-肉碱的内源合成是以赖氨酸(碳源供体)和蛋氨酸(甲基供体)为原料,在烟酸、叶酸、维生素B6、维生素C及相关酶类的作用下合成L-肉碱。由图2可知,L-肉碱以赖氨酸和蛋氨酸为底物,经过4种重要酶的催化,生成4种中间代谢产物,最终生成L-肉碱。第一代谢产物6-N-三甲基赖氨酸(6-N-trimethyllysine,TML)残基通过TML双加氧酶(TML dioxygenase,TMLD)将TML羟基化生成3-羟基-6-N-三甲基赖氨酸(3-hydroxy-6-N-trimethyllysine,HTML)。随后,HTML醛缩酶(HTML-aldolase,HTMLA)将HTML分解成4-N-三甲基氨基丁醛(4-N-Trimethylaminobuty-raldehyde,TMABA)和甘氨酸。TMABA脱氢酶(TMABA Dehydrogenase,TMABADH)对TMABA的脱氢导致形成4-N-三甲基氨基丁酸(4-N-Trimethy-laminobutyrate,γ-BB)。最后,γ-BB被γ-丁基甜菜碱双加氧酶(γ-Butyrobetaine Dioxygenase,BBD)羟基化,生成L-肉碱(图2)[5]。肉碱合成所需的前3种酶(TMLD、HTMLA和TMABADH)在机体内分布广泛,而关键限速酶BBD仅存在于肝脏、肾脏和脑中。因此,多种组织可以完成从第一中间代谢产物TML到第四中间代谢产物γ-BB的合成过程,而终产物L-肉碱仅能在肾、肝和脑中得到进一步合成[6]。
关键限速酶BDD在肾脏中活性最高,脑中的活性较低。肾脏中BBD 酶活性不会随着年龄的增长产生变化,而肝脏中BBD酶活性在不同年龄段显示出明显差异,研究发现在婴儿肝脏中的BBD 活性约为成人水平的10%[7],因此,有人认为哺乳动物在幼龄时期L-肉碱的合成能力不足[8-9]。此外,幼龄哺乳动物的L-肉碱合成能力不足除了与BBD酶活性有关外,TMLD活性以及产物TML和γ-BB水平也能影响幼龄动物L-肉碱的合成水平[10]。值得注意的是,以上影响L-肉碱内源合成的因素在鱼类方面的研究甚少,因此上述试验结果是否适用于水产动物,还需进一步研究。
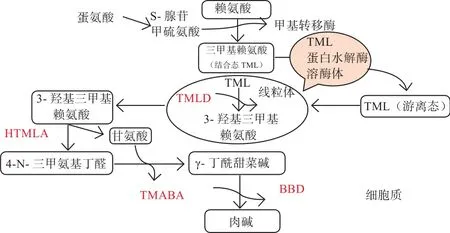
图2 L-肉碱内源合成途径
1.3 L-肉碱的转运 无论是来源于膳食摄取还是内源合成,L-肉碱在体内的运输主要是通过L-肉碱/有机阳离子转运蛋白(Carnitine/Organic Cation Transporters,OCTNs)介导的主动运输来完成。OCTNs是溶质运载转运体家族(Solute Carrier Family,SLC)的主要成员,属于双向转运体,主要介导两性离子的跨膜转运,也可介导部分有机阳离子化合物的转运,因而又被称为两性离子/有机阳离子转运体。OCTNs包括3种转运蛋白,分别是OCTN1、OCTN2和OCTN3。
OCTN1高表达于肾小管上皮细胞的顶侧膜,在成人气管、小肠、心脏、胎盘、胰腺和神经细胞中也有表达[11]。研究表明,OCTN1对L-肉碱的亲和力较低,但对麦角硫因具有高亲和力,在机体内主要介导麦角硫因的肠吸收和肾消除过程[12]。OCTN2是钠离子依赖性的有机阳离子转运蛋白,对L-肉碱的亲和力最高,它在机体L-肉碱的稳态中起着十分关键的作用。与 OCTN1类似,OCTN2 也表达于肾近曲小管上皮细胞的顶侧膜,负责肾脏中肾小球滤过后L-肉碱的重吸收,用以维持血浆L-肉碱的平衡,但OCTN2的表达并不限于肾,在许多组织(如肝脏、心脏、睾丸、骨骼肌和脑)中也有发现[13]。这一广泛分布的性质保证了机体内L-肉碱的稳定吸收和分布,因此OCTN2在机体L-肉碱调度上具有举足轻重的地位。OCTN3是一种过氧化物酶体L-肉碱转运蛋白,它对L-肉碱的亲和力在OCTNs家族中属于中等,在人过氧化物酶体膜上有表达,说明L-肉碱在过氧化物酶体脂质代谢中具有重要作用[14]。
1.4 L-肉碱的代谢 L-肉碱的稳态通过膳食摄取、适度的合成速率以及有效的肾重吸收来共同维持。在正常L-肉碱循环浓度下,肾脏是调节体内L-肉碱浓度的重要器官,90%以上的L-肉碱在肾脏被重吸收,多余未被吸收的L-肉碱主要以酰基肉碱的形式随尿液排出,少量随胆汁排出。当饮食中L-肉碱摄入量增加时,肾脏重吸收率降低并且增加清除率,使机体循环的L-肉碱浓度迅速下降至基本水平;反之,当饮食中L-肉碱摄入减少时,肾脏重吸收率增加并且清除率降低,使循环L-肉碱浓度保持在正常范围内[15]。因此,随着膳食L-肉碱摄入量的变化,尿排泄L-肉碱的量也会随之变化,以维持血浆和机体各组织L-肉碱水平在正常范围内。
2 L-肉碱在鱼类养殖中的研究进展
2.1 L-肉碱对鱼类生长的影响 饲料中添加L-肉碱对鱼类生长的影响是最早被关注的热点问题。总结多项研究结果可知,L-肉碱对鱼类生长的影响并不一致。从表1中可以看出,不同鱼类对L-肉碱的最适需求量不同(150~2 000 mg/kg);此外,同种鱼类、饲养周期相近,不同生长阶段所需L-肉碱的最适添加量也有不同,大规格鱼需要添加较多L-肉碱,小规格鱼(如鲤鱼)需要添加较少L-肉碱。但总体来说,添加L-肉碱能促进一些鱼类生长,提高其饲料效率。然而也有部分研究表明,饲料中添加L-肉碱对鱼类生长、蛋白质利用率和饲料转化率无明显影响,如杂交条吻鲈、大菱鲆、黄颡鱼、黑鲷、大口黑鲈、欧洲鲈和初始体重为(151.00±1.69)g的虹鳟。由表1可知,在40 g左右虹鳟饲料中添加800 mg/kg L-肉碱能促进其生长,但在151 g左右虹鳟饲料中添加500 mg/kg L-肉碱对生长无影响,可能原因是151 g左右虹鳟饲料中L-肉碱的添加量不足导致未表现出促生长作用。L-肉碱对不同鱼类生长效果的影响具有差异性,这可能与鱼的种类、体质、生存环境、饲料组成等因素有关。生存环境和鱼体体质的不同导致鱼体对L-肉碱的需求量产生差异;而饲料原料的不同配比(如饲料中蛋氨酸和赖氨酸的水平)对内源L-肉碱的合成产生影响,鱼体自身合成L-肉碱的含量发生变化,随之对饲料中L-肉碱的需求也会发生改变。
2.2 L-肉碱对鱼类脂代谢的影响 饲料中补充L-肉碱不仅会对鱼类生长产生影响,还会改变机体的脂代谢过程,进而对整个鱼体健康稳态产生积极或消极的影响。研究发现,饲料中添加L-肉碱可以减少草鱼(Ctenopharyngodon idella)肌肉和肝胰脏脂肪含量,促进脂质降解[16]。在高脂饲粮中添加外源L-肉碱使非洲鲶鱼(Clarias gariepinus)呼吸商显著下降,明显降低肝脏、肌肉等组织中n-3多不饱和脂肪酸含量,表明添加外源L-肉碱可通过促进脂肪酸代谢产生能量,减少其他方式(如碳水化合物、蛋白质)的氧化供能,达到节约蛋白质、降低脂肪沉积的目的[36]。但有其他鱼类的研究结果与上述研究不尽相同,如在欧洲海鲈(Dicentrarchus labrax)饲料中补充L-肉碱增加了乙酰辅酶A羧化酶3倍的活性,使欧洲海鲈肝脏脂肪生成率升高,更易导致脂肪沉积[35]。这一结果与以黄鲶(Pelteobagrus fulvidraco)为研究对象的结果一致,且进一步表明饲料中添加L-肉碱能在mRNA水平上通过上调与脂代谢有关的关键酶基因(如脂肪酸合成酶、乙酰辅酶A羧化酶)的表达来增加肝脏、肌肉脂质水平[37]。综上可知,L-肉碱对鱼类脂肪酸的调节作用并不一致,这种差异产生的机制目前尚未见详细报道,可能与研究对象大小、环境及外源L-肉碱添加量不同等有关,需要进一步深入研究。
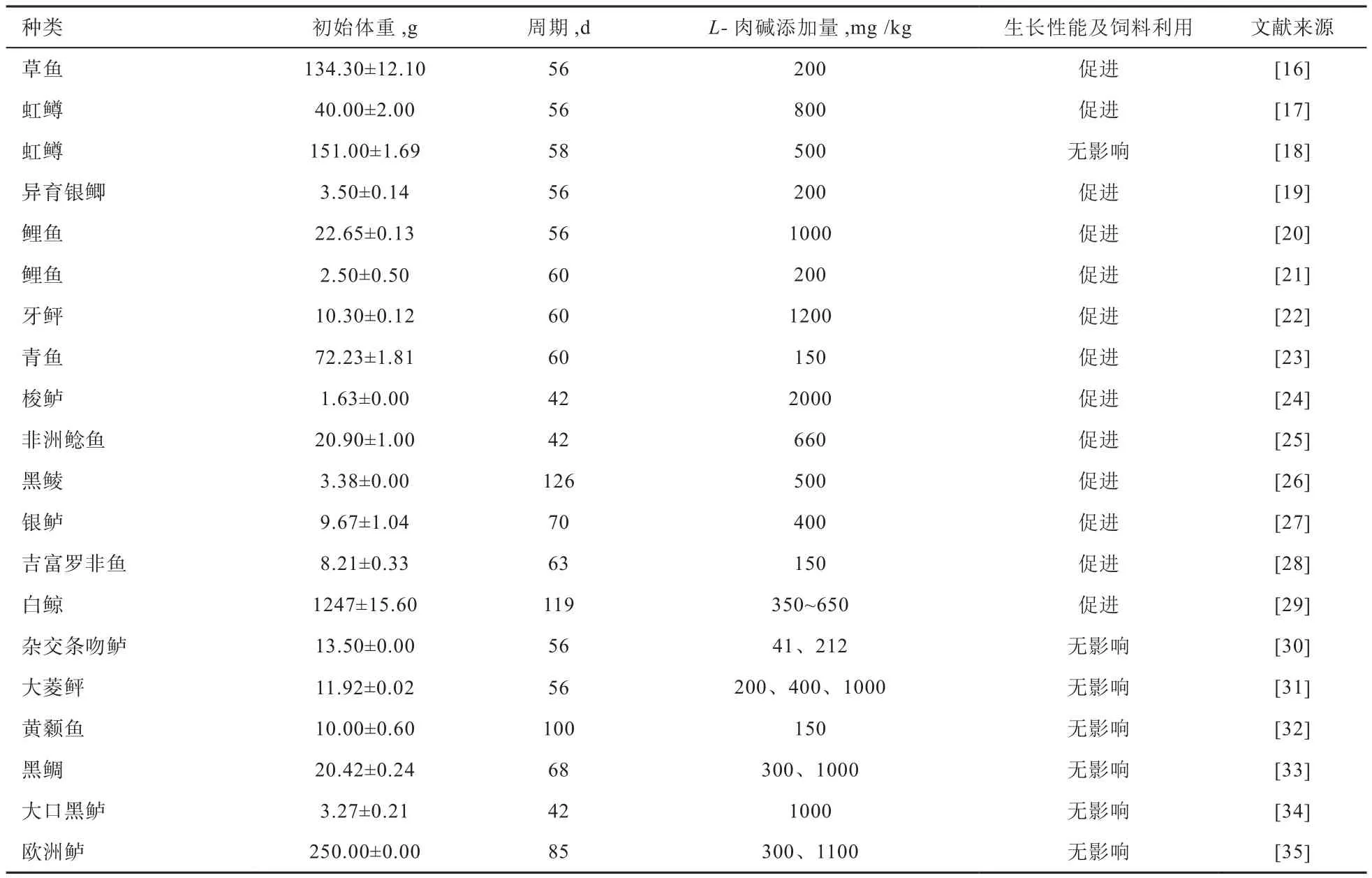
表 1 饲料中添加L-肉碱对鱼类生长及饲料利用的影响
2.3 L-肉碱对鱼类抗氧化和免疫功能的影响 随着生活水平的不断提高,人们对水产品的需求量不断增加,这使我国现代水产养殖业正朝向集约化、规模化方向发展。在现代养殖条件下,鱼类养殖密度增大及水环境的复杂多变,极易造成鱼体产生应激反应,而任何应激均伴有氧化应激发生[38],长期处于不良胁迫下的鱼类其体内原有的氧化还原平衡状态极易受到破坏,导致机体产生氧化应激,进一步影响各组织器官功能的正常行使,导致鱼体免疫力下降、生长发育缓慢、饲料转化率降低、发病率升高,给养殖户造成巨大的经济损失。因此,自20世纪90年代以来,L-肉碱的抗氧化功能受到越来越多研究者的重视。
在体外条件下,Gülçin等[39]证明,L-肉碱能够清除过氧化氢和超氧化物自由基以及螯合过渡金属离子,是一种新型有效的抗氧化剂。多项研究发现,L-肉碱可以有效保护哺乳动物细胞免受氧化损伤[40-42]。在草鱼性腺细胞系(GCO)[43]及胖头鱥肌肉细胞系(FHM)[44-45]的研究发现,L-肉碱可对H2O2引起的氧化应激起到明显的保护作用,首次证明了L-肉碱对鱼类细胞的抗氧化作用。Safari等[46]研究表明,饲粮中补充L-肉碱能明显提高淡水小龙虾抗氧化酶活性,增强机体的抗氧化功能。在氧化损伤条件下,补充适宜浓度的L-肉碱能显著提高罗非鱼和鲤鱼的抗氧化酶活性[47-48],从而展现出L-肉碱的有效保护效果。进一步说明体内研究L-肉碱对鱼类的抗氧化功能同样具有促进作用。
随着研究的不断深入,人们发现L-肉碱发挥抗氧化作用与NF-E2-Related Factor 2-Keap1-Antioxidant-Response Element(Keap1-Nrf2-ARE)信号通路有关。而Keap1-Nrf2-ARE通路是机体在长期的进化过程中,为缓解所受损害而形成一套复杂且关键的氧化应激应答系统[49]。而Nrf2作为外源性有毒物质和氧化应激的感受器,介导并调控许多抗氧化基因的表达,在细胞防御保护中扮演重要角色[50]。Zambrano等[51]研究发现,L-肉碱可以通过特异性调节Nrf2转录因子,使超氧阴离子的产生降低,从而达到抵抗高血压大鼠肾皮质氧化应激的目的。Li等[52]发现,L-肉碱通过Akt介导激活的Nrf2信号通路保护人类肝细胞免受氧化应激诱导的毒性。而L-肉碱通过调节Keap1-Nrf2-ARE通路从而发挥抗氧化功能的研究在鱼类中鲜有报道。
L-肉碱对鱼类免疫功能也有影响。明建华等[23]研究发现,添加L-肉碱可显著提高青鱼血清溶菌酶活性及补体 C3和 C4水平,从而增强鱼体的非特异性免疫力。Safari等[46]研究发现,饲料中添加L-肉碱不仅能减少小龙虾脂质过氧化,增强其抗氧化防御功能外,还能显著提高其免疫能力。
3 结语与展望
L-肉碱作为一种条件必需营养素,具有多重功能特性;L-肉碱是一种小分子物质,容易被动物机体吸收,性质稳定,并无明显毒副作用;L-肉碱的工业化生产技术成熟、价格相对低廉, 因此L-肉碱作为稳定饲料添加剂应用具有重要优势,但L-肉碱在鱼类养殖方面的研究仍然缺乏,建议从以下几个方面进行深入研究:①确定鱼类不同生长阶段L-肉碱的需要量,实现精准添加和投喂,避免浪费。②鱼类饲料中通过添加L-肉碱来提高脂肪的利用效率进而节约蛋白质,是解决减少蛋白质使用、鱼粉替代的另一重要途径。③在鱼类中L-肉碱合成路径、合成能力、转运过程及部分生理功能发挥的机制尚不清晰,从而完善鱼类L-肉碱的代谢和生理功能等基础信息,为其科学应用提供更详尽的参考依据。

